原发性胆汁性胆管炎易感基因多态性的研究现状
高琪 张华,2★
原发性胆汁性胆管炎(primary biliary cholangitis,PBC),既往称为原发性胆汁性肝硬化[1],是一种以肝脏损害为主的器官特异性自身免疫性疾病,临床特点以慢性进行性肝内胆汁淤积为主,典型病理表现为进行性、非化脓性、破坏性肝内小胆管炎,伴门管区淋巴细胞浸润和肝纤维化,疾病进展最终可导致肝硬化甚至肝功能衰竭,其特征主要是血清高特异性抗线粒体抗体(Anti-mitochondrial antibody,AMA)的产生和胆管上皮细胞的特异性损伤[2-3]。目前PBC的发病机制尚未完全阐明,但越来越多的研究表明,可能是遗传和环境多方因素共同作用诱发体内免疫功能失衡,导致免疫耐受丧失,从而致使针对自身肝内胆管上皮细胞的免疫反应发生[4]。近年来,随着对PBC认识的不断加深以及AMA检测的逐渐普及,文献报道的病例数呈快速增多的趋势。PBC起病隐匿,临床症状不典型,且病程漫长,从疾病早期出现AMA发展至最终肝硬化阶段,约需14~18年,患者常错过早期诊断和治疗的最佳时期。因此,进一步阐明PBC的发病机制,找到疾病的治疗靶点,对于获得更好的治疗效果尤其重要。大量研究表明,遗传易感性在PBC的发病过程中起着重要的作用,全基因组关联分析(genome-wide association studies,GWAS)和基因芯片已经鉴定出PBC相关易感基因主要有人白细胞抗原(human leukocyte antigen,HLA)和非HLA两大类[5]。现就PBC的遗传易感性及易感基因多态性的研究现状作一综述。
1 PBC的遗传易感性
PBC发病的家族聚集性、女性患病率明显高于男性以及同卵双胞胎患病的高度一致性,均提示了PBC的遗传易感性[6-7]。单核苷酸多态性(Single nucleotide polymorphism,SNP)是人类基因组中最常见的一种基因多态性,主要是指不同个体DNA序列上单个碱基的差异,是人群个体差异产生最主要的遗传因素,也是造成人们患病的主要原因之一。GWAS是一种对人类全基因组范围内序列变异及SNP分析的方法,其最显著的特点之一是能够在整个人类基因组范围内识别并筛选出与疾病相关的遗传基因。目前,GWAS研究已鉴定出了数千种与人类复杂疾病易感性相关的基因位点,同时也筛选出了PBC人群的易感基因位点,并证实了PBC的种族差异性。HLA等位基因与PBC发病具有强相关性,尤其是HLA-DRB1、HLA-DQA1、HLA-DQB1等[5]。欧洲PBC人群最显著相关的基因主要是IL12RB2和IL12A[8]。日本GWAS研究表明,TNFSF15、POU2AF1、PRKCB、NFKB1、MANBA、IL21R、IL7R和染色体17q12-21基因座是日本PBC人群的易感区域,其中的TNFSF15和POU2AF1是日本PBC人群的主要易感基因,但这两者均未在欧洲PBC人群中有描述[9]。Dong等[8]选取日本和欧洲人群显著相关的14个SNP位点在中国汉族人群中进行了大样本研究表明,最显著相关的SNP位点是CD80(rs2293370)和TNFSF15(rs4979462)。另 外,IL12RB2(rs11209050)、STAT4(rs7574865)、17q12-21(rs9303277)、PDGFB(rs715505)和NF-κB1(rs7665090)等也与汉族PBC人群相关。
2 PBC相关易感基因多态性
2.1 HLA易感基因多态性
HLA基因复合体位于人类染色体6p21,占人类整个基因组的1/3000,包含了人类基因组中最具多态性的基因位点,在多种自身免疫性疾病中已有报道。根据HLA的结构及其特点,HLA复合体可分为Ⅰ、Ⅱ、Ⅲ类基因区。全球多项GWAS研究表明HLA-Ⅱ类基因区与PBC的发病显著相关,主要是HLA-DQA1、HLA-DRB1和HLA-DQB1基因,其等位基因的多态性通过编码不同的氨基酸残基,可能通过影响对抗原的结合亲和力,进而影响PBC的遗传易感性。其中,DRB1*0801、DRB1*0803、DRB1*14和DPB1*0301是PBC的易感等位基因,而DRB1*11和DRB1*13是其保护性等位基因[5-6]。Darlay等[10]的研究表明,单体型HLA-DQB1*0402-DRB1*0801、DQB1*0602-DQB1*0301、DRB1*0404-DQB1*0302与英国PBC人群紧密关联,早前研究已表明HLA-DRB1*0801是英国及意大利PBC人群共同的风险等位基因,而HLA-DRB1*13是其共同的保护基因,DRB1*11仅在意大利人群中发现。中国PBC人群中,单体型HLA-DRB1*0803-DQB1*0601与PBC人群高度相关,单体型DRB1*0701-DQB1*0202也有关联,而单体型DRB1*1202-DQB1*0301相对于健康对照组明显降低[11]。单体型DRB1*0803-DQB1*0601和DRB1*0405-DQB1*0401可显著增加日本PBC患者的遗传易感性,DRB1*1302-DQB1*0604和DRB1*1101-DQB1*0301是其保护性关联单体型。Im等[12]在日本PBC人群的全基因组单倍型关联分析中发现,PBC相关基因座(TNFSF15,HLA-DRA)的风险单倍型可能潜在地模拟调节基因表达的顺式相互作用。HLA-DRB1与PBC易感性显著相关,但撒丁学者的研究发现,与PBC高度相关的HLA-DRB1*08等位基因却在撒丁人群中出现的频率较低,单体型DRB1*0301-DQB1*0201的高发病率是撒丁人群特有的遗传学特征[13]。
2.2 非HLA易感基因多态性
尽管HLA基因多态性与PBC的发病紧密关联,但仍有大部分患者并未携带这种常见的HLA基因多态性,提示非HL A易感基因中可能存在与PBC发病相关的遗传变异。GWAS研究和基因芯片研究[8,11,14]表明,超过20种非HLA基因多态性位点与中国汉族PBC患者的发病相关(表1)。
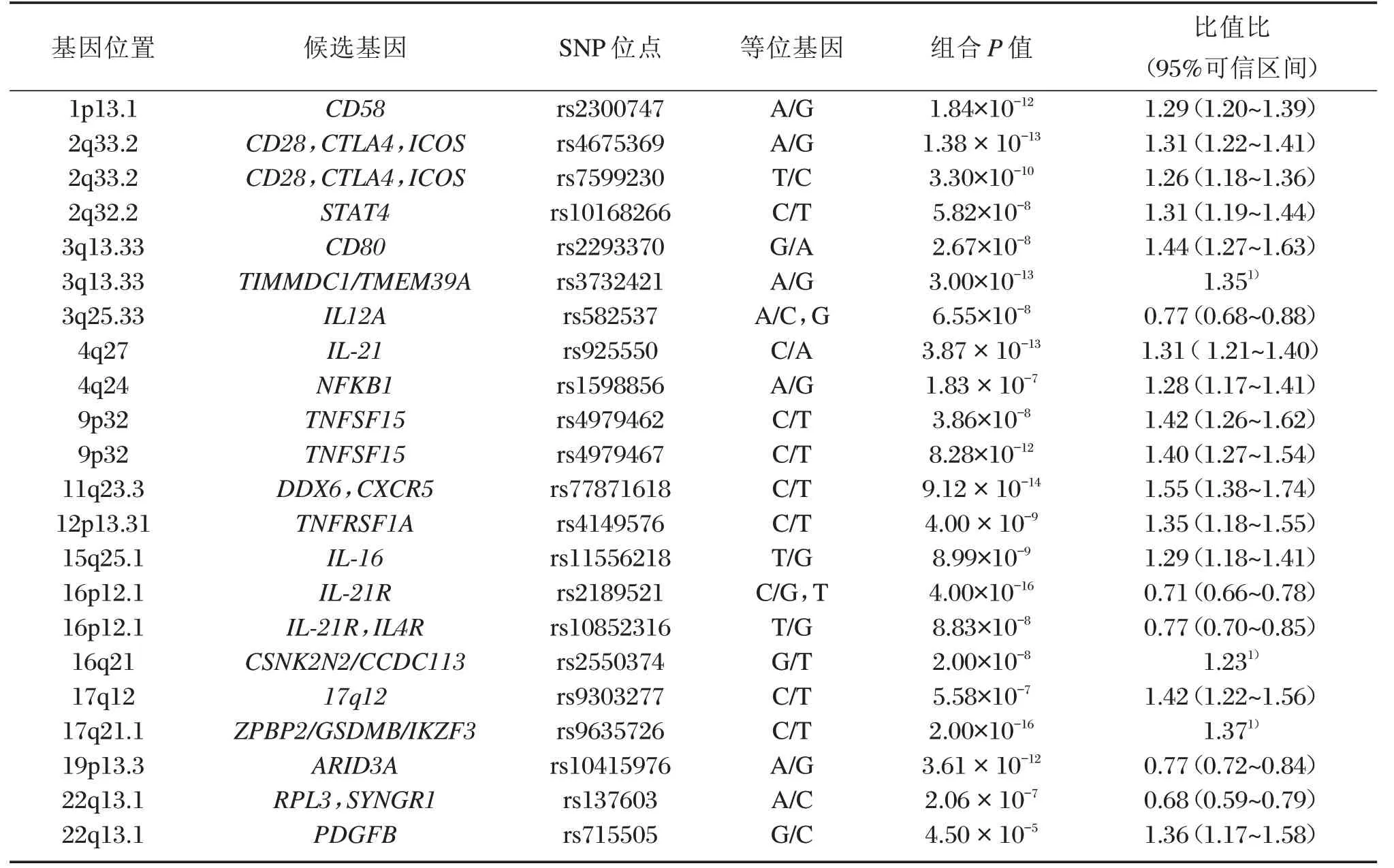
表1 与中国汉族PBC显著相关的非HLA位点(P<1×10-5)Table1 Non-HLA sites significantly associated with Chinese PBC(P<1×10-5)
2.2.1 肿瘤坏死因子超家族15
肿瘤坏死因子超家族15(tumornecrosis factor superfamily 15,TNFSF15)是一类在诱导细胞增殖和凋亡中起重要作用的细胞因子[15]。GWAS研究表明,TNFSF15基因多态性与日本和汉族PBC人群显著相关。Hitomi等[16]的研究结果提示TNFSF15(rs4979462、rs55682128、rs1857335、rs117567605、rs76015065、rs3810936、rs76998125)与日本PBC显著相关,其中最显著相关的SNP位点是rs4979462,该位点可能是通过与转录因子结合位点核因子-1(nuclear factor-1,NF-1)紧密结合影响其表达进而导致PBC的发病。Fang等[11]研究发现,中国PBC人群中最强关联的SNP位点是TNFSF15(r s4979467),这与日本Hitomi和中国Dong等人报道的研究结果有所差异,但rs4979467位点具有强连锁性,它与rs6478108(r2=1)和rs4979462(r2=0.68)有很强连锁,后两者已报道与多种自身免疫性疾病有关。
2.2.2 白细胞介素家族
白细胞介素(Interleukin,IL),是一类在免疫细胞的成熟、活化、增殖和免疫调节等一系列过程中发挥重要作用的细胞因子。研究报道,PBC患者中卵泡T辅助细胞产生的I L-21明显增多,它可进一步介导B淋巴细胞的成熟和自身抗体的分泌,进而参与PBC的发病[17]。GWAS研究表明,IL21(rs925550、rs17005934)以及IL21R(rs2189521)与汉族PBC人群最显著相关[18]。欧洲PBC人群显著相关的SNP位点是IL12RB2(rs11209050)和IL12A(rs485499,rs2366408)[8]。LiP等[18]对IL12A基因座周围的22个SNP位点研究发现,有3个SNP位点与汉族PBC人群相关,其中最显著相关的是rs4679868和rs6441286,连锁分析发现这两个SNP位点彼此紧密关联(r2=0.981),并且均与欧洲PBC人群显著相关。IL12RB2(IL12R-β2)主要编码IL-12受体β2,IL12RB2rs3790567位点的等位基因A和r s6679356位点的等位基因C可显著增加患者肝硬化的风险[19]。以上结果均提示了IL家族在PBC发病中的重要作用,但由于I L家族的复杂性和它们涉及信号通路功能研究的不充分,IL家族相关信号通路在PBC发病中的具体机制尚不明确。
2.2.3 细胞信号转导通路与转录激活因子4
信号转导和转录激活因子4(signal transducerand activator of transcription 4,STAT4),在辅助T淋巴细胞的分化调控及各种炎症性疾病中可发挥重要的作用,其编码的转录因子可参与多种重要细胞因子的信号转导过程。STAT4基因多态性已报道与系统性红斑狼疮、类风湿性关节炎、干燥综合征等多种自身免疫性疾病相关。研究发现,江苏地区汉族人群STAT4的rs7574865位点的等位基因T与PBC显著相关[20]。STAT4基因多态性与PBC的荟萃分析[21]表明,rs7574865、rs3024921、rs6752770、rs7601754和rs10168266位点与PBC在统计学上存在显著相关性。
2.2.4 细胞毒性T淋巴细胞抗原4
细胞毒T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated protein 4,CTLA4),主要表达于活化的调节性T细胞,通过与CD28竞争性结合表达于抗原提呈细胞表面的CD86/CD80来抑制细胞免疫。CD28-CTLA4-ICOS基因座紧密相连并有多个SNP位点,它们一直被认为是PBC的风险基因位点,共同参与T细胞共刺激信号通路的激活[14]。中国PBC人群的队列研究显示CTLA4(rs231775)与汉族PBC紧密关联。日本的荟萃分析[22]表明,CTLA4基因的rs231775、rs3087243和rs231725位点都与日本PBC患者的发病高度相关,其中rs231725位点与疾病的晚期进展阶段密切相关,这与中国PBC的研究结果一致。
2.2.5 蛋白质O-葡萄糖基转移酶1与CD80
Dong等[6]报道了CD80(rs2293370)是与中国PBC人群显著相关的易感基因位点。蛋白质O-葡萄糖基转移酶1(Protein O-Glucosyltransferase 1,POGLUT1)与CD80都是人类染色体3q13.33上的易感基因位点,最新的一项研究[23]表明,POGLUT1rs2293370位点与日本PBC患者显著相关,这提示了POGLUT1基因在PBC的发生和发展中可能扮演着重要的角色,人类染色体3q13.33上的基因位点的改变可能在PBC的发病机制中起着一定的作用。
2.2.6NFκB1/MANBA基因区域
NFκB1/MANBA基因区域位于人类染色体4q24,已被确定为几种消化系统疾病的易感基因区域,如溃疡性结肠炎(rs3774937,rs3774959)[24]和克罗恩病(rs13126515)[25]以及PBC[26]。研究表明,NFκB1/MANBA基因区域的SNP位点rs17032850和rs227361是与PBC最显著相关的易感基因位点;Hitomi等[26]从分子机制层面,通过体外功能验证实验发现它们可通过与转录因子LEF-1和RXRα的紧密结合,进一步调控基因的表达,从而促进PBC的发生和发展。
3 小结与展望
综上所述,PBC的发病机制复杂,涉及遗传、环境和免疫等多种因素,也是涉及多种基因变异的复杂性疾病。遗传易感性在PBC的发病中起着重要作用,但目前发现的基因多态性位点只是一小部分,仍有大量未知基因及对应的生物学信号通路需进一步研究。随着对PBC遗传易感性的深入研究,结合其他病因机制,挖掘SNP及其对应的信号通路,将有助于个体化风险评估和筛查PBC高危人群,评估其发病风险,风险等位基因位点的靶向治疗或可成为PBC的潜在有效治疗途径。

