肺癌癌组织中M2-PK、和ENO1的表达水平及对其生存期的预测价值
范华颖 张家艳 方怡 高阳
近年来恶性肿瘤成为威胁人类健康的主要疾病之一,其中肺癌已成为我国发病率上升最快的恶性肿瘤,而非小细胞肺癌(non-small cell lung cancer,NSCLC)是患病比例最高的肺癌类型,约占肺癌患者的90%[1-2]。随着临床检测技术的不断发展,肿瘤标志物检测已成预测肿瘤发生、诊断及肿瘤治疗效果监测的有效参考指标[3]。肿瘤型丙酮酸激酶(tumor M2 pyruvate kinase,M2-PK)和烯醇化酶-α(enolase-α,ENO1)是细胞进行有氧糖酵解途径的关键调节酶[4-5],其在多种肿瘤细胞中存在明显的异常高表达现象,对肿瘤的发生、发展具有重要意义[6-7]。但关于M2-PK和ENO1在NSCLC患者肺癌组织中的表达,以及对患者生存期预测的研究少有报道。因此,本文以NSCLC患者为研究对象,探讨肺癌患者肺癌组织中M2-PK和ENO1的表达水平与患者临床病理分级及对患者生存期的预测价值。
1 资料与方法
1.1 一般资料
选取2011年1月至2013年6月间本院收治,经病理学检查确诊的182例NSCLC患者。研究组中男性108例,女性74例,患者年龄32~75岁,平均(49.18±9.67)岁,其中鳞癌128例,腺癌54例;肿瘤分期结果(Tumor Node Metastasis,TNM):Ⅰ期32例;Ⅱ期58例,Ⅲ期52例,Ⅳ期40例;高分化87例,低分化95例;其中淋巴结发生转移患者87例;浸润深度T1和T2共97例,T3和T4共85例。对照组选择68例同期医院就诊的肺良性病变患者,男性35例,女性33例,患者年龄31~74岁,平均(48.68±9.52)岁,疾病类型为慢性支气管炎32例,支气管扩张22例,肺结核14例。2组入选患者年龄、性别等信息资料差异无统计学意义(P>0.05),具有可比性。
1.2 纳入排除标准
肺癌患者纳入标准:患者经病理学诊断标准[8]确诊为NSCLC患者;入院治疗前未接受放疗、化疗、手术和靶向药物等治疗;术前均存在可测量病灶,临床资料完整。排除标准:患者存在肿瘤转移或患有其他肿瘤;合并有其他器官功能异常及严重心血管疾病;患有先天性肺功能异常或畸形患者。肺良性病纳入标准:经医院诊断确诊为慢性支气管炎、支气管扩张、肺结核的患者;无其他重大疾病患者;近3个月未发生严重感染患者。排除标准:患者存在其他肿瘤;肺部存在严重感染或损伤。所有入选对象均签署知情同意书,自愿参与本课题研究。
1.2 材料与方法
1.2.1 试剂及仪器
兔抗人ENO1抗体购自美国Proteintech Group公司,货号:55237-1-AP;兔抗人M2-PK抗体购自中国北京博奥森有限公司,货号:bs-0101R;图像采集成像系统(chemiDocTm)及图像分析系统(Quantity One 1-D分析软件)购自美国Bio-Rad Laboratories公司。
1.2.2 免疫组化分析
将患者进行病理学诊断时获得的病理组织由石蜡包埋后连续切片,固定于载玻片上,50℃烘箱中烘1h后,二甲苯、100%乙醇、95%乙醇、80%乙醇及75%乙醇依次进行水化,蒸馏水洗涤3次,然后置于柠檬酸钠溶液中加热2次,每次8min,PBS洗涤3次,3%H2O2溶液中浸10min,PBS洗涤3次后,滴加ENO1抗体和M2-PK抗体稀释液,4℃孵育过夜。PBS洗涤3次后用羊抗兔二抗室温孵育1h,PBS洗涤3次,免疫组化染色,苏木精复染,0.1%HCl分化,蓝化,梯度酒精脱水干燥,二甲苯透明,中性树胶封固。
1.2.3 数据对比分析
免疫组化结果评估由两名专业病理人员采用双盲法进行判定,每张组织切片高倍镜下随机选取5个视野区,每个视野区计100个肿瘤细胞,根据M2-PK蛋白和ENO1蛋白定位结果,进行结果分析,结果一致则记录结果;不一致则由2人相同意见或第3位更加权威的医师确定。其中M2-PK定位与胞浆或胞核,ENO1定位与胞浆或胞膜。阳性结果判读采用免疫组化半定量分析,阳性细胞比例评定>5%患者检测为阳性[8-9]。
1.2.4 随访及信息统计
所有患者以门诊、住院复查的方式由主治医师定期随访,随访内容包括患者治疗方案、复查信息、肺部电子计算机断层扫描(computed tomography,CT)、磁共振成像(magnetic resonance imaging,MRI)检测、生存信息统计等。时间起始于患者入院治疗,随访5年,统计患者5年内的存活情况。
1.3 统计学分析
采用SPSS 22.0统计学软件进行分析,对于服从正态分布的连续型资料,计量资料以()表示表示,组间比较采用单因素方差分析(one-way ANOVA);计数资料以率(%)表示,组间比较应用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 肺组织中M2-PK和ENO1的表达
M2-PK在在肺良性病变组织中的阳性表达22例,阳性率为32.36%;在肺癌组织中阳性表达142例,阳性率为78.02%,显著高于肺良性病变患者,差异有统计学意义(P<0.05)。ENO1在肺良性病变组织中的阳性表达20例,阳性率为29.41%;在肺癌组织中阳性表达123例,阳性率为67.58%,显著高于肺良性病变患者,差异有统计学意义(P<0.05)。见表1,图1。
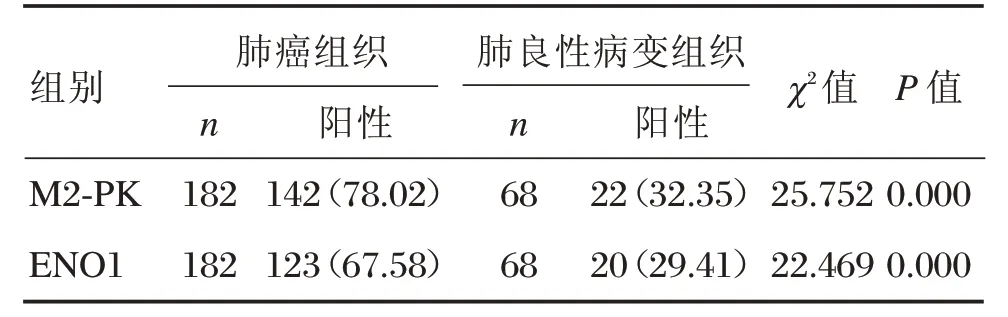
表1 M2-PK、ENO1在肺良性病变组织和肺癌组织中的表达[n(%)]Table1 Expression of M2-PK and ENO1in benign lung lesions tissues and lung cancer tissues[n(%)]
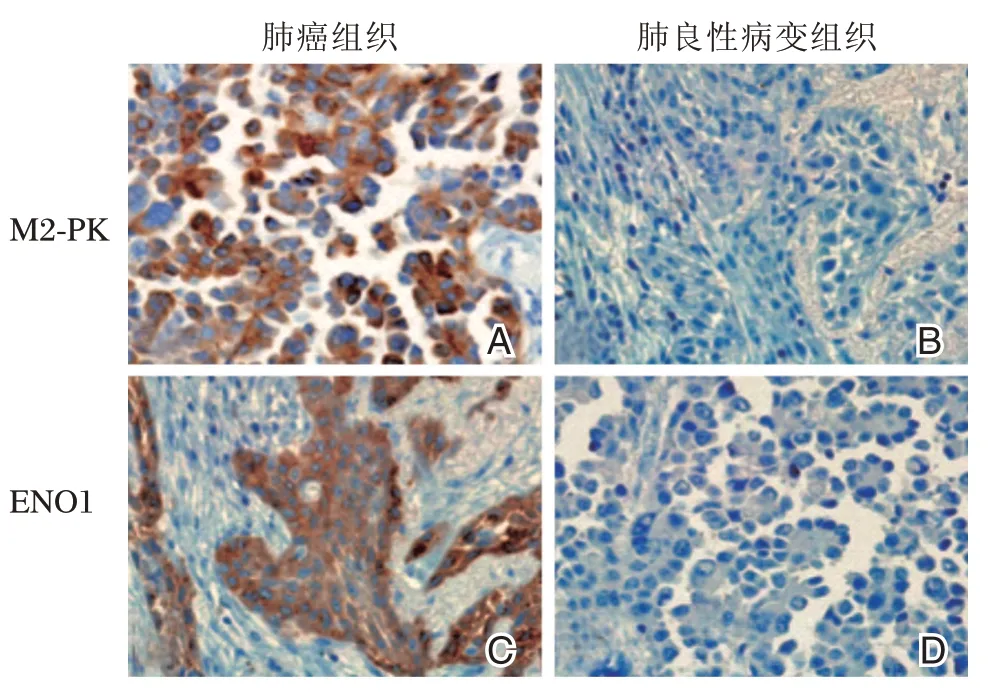
图1 M2-PK、ENO1在肺组织中的免疫组化分析(×40)Figure1 Immunohistochemicalanalysis of and in lung tissues(×40)
2.2 肺癌组织中M2-PK、ENO1表达与临床病理特征的关系
分析患者的临床病理特征与肺癌组织中ENO1、M2-PK表达,结果显示,肺癌组织中ENO1、M2-PK表达与肺癌的分化程度、浸润、TNM分期、淋巴结转移差异有统计学意义(P<0.05),与患者的年龄、性别差异无统计学意义(P>0.05),见表2。
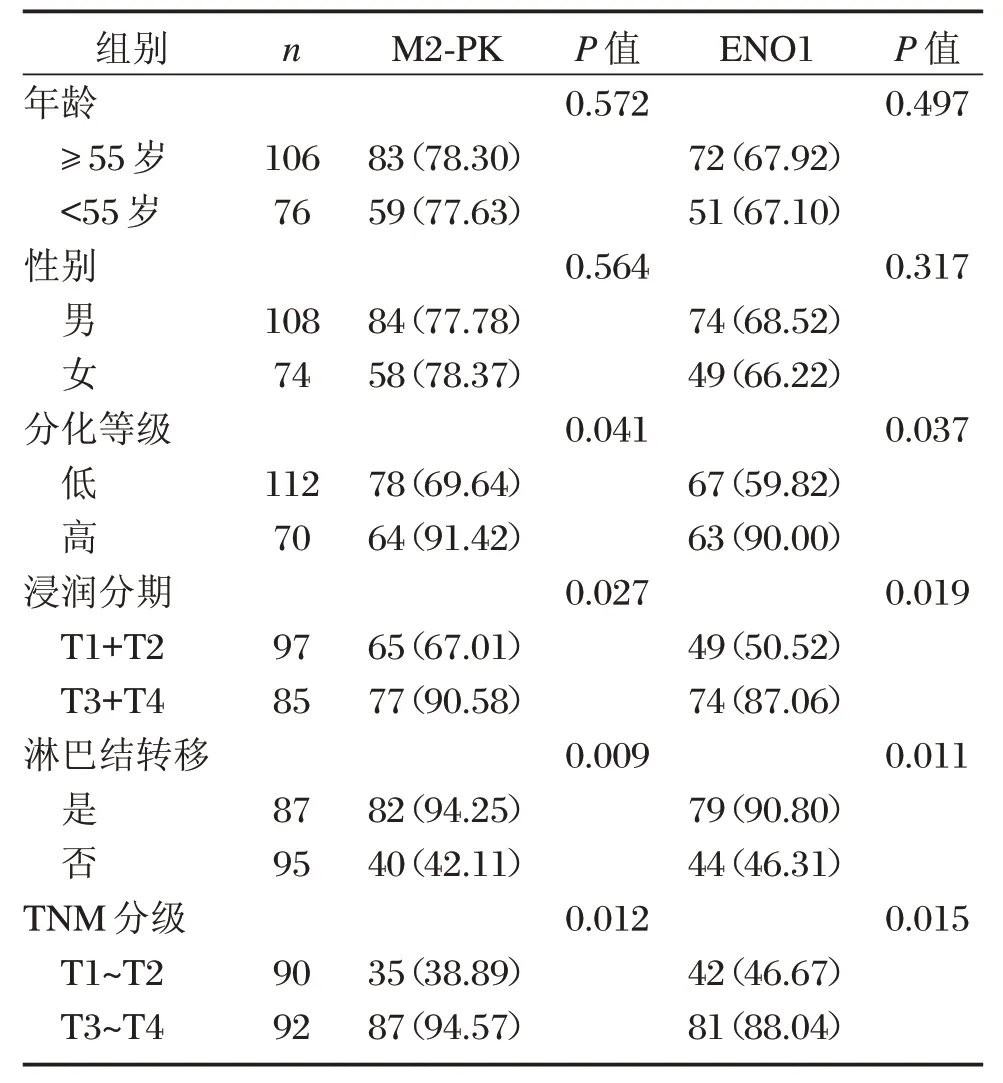
表2 M2-PK、ENO1表达与肺癌临床病理特征的关系[n(%)]Table2 Relationship between expression ofM2-PK and ENO1and clinicopathological features of lung cancer[n(%)]
2.3 肺癌组织中M2-PK、ENO1表达相关性
肺癌组织中共111例M2-PK、ENO1共阳性表达,28例M2-PK、ENO1共阴性表达,M2-PK单阳性31例,ENO1单阳性12例,相关性分析结果显示M2-PK与ENO1表达呈正相关(r=0.769,P<0.05)。
2.4 肺癌组织中M2-PK和ENO1高表达与患者生存期的关系
阳性细胞比例达50%以上为高表达,不表达或低于50%为低表达,分析2种蛋白高、低表达对患者5年生存的影响,结果显示,M2-PK阳性细胞比例≥50%共83例,患者5年存活31例,存活率为37.35%;M2-PK低表达99例,患者5年存活62例,存活率为62.62%,显著高于M2-PK高表达患者,差异有统计学意义(P<0.05)。ENO1阳性细胞比例≥50%共65例,患者5年存活21例,存活率为32.31%;ENO1低表达117例,患者5年存活62例,存活率为52.99%,显著高于ENO1高表达患者,差异有统计学意义(P<0.05)。
2.5 肺癌组织中M2-PK、ENO1高表达与患者生存期的关系
选择ENO1和M2-PK共表达的111例患者为研究对线,2种蛋白阳性细胞比例均在50%以上为共高表达,均低于50%为低表达,分析2种蛋白高表达对患者5年生存率的影响,结果显示,M2-PK和ENO1共高表达患者52例,5年存活患者15例,存活率为28.8 4%;共低表达患者59例,5年存活患者35例,存活率为59.32%,显著高于M2-PK和ENO1共高表达患者,差异有统计学意义(P<0.05),见图2。

图2 肺癌组织中M2-PK、ENO1高表达与患者5生存期的关系Figure2 Relationship between high expression of M2-PK and ENO1and 5-year survival time in lung cancer tissues
3 讨论
M2-PK是丙酮酸激酶的一种同工酶,对三磷酸腺苷的合成起着重要作用,当M2-PK以二聚体存在时主要调节机体碳水化合物的合成转态;以四聚体形式存在时调节机体糖酵解的产能状态[9]。在肿瘤的发生发展过程中,初始组织特异性的丙酮酸激酶会逐渐被M2代替,并以二聚体形式存在于肿瘤细胞中,促使和增强肿瘤糖酵解途径,在肿瘤细胞增殖与代谢过程中发挥重要作用[10-11]。研究发现正常人血清中M2-PK水平很低,而在肿瘤患者血清中显著升高,临床显示其在肺癌、乳腺癌、宫颈癌等实体肿瘤的诊断中具有重要作用[12-13]。在黑色素瘤的研究发现,M2-PK水平不仅与患者的临床分期有关,同时而还能在预测患者生存预后发挥重要价值[14]。
ENO1是一种高度保守磷酸烯醇化酶,该蛋白在胞浆中的表达主要作用是参与细胞的糖酵解途径发挥催化作用,促进磷酸化烯醇式丙酮酸的形成[15],参与体内多种生物学活动,如低氧耐受及炎症反应。此外许多报道表明,ENO1与肿瘤的发生发展密切相关,如乳腺癌、肺癌、肝癌等多种恶性肿瘤中存在异常高表达现象[16]。Yu等[17]人的研究发现ENO1可以作为早期肺癌诊断标志物。在非小细胞肺癌中,ENO1能够通过抑制ERK的磷酸化抑制肺癌细胞的上皮间质转化[18]。在对前列腺癌的研究发现,ENO1能够刺激血纤维蛋白溶酶体受体的活化促进癌细胞的迁移[17],而肿瘤的侵袭和签署是患者治疗和预后的重要因素[19]。
由于肿瘤细胞在快速增殖过程中的能量代谢主要依赖于葡萄糖的糖酵解途径,M2-PK和ENO1作为糖酵解途径的关键酶,其表达水平与肿瘤细胞的增殖密切相关。此外,在实体肿瘤组织中,由于肿瘤细胞的快速增殖,往往会造成组织处于低氧状态促进缺氧诱导因子的表达,进而增强细胞的糖酵解途径[20-21],在对M2-PK、ENO1的基因研究发现,两者的启动区均存在缺氧反应原件;同时缺氧诱导因子的表达能够促进肿瘤细胞的侵袭和转移,而ENO1在细胞表面的高表达能够增强细胞的侵袭能力。本文对NSCLC患者肺癌癌组织中表达水平分析显示,M2-PK、ENO1肺癌组织中阳性率显著高于肺良性病变患者(P<0.05);与Yu等[22]和Kobierzycki等[23]的关于M2-PK、ENO1在NSCLC患者中的表达结果一致。
研究证实由于M2-PK和ENO1蛋白能够通过肿瘤细胞的坏死与细胞更新,分泌到细胞外,其表达水平只与肿瘤的病征有关。本文对2种蛋白的表达相关性分析发现与Gu等[23]的研究结果一致,这可能与两者均为糖酵解途径中的关键酶有关。同时本文也首次研究患者治疗前M2-PK和ENO1共表达水平与患者5年存活率的关系,结果显示M2-PK和ENO1高表达患者的5年存活率均显著低于M2-PK和ENO1低表达患者(P<0.05),其原因可能是M2-PK和ENO1高表达水平预示着肿瘤细胞处于较高的增殖活性,患者的肿瘤分化差、晚期患者比例高、远处转移风险高,治疗难度大,不利于患者的预后和长期生存[25]。
综上所述,肺癌组织中M2-PK、ENO1的高水平表达与肺癌的发生、发展及预测患者的生存期有一定指导意义。

