miR-219a-5p对皮肤鳞状细胞癌细胞凋亡的影响及机制
林永丽 杨灿 李艳
皮肤鳞状细胞癌(cutaneous squamous cell carcinoma,CSCC)是常见的皮肤恶性肿瘤之一。目前的治疗方式还是以手术为主,放化疗为辅[1]。微小RNA(microRNA,miRNA)是一类非编码RNA,可通过调控靶基因的表达影响细胞增殖、分化和凋亡等生命过程[2]。据报道miRNA参与了皮肤肿瘤的发生发展,研究miRNA对在其中的作用机制,有利于皮肤肿瘤诊断和治疗[3]。miR-219a-5p可抑制乳腺癌细胞迁移和上皮-间质转化[4];miR-219a-5p可抑制恶性黑素瘤的生长和转移[5]。染色质结构维持蛋白4(structuralmaintenance of chromosome 4,SMC4)是SMC家族成员之一,主要参与染色体高级结构动态变化,与肿瘤的发生过程有关[6]。干扰SMC4表达可抑制乳腺癌细胞的增殖、迁移及侵袭能力[7]。Wnt信号通路是一种基础信号通路,调控细胞增殖、分化,影响细胞凋亡[8];Wnt/βcatenin是Wnt中重要的信号调节通路,参与多种人类肿瘤的发生发展[9]。Wnt/β-catenin信号通路的异常激活可导致鼻咽癌的发生发展[10];miR-200a抑制Wnt/β-catenin通路可以缓解肾间质纤维化[11]。但miR-219a-5p对CSCC增殖、凋亡的影响及其机制是否与SMC4、Wnt/β-catenin通路有关还尚未清楚,本实验旨在研究miR-219a-5p对CSCC增殖、凋亡的影响以及miR-219a-5p是否通过调控SMC4、Wnt/βcatenin信号通路影响CSCC的增殖和凋亡。
1 材料与方法
1.1 材料
皮肤鳞状细胞癌细胞HSC-2、Colo-16、SCL-1和人正常皮肤细胞HaCaT均购自中国科学院上海细胞库;胎牛血清、RPMI-1640培养基购自美国Sigma公司;双荧光素酶报告基因检测试剂盒购自北京Solarbio公司;MTT试剂盒、膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)和碘化丙锭(PI)试剂盒购自上海碧云天生物技术有限公司。抗体均购自上海煊翎生物科技有限公司。FACSCalibur流式细胞仪购自美国BD公司;ThermoFC酶标仪购自美国Thermo公司。
1.2 方法
1.2.1 细胞培养
皮肤鳞状细胞癌细胞HSC-2、Colo-16、SCL-1和人正常皮肤细胞HaCaT用含10%胎牛血清的RPMI-1640培养基于37℃、5%CO2饱和湿度条件下培养,每天换液一次,待细胞融合至80%左右时,加入0.25%的胰蛋白酶进行消化传代,选取处于对数生长期的细胞进行实验。
1.2.2 细胞转染与分组
取对数生长期细胞HSC-2,用无血清培养基同步化12h后,将miR-con、miR-219a-5p、anti-miR-con和anti-miR-219a-5p分别转染至细胞HSC-2中,记为miR-con组、miR-219a-5p组、anti-miR-con组和antimiR-219a-5p组;未进行任何处理的细胞HSC-2作为空白对照组(NC);将miR-219a-5p分别与pcDNA和pcDNA-SMC4共同转染至细胞HSC-2中,记为miR-219a-5p+pcDNA组和miR-219a-5p+pcDNASMC4组,转染均按照LipofectamineTM2000试剂盒进行操作,均转染培养48 h,每组实验重复3次。
1.2.3 qRT-PCR检测miR-219a-5p和SMC4mRNA表达水平
收集以上培养48 h后的各组细胞,研磨充分后加入Trizol试剂提取总RNA,微量核酸测定仪检测RNA纯度和浓度。使用Ta Ka Ra反转录试剂盒将RNA反转录成cDNA,按照Ta Ka Ra荧光定量试剂盒使用说明配制反应体系,以β-actin为内参进行PCR扩增,每个样品重复3次,循环条件为95℃3min;95℃30s,60℃30s,72℃30s,共40个循环;72℃延伸5min。相对表达量采用2-△△Ct法计算。
1.2.4 Westernblot检测SMC4、CyclinD1、Caspase-3、Wnt2、β-catenin蛋白的表达
收集以上培养48 h后的各组细胞,加入RIPA裂解液裂解,4℃,12000g离心15min,收集蛋白上清液,BCA试剂盒测定蛋白浓度。将蛋白样品进行SDS-PAGE电泳后转至PVDF膜上,5%脱脂奶粉封闭液室温封闭1h。分别加入一抗(1∶1000),4℃孵育过夜,TBST洗膜;加入二抗(1∶2000)室温孵育2h,TBST洗涤3次,每次10min,后在暗室中曝光显影,再浸入定影,最后洗去残液晾干,将胶片用Quantity One凝胶分析软件处理,测定各组蛋白条带的吸光度,以目的条带和β-actin条带的比值作为蛋白表达水平。实验重复3次。
1.2.5 MTT检测细胞活性
各组细胞培养至48h时加入20μL的MTT溶液,继续孵育4 h;弃去多余培养基并加入150μL DMSO振荡反应10min,酶标仪检测490nm处吸光度(OD)值。细胞存活率(%)=实验组OD值/空白对照组OD值×100%。
1.2.6 流式细胞术检测细胞凋亡
用不含EDTA的胰酶消化培养48 h后的各组细胞后离心收集,PBS漂洗2次,加结合缓冲液重悬细胞。依据试剂盒说明书,先后加入Annexin V-FITC和PI避光孵育15min。流式细胞仪检测激发波长488nm和发射波长530nm处的荧光强度。实验重复3次。
1.2.7 荧光素酶报告基因检测实验检测miR-219a-5p对SMC4的靶向调控
TargetScan数据库显示SMC43′UTR区域有miR-219a-5p结合位点。构建野生型和突变型基因靶点SMC4的3′UTR荧光素酶表达载体(SMC4-WT和SMC4-MT),将SMC4-WT和SMC4-MT载体质粒分别与miR-con和miR-219a-5p共转染至HSC-2细胞中,具体转染步骤按LipofectamineTM2000试剂盒说明进行实验重复3次。
1.2.8 统计学分析
采用SPSS 20.0进行统计学分析。计数资料用%表示,计量资料以(±s)表示,两组比较行t检验,多组间比较采用单因素方差分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 miR-219a-5p和SMC4在皮肤鳞状细胞癌细胞株中的表达
与人正常皮肤细胞HaCaT相比,皮肤鳞状细胞癌细胞HSC-2、Colo-16、SCL-1中miR-219a-5p的表达水平显著降低,SMC4mRNA和蛋白的表达水平显著升高,差异具有统计学意义(P<0.05)(图1,表1)。

图1 皮肤鳞状细胞癌细胞株中SMC4蛋白表达结果Figure1 Expression of SMC4 protein in skin squamous cell carcinoma cell lines
表1 皮肤鳞状细胞癌细胞株中miR-219a-5p和SMC4的表达[n=9,(±s)]Table1 Expression ofmiR-219a-5p and SMC4 in squamous cell carcinoma cell lines[n=9,(±s)]

表1 皮肤鳞状细胞癌细胞株中miR-219a-5p和SMC4的表达[n=9,(±s)]Table1 Expression ofmiR-219a-5p and SMC4 in squamous cell carcinoma cell lines[n=9,(±s)]
注:与HaCaT组比较,aP<0.05,aP<0.05vs HaCaT group。
分组HaCaT HSC-2 Colo-16 SCL-1 F值P值miR-219a-5p 1.00±0.080.35±0.05a 0.25±0.09a 0.41±0.11a 141.4740.000SMC4mRNA 1.00±0.031.86±0.09a 2.05±0.12a 1.73±0.13a 188.3670.000SMC4 protein 1.00±0.072.15±0.12a 2.23±0.14a 2.03±0.14a 202.9280.000
2.2 转染miR-219a-5p诱导皮肤鳞状细胞癌细胞的凋亡
与miR-con组相比,miR-219a-5p组皮肤鳞状细胞癌中miR-219a-5p的表达水平显著升高,Cyclin D1表达水平显著降低,Caspase-3表达水平显著升高,细胞存活率显著降低,细胞凋亡率显著升高(P<0.05)(表2)。
2.3 miR-219a-5p过表达对Wnt/β-catenin信号通路的影响
与miR-con组相比,miR-219a-5p组皮肤鳞状细胞癌中Wnt2、β-catenin表达水平显著降低,GSK3β表达水平显著升高(P<0.05)(表3)。
表2 转染miR-219a-5p对皮肤鳞状细胞癌HSC-2细胞中miR-219a-5p、CyclinD1、Caspase-3的表达量和凋亡的影响[n=9,(±s)]Table2 Effect of transfection ofmiR-219a-5p on expression ofmiR-219a-5p,CyclinD1,Caspase-3and apoptosis in squamous cell carcinoma HSC-2 cells[n=9,(±s)]

表2 转染miR-219a-5p对皮肤鳞状细胞癌HSC-2细胞中miR-219a-5p、CyclinD1、Caspase-3的表达量和凋亡的影响[n=9,(±s)]Table2 Effect of transfection ofmiR-219a-5p on expression ofmiR-219a-5p,CyclinD1,Caspase-3and apoptosis in squamous cell carcinoma HSC-2 cells[n=9,(±s)]
分组NC miR-con miR-219a-5p F值P值miR-219a-5p 1.00±0.050.92±0.09 3.35±0.34a 407.7030.000细胞存活率99.56±4.3689.85±4.0251.86±3.25a 375.1740.000凋亡率4.56±1.356.25±1.48 28.46±1.94a 617.6400.000CyclinD11.00±0.060.85±0.090.35±0.12a 119.8280.000Caspase-31.00±0.08 1.21±0.112.97±0.37203.3570.000
表3 转染miR-130a-3p对皮肤鳞状细胞癌HSC-2细胞对Wnt/β-catenin信号通路的影响[n=9,(x±s)]Table3 Effect of transfection ofmiR-130a-3p onWnt/βcatenin signaling pathway in squamous cell carcinoma HSC-2 cells[n=9,(±s)]

表3 转染miR-130a-3p对皮肤鳞状细胞癌HSC-2细胞对Wnt/β-catenin信号通路的影响[n=9,(x±s)]Table3 Effect of transfection ofmiR-130a-3p onWnt/βcatenin signaling pathway in squamous cell carcinoma HSC-2 cells[n=9,(±s)]
注:与miR-con组比较,aP<0.05,aP<0.05vs miR-con group。
分组NC miR-con miR-219a-5p F值P值miR-219a-5p 1.00±0.030.99±0.075.78±0.58a 602.1820.000Wnt21.00±0.050.88±0.090.34±0.06a 235.0140.000β-catenin 1.00±0.070.95±0.090.42±0.13a 93.2810.000GSK3β 1.00±0.041.05±0.09 2.54±0.21a 384.2730.000
2.4 miR-219a-5p靶向SMC4抑制SMC4蛋白的表达
TargetScan数据库预测到SMC4与miR-219a-5p存在结合位点(图4A)。荧光素酶报告基因检测实验结果(表4)显示,相较于miR-con组,miR-219a-5p组SMC4-WT细胞HSC-2的荧光素酶活性显著降低(P<0.05);而SMC4-MT细胞HSC-2的荧光素酶活性差异不显著。Western Blot检测结果(图4 B)显示,相较于miR-con组,miR-219a-5p组HSC-2细胞中SMC4表达水平显著降低;相较于anti-miR-con组,anti-miR-219a-5p组HSC-2细胞中SMC4表达水平显著升高(P<0.05)。

图4 miR-219a-5p靶向SMC4的蛋白表达结果Figure4 miR-219a-5p targets SMC4

表4 miR-con或miR-219a-5p与报告质粒共转染皮肤鳞状细胞癌HSC-2细胞后双荧光素酶活性检测(n=9)Table4 Detection of dual luciferase activity after co-transfection of skin squamous cell carcinoma HSC-2 cellswithmiR-con ormiR-219a-5p and reporter plasmid(n=9)
2.5 过表达SMC4逆转miR-219a-5p诱导皮肤鳞状细胞癌的凋亡
与miR-con组相比,miR-219a-5p组SMC4、Cyclin D1表达水平显著降低,Caspase-3表达水平显著升高,细胞存活率显著降低,细胞凋亡率显著升高(P<0.05);与miR-219a-5p+pcDNA组相比,miR-219a-5p+pcDNA-SMC4组SMC4、CyclinD1表达水平显著升高,Caspase-3表达水平显著降低,细胞存活率显著升高,细胞凋亡率显著降低(P<0.05)见表5,图5。

表5 Wes ternblot检测皮肤鳞状细胞癌HSC-2细胞中SMC4的蛋白表达(n=9)Table5 Western blotanalysis of SMC4 protein expression in skin squamous cell carcinoma HSC-2 cells(n=9)
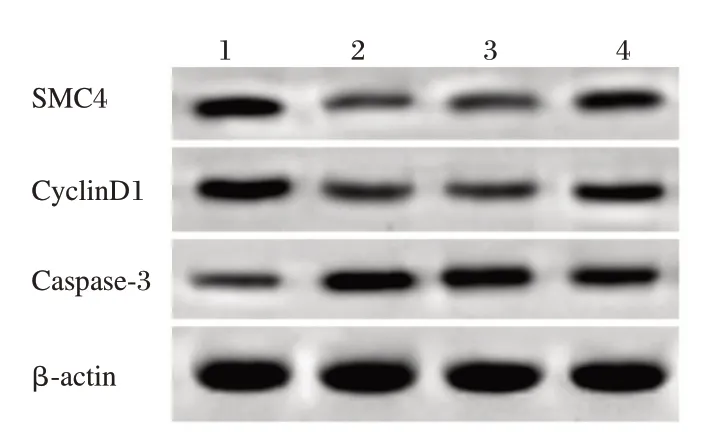
图5 Wes ternblot检测皮肤鳞状细胞癌HSC-2细胞中SMC4、CyclinD1和Caspase-3的表达Figure5 Western blotanalysis of SMC4,CyclinD1and Caspase-3expression in skin squamous cell carcinoma HSC-2 cells
3 讨论
CSCC发病率逐年上升,且易转移,对人类生命健康威胁极大[12]。miRNA在多种恶性肿瘤发生发展中发挥重要作用[13]。研究发现miR-219-5p可抑制非小细胞肺癌的增殖和侵袭并促进其凋亡[14]。miR-219-5p过表达通过上调Cleaved Caspase-3蛋白表达可抑制胰腺癌细胞增殖和侵袭,并诱导细胞凋亡[15]。本研究结果表明,miR-219a-5p在CSCC细胞系中均低表达,过表达miR-219a-5p可抑制CSCC细胞增殖,诱导细胞凋亡;促进Caspase-3表达,抑制CyclinD1表达。
SMC4属于SMC染色体ATP酶家族,SMC4在肺腺癌组织中过表达,敲低SMC4显著抑制A549细胞的增殖和侵袭[16]。SMC4的过表达可激活TGFβ/Smad信号传导并促进胶质瘤细胞的侵袭[17];SMC4在肝癌细胞中上调表达,miR-219可降低SMC4的表达,而SMC4又下调JAK2/Stat3的表达[18]。本研究中SMC4在CSCC中也上调表达,且miR-219a-5p也调控SMC 4的表达,过表达SMC4还能逆转miR-219a-5p对细胞HSC-2的增殖抑制和凋亡促进的作用。
研究发现Wnt/β-cat enin信号通路可与miRNA相互作用、调控进而影响肿瘤的发生发展。有研究报道miR-219-5p通过靶向LRH-1/Wnt/β-catenin信号通路可抑制胃癌细胞的增殖,迁移和侵袭[19];miR-219-5p通过靶向Twist/Wnt/β-catenin信号通路也能抑制上皮性卵巢癌细胞的增殖,迁移和侵袭[20];此外Sox9介导Wnt/β-catenin信号通路还影响皮肤鳞癌细胞的增殖[21]。本实验结果表明,miR-219a-5p过表达会抑制CSCC中Wnt2、β-catenin和Cyclin D1蛋白表达,Cyclin D1又是Wnt/β-catenin通路下游调控因子,即miR-219a-5p过表达会抑制Wnt/β-catenin信号通路,提示miR-219a-5p过表达影响CSCC细胞增殖、凋亡可能与Wnt/β-catenin信号通路有关。
综上所述,miR-219a-5p抑制皮肤鳞状细胞癌细胞增殖,诱导细胞凋亡,其机制可能与SMC4及Wnt/β-catenin信号通路有关,将可为皮肤鳞状细胞癌的预防和治疗提供新思路和新靶点。

