Notch通路上调miR−223抑制FBXW7表达对结肠癌HCT116细胞生物学的影响
刘志新,段菊凤,马藤,杨靖,谭华炳,刘龙△
结直肠癌(colorectal cancer,CRC)是第三大常见的恶性肿瘤,死亡率在所有恶性肿瘤中居第4位[1−2]。F−box家族的FBXW7是一个新发现的癌症抑制基因,其异常表达与结直肠癌、胃癌和卵巢癌等有关,常常扮演抑癌基因的角色,影响肿瘤细胞增殖、凋亡和信号转导等过程[3−4]。近年的研究表明,FBXW7基因的表达在CRC发生、发展和转移中发挥了不可或缺的作用[5−6]。MicroRNAs(miRNAs)是一种非编码小RNA分子,通过部分同源序列结合到mRNA的3′非翻译区(3′UTR),并引起mRNA降解或蛋白质翻译抑制,从而调控目的基因表达[7]。然而,目前miR−223抑制FBXW7mRNA,从而影响结肠癌细胞增殖与凋亡的分子机制尚不明确。本研究旨在探讨miR−223调控FBXW7基因表达,进而影响结肠癌HCT116细胞活性和凋亡的机制,以期为临床相关研究提供参考。
1 材料与方法
1.1 一般资料 选取2016年10月—2018年1月于十堰市人民医院就诊并存于病理科的20例结肠癌组织及癌旁正常组织标本,包括TNMⅢ期和Ⅳ期肿瘤组织。人结肠癌HCT116细胞由湖北医药学院基础医学院分子免疫学实验室保存。DMEM培养液、高糖DMEM培养基购自Thermo公司,胎牛血清(FBS)、Opti−MEM培养液购自Gibco公司,LipofectMINETM2000购自美国Invitrogen公司,TRIzol购自宝生物工程(大连)有限公司,反转录试剂和实时荧光定量PCR试剂盒均购自ABM公司,PCR引物购自苏州金维智公司,microRNAs购自上海生工生物工程有限公司,BCA蛋白定量试剂盒和ECL均购自碧云天生物技术研究所,CCK−8试剂购自日本同仁化学研究所,PVDF膜均购自美国Millipore公司,Annexin V−FITC/碘化丙啶(PI)细胞凋亡检测试剂盒购自康为世纪生物科技有限公司,荧光检测试剂盒Luciferase Assay System购自Promega公司。鼠抗人FBXW7多克隆抗体、鼠抗GAPDH单克隆抗体、羊抗鼠IgG(二抗)购自碧云天生物技术研究所。
1.2 标本检测
1.2.1 临床标本定量PCR检测 将结肠癌组织和癌旁组织标本匀浆后采用TRIzol提取总RNA,采用反转录试剂盒以oligo(dT)引物得到细胞cDNA,定量PCR检测细胞中FBXW7和MiR-223的表达水平。引物序列见表1,反应过程:95℃30 s;40个循环:95℃5 s,60℃30 s。实验进行3次,数据采用2−ΔΔCt法进行分析。
1.2.2 Western blot检测标本FBXW7表达 结肠癌组织和癌旁组织标本蛋白通过10% SDS−PAGE胶分离,电转移至PVDF膜上,用5%脱脂奶粉封闭,加入鼠抗人FBXW7多克隆抗体(1∶2 000稀释)及鼠抗人GAPDH单克隆抗体(1∶5 000稀释),4℃孵育过夜,洗膜3次后加入羊抗鼠IgG(1∶5 000稀释),室温孵育1 h后行ECL显影。3次重复,GAPDH作为内参,采用Image Lab对蛋白条带灰度值进行半定量分析。
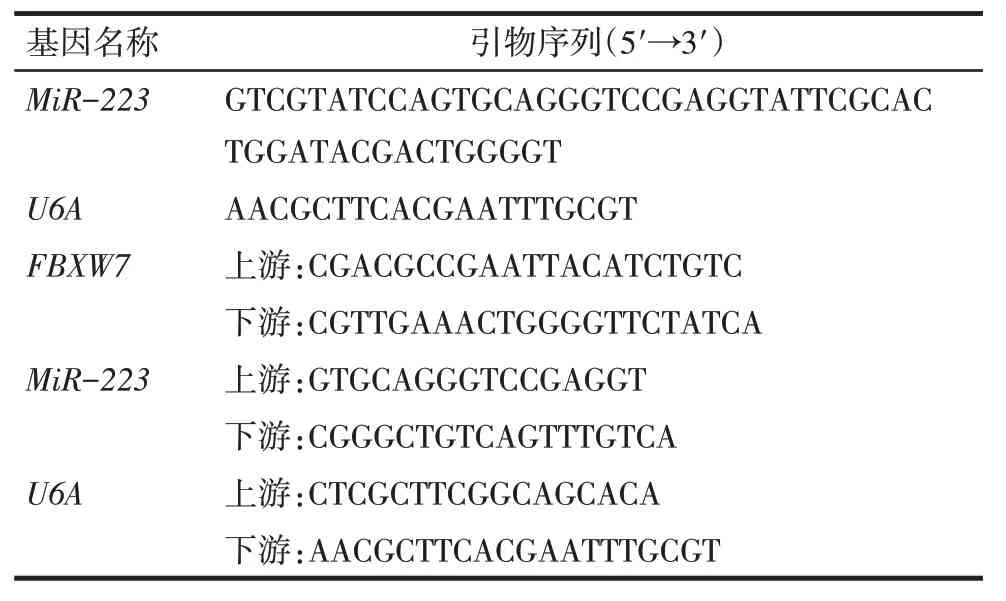
Tab.1 The nucleotide sequences used in q-PCR of this study表1 定量PCR所用引物序列
1.3 microRNAs挖掘验证
1.3.1 microRNAs挖掘 为了进一步挖掘调控FBXW7基因表达的microRNAs,将人源FBXW7序列提交到生物信息学网站TargetScan,预测作用于FBXW7基因的所有microRNAs序列和位点。
1.3.2 microRNAs特异扩增 以颈环引物逆转录得到预测microRNAs的cDNA,采用实时荧光定量PCR检测细胞中microRNAs的mRNA水平。引物序列见表1,程序同1.2.1,实验进行3次。
1.3.3 荧光素酶实验验证microRNAs与FBXW7结合 构建pMIR−miR−223、pMIR−miR−25质粒,miR−223模拟物(miR−223 mimics)与miR−223抑制剂(Inhibitor)作为对照,4组分别与pRL−TK质粒共转染入人胚肾HEK−293T细胞。36 h后采用荧光检测试剂盒Luciferase Assay System测定细胞荧光素酶的表达活性。将平皿中的细胞用5×细胞裂解试剂(Promega)裂解,离心后收集上清液加入100µL荧光素酶测定试剂室温混合,使用Glomax 20/20生物与化学发光检测仪(Promega)测定荧光素酶活性。
1.4 鉴定miR−223影响FBXW7表达及细胞生物学功能实验
1.4.1 检测HCT116细胞FBXW7 mRNA和蛋白表达量 转染miR−223与对照(miCtr)、miR−223抑制剂(Inhibitor)进入HCT116细胞,收集转染48 h后的各组细胞总蛋白并通过Western blot检测FBXW7表达量,进行3次生物学重复,对蛋白条带进行灰度分析。提取3组细胞总RNA,通过定量PCR检测各组miR−223和FBXW7的mRNA水平,方法同1.2.1。
1.4.2 细胞活性及凋亡检测 采用CCK−8法检测HCT116细胞活性,分组同1.4.1。将转染12、24、48、72 h后的各组HCT116细胞分别加入CCK−8试剂(10µL/孔),放入培养箱中继续培养2 h,用酶联免疫检测仪检测450 nm波长处各孔的光密度(OD)值。每组设生物学重复3次。收集转染48 h后 的 各 组HCT116细 胞,用PBS洗 涤2次,加 入500µL Binding Buffer悬浮细胞,加入5µL Annexin V−FITC混匀,最后加入5µL PI混匀,室温避光孵育10 min。通过流式细胞仪检测各组细胞的凋亡情况。进行3次生物学重复。
1.5 Notch通路影响miR−223及细胞生物学功能鉴定
1.5.1 Notch通路调控miR−223表达鉴定 将siNotch3和对照NC、Ctr分别转染HCT116细胞,转染48 h后分别提取3组细胞总RNA,通过定量PCR检测miR−223及FBXW7的mRNA水平,方法同1.2.1。
1.5.2 Notch通路影响HCT 116细胞凋亡 分组同1.5.1,转染48 h后应用Annexin V−FITC/PI细胞凋亡检测试剂盒染色,并用流式细胞仪检测各组细胞的凋亡水平。方法同1.4.2。
1.6 统计学方法 采用GraphPad Prism 5.0软件进行作图,采用SPSS 18.0进行统计分析。符合正态分布的计量资料以均数±标准差(±s)表示,2组间比较用t检验,多组间比较采用单因素方差分析,组间多重比较采用LSD−t检验。重复测量设计的计量资料比较采用重复测量资料方差分析,每个时点多组间比较使用Bonferroni法,P<0.05为差异有统计学意义。
2 结果
2.1 结肠癌组织中FBXW7 mRNA与蛋白表达量下调FBXW7在结肠肿瘤组织中的mRNA含量较癌旁组织显著降低(1.42±0.12vs.1.95±0.13;n=20,t=13.141,P<0.001);FBXW7蛋白表达量也低于癌旁组织(0.42±0.05vs.1.04±0.07;n=3,t=12.966,P<0.05),见图1。

Fig.1 The FBXW7 expression levels in CRC tissue and normal tissue图1 结肠癌组织和正常组织中FBXW7蛋白表达
2.2 挖掘与FBXW7序列结合的microRNAs 经过生物信息学网站TargetScan预测,作用于人源FBXW7基因的microRNAs包含以下作用位点和序列信息,共4条保守序列和2条非保守序列,见表2。
2.3 结肠癌细胞中microRNAs含量 经生物信息学预测得到的miR−223、miR−25、miR−32和miR−22都实现了高特异性扩增,miR−223和miR−25在Ct<30区域即检测到特异性扩增,miR−32在Ct<35区域得到特异性扩增,见图2。癌旁组织样本中miR−223的mRNA水平低于结肠癌组织(1.14±0.37vs.4.20±0.53;n=20,t=20.955,P<0.001)。

Fig.2 Amplification efficiency of four miRNAs in HCT116 cells图2 结肠癌细胞株HCT116中4种miRNAs的扩增效率
2.4 miR−223与靶基因FBXW7有结合作用 miR−223 mimics组、pMIR−miR−223组、pMIR−miR−25组及Inhibitor组的荧光值分别为1.02±0.07、0.53±0.05、1.48±0.13及0.78±0.07(n=3,F=67.624,P<0.001),过表达miR−223与miR−25可显著降低萤光素酶的活性(P<0.01)。
2.5 HCT116中miR−223抑制抑癌基因FBXW7的表达 miR−223组FBXW7 mRNA和蛋白相对表达水平 较miCtr组 与Inhibitor组均下降(P<0.01),见表3。
2.6 miR−223抑制抑癌基因FBXW7影响结直肠癌细胞活性和凋亡 miR−223与Inhibitor处理HCT116细胞活性有影响且与时间存在交互效应(P<0.05),见表4。miCtr组、Inhibitor组及miR−223组HCT116细胞凋亡率分别为5.55±0.57、3.64±0.55和9.35±0.55(单位:%;n=3,F=80.913,P<0.001),其中miR−223组较前2组显著降低(P<0.01)。

Tab.2 miRNAs binding positions in FBXW7 predicted by TargetScan表2 TargetScan预测人源FBXW7基因的miRNAs结合位点
Tab.3 Changes of miR-223,FBXW7 mRNA and protein levels affected by miR-223表3 miR-223影响miR-223与FBXW7 mRNA及蛋白含量变化 (n=3,±s)
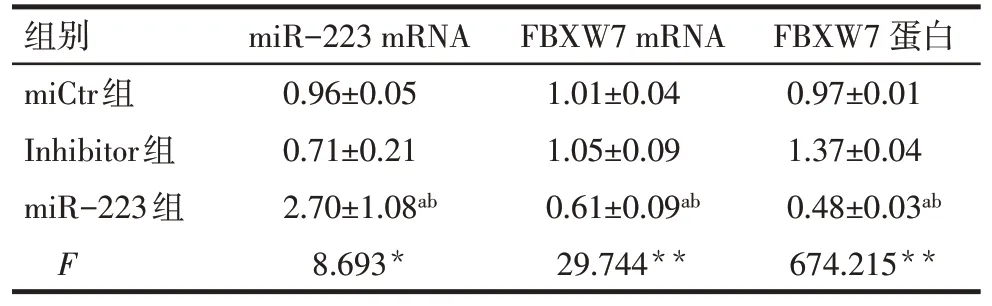
Tab.3 Changes of miR-223,FBXW7 mRNA and protein levels affected by miR-223表3 miR-223影响miR-223与FBXW7 mRNA及蛋白含量变化 (n=3,±s)
*P<0.05,**P<0.01;a与miCtr组 比 较,b与Inhibitor组比较,P<0.05
组别miCtr组Inhibitor组miR−223组F miR−223 mRNA 0.96±0.05 0.71±0.21 2.70±1.08ab 8.693*FBXW7 mRNA 1.01±0.04 1.05±0.09 0.61±0.09ab 29.744**FBXW7蛋白0.97±0.01 1.37±0.04 0.48±0.03ab 674.215**

Tab.4 Cell viability in HCT116 cells affected by miR-223 and inhibitor表4 miR-223与Inhibitor处理对HCT116细胞活性的影响(n=3,OD值,x ±s)
2.7 Notch通路影响miR−223表达及HCT116细胞凋亡 siNotch3组miR−223 mRNA相对表达量较NC组和Ctr组均减低(P<0.001),而FBXW7mRNA表达量升高(P<0.01)。相对于NC组,siNotch3组细胞凋亡率显著下降(P<0.05),见表5。
Tab.5 The effect of siRNA on Notch pathway表5 siRNA干扰Notch通路的影响 (n=3,±s)

Tab.5 The effect of siRNA on Notch pathway表5 siRNA干扰Notch通路的影响 (n=3,±s)
*P<0.05,**P<0.01;a与NC组比较,b与Ctr组比较,P<0.05
组别NC组Ctr组siNotch3组F miR−223 mRNA 1.09±0.11 1.05±0.03 0.25±0.07ab 112.832**FBXW7 mRNA 1.05±0.08 0.94±0.05 9.92±4.16ab 13.790**凋亡率(%)5.70±1.03 4.64±1.20 2.83±0.62ab 6.560*
3 讨论
抑癌基因FBXW7通过抑制细胞增殖和诱导细胞凋亡而发挥其抑制肿瘤的功能[8−9]。FBXW7是影响结直肠癌患者生存期的独立因子,且其表达与结直肠癌发生、发展及预后有一定关系[10]。miR−223与胃癌患者肿瘤大小、TNM分期明显有关,也与大肠癌侵袭及远处转移有关,可能在大肠癌的发生发展中发挥一定作用[11],但其机制仍旧未知。
FBXW7是多种miRNAs的靶标之一,相关研究证实,miR−25和miR−223可降低FBXW7的mRNA水平,并且miR−223可调节FBXW7的表达,从而调控细胞周期蛋白E的活性,最终影响细胞周期进程[12]。本研究结果显示,转染miR−223后结肠癌细胞HCT116中FBXW7的mRNA水平和蛋白表达量均显著下调,同时细胞活性增加、细胞凋亡数量减少,这与miR−200a和miR−125b在结直肠癌细胞中的作用一致[13−14]。同时证实,miR−223可以抑制FBXW7的mRNA和蛋白含量,而抑制miR−223不影响HCT116细胞活性,但细胞凋亡率升高,考虑可能是由于Inhibitor仅抑制微量的内源性miR−223,不足以影响FBXW7调控细胞周期蛋白E的活性,但可以通过其他途径影响细胞凋亡所致,此有待进一步研究。
多项研究证实,抑制Notch−1活性可影响细胞转移、侵袭与生长[15−16],而在非小细胞肺癌中,阻断Akt或Notch信号通路可减少miR−223的表达[17]。本研究通过siRNA干扰Notch通路影响HCT116细胞miR−223及FBXW7的表达,细胞凋亡率降低,表明Notch通路上调miR−223表达而抑制细胞凋亡。过表达miR−223而下调FBXW7可能参与一些癌症的发生发展[18],因此miR−223表达失调可能在细胞转化中损害FBXW7的肿瘤抑制活性。这提示Notch/miR−223/FBXW7途径有望成为临床上结直肠癌治疗潜在的生物标志,并可能作为潜在的药物作用靶标。
综上所述,Notch通路上调miR−223而抑制FBXW7的表达,最终促进结直肠癌HCT116细胞增殖而抑制其凋亡。

