蛋白质羰基化与大鼠心衰恶病质发生的相关性
孔文文,张昕
研究发现,慢性心衰患者晚期可能伴发心衰恶病质,其特征是体质量减轻及骨骼肌功能障碍,患者表现为骨瘦如柴,行动不便,生活难以自理,这增加了死亡率[1]。研究显示,仅通过营养摄入量的改变,无法逆转心衰恶病质患者体质量减轻的实质性状态[2]。目前,心衰恶病质发生的确切机制还未明确,但氧化应激、炎症、低氧、低营养状态、心血管系统功能失调等因素已被证实与其有关[3]。蛋白质羰基化是蛋白质氧化损伤的一种形式,是氨基酸残基侧链受到氧自由基攻击,最后转变成羰基产物,是氧化应激的结果。本研究通过制作异丙肾上腺素(ISO)诱导的心衰恶病质大鼠模型,并使用抗氧化剂肼苯哒嗪(HYD)[4]探讨骨骼肌和心肌中蛋白质羰基化与心衰恶病质发生的联系,明确HYD是否可以减轻羰基化程度,抑制恶病质进展,以期为明确心衰恶病质发生机制,延缓病情进展提供实验依据。
1 资料与方法
1.1 一般资料 90只清洁级12月龄的SD雄性大鼠,体质量500~600 g,由内蒙古大学实验动物中心提供。ISO购自大连美仑生物有限公司、HYD购自Sigma公司、脑钠肽(BNP)酶联免疫吸附测定(ELISA)试剂盒购自酶免,蛋白质羰基含量检测试剂盒购自北京Solarbio科技有限公司、抗2,4−二硝基苯(2,4−dinitrophenylhydrazine,DNP)抗体购自Sigma公司、山羊抗兔抗体以及DAB染色试剂盒购自中杉金桥生物技术有限公司。HD11XE彩色多普勒超声诊断仪购自飞利浦电器科技集团(中国)有限公司;罗氏全自动生化分析仪购自四川沃特仪器公司;紫外分光光度计购自上海精密科学仪器有限公司;显微镜照相系统购自日本Olympus公司等。
1.2 方法
1.2.1 SD大鼠心衰恶病质模型的建立 90只SD大鼠随机分为3组,异丙肾上腺素(ISO)组、肼苯哒嗪(HYD)+ISO组和对照组,每组各30只。每组大鼠测量体质量并进行编号。ISO组和HYD+ISO组注射异丙肾上腺素,对照组注射生理盐水。注射ISO的大鼠用0.9%氯化钠溶解粉剂ISO,终浓度为20 g/L,按0.18 g/(kg·d),隔天1次,共2次注射到大鼠腹股沟皮下,为了避免皮肤坏死,第2次换作另一侧进行注射,所有大鼠用药后正常进食和活动,饲养6周[5],HYD+ISO组用生理盐水溶解HYD,终浓度为1 g/L,按0.007 2 g/(kg·d)灌胃6周。ISO组和对照组用生理盐水进行灌胃6周,其他条件相同。每2周测量一次大鼠体质量,根据每一只大鼠新测量体质量进行灌胃。注射ISO后,ISO组和HYD+ISO组各死亡1只大鼠,均于注射药物后24 h内死亡。对照组没有注射ISO无动物死亡。模型成功的标准:大鼠左心室射血分数LVEF比对照组均值降低20%以上并且体质量较对照组降低6%以上[6]。造模结果:ISO组有26只大鼠,HYD+ISO组有15只大鼠造模成功,对照组30只大鼠未进行造模,只是作为对照。
1.2.2 超声心动图检查 造模6周后,用3%的水合氯醛,按0.1 mL/kg的量在各组大鼠腹腔皮下注射进行麻醉。深麻后,将大鼠四肢固定在木板上,大鼠取仰卧位,并用备皮刀去除大鼠胸部体毛。由同一个有经验的彩超医生用飞利浦彩色超声诊断仪的S4−2高频探头,选取大鼠左室乳头肌短轴切面进行测量左室舒张末期内径(LVEDD)、左室收缩末期内径(LVESD)、LVEF、短轴缩短率(FS)。每只大鼠测10个心动周期,取其平均值。
1.2.3 生化及营养指标的检测 造模6周后,于心脏超声检查后次日,将大鼠禁食12 h,钝性分离腹主动脉并采血,静置30 min后,3 000×g离心5 min后分离出血清,用于全自动生化分析仪检测所有大鼠血清中总白蛋白、三酰甘油、胆固醇、血糖水平。
1.2.4 ELISA法检测血浆BNP 造模6周后,于心脏超声检查后次日,将大鼠禁食12 h后,钝性分离腹主动脉并采血2 mL,颠倒混匀5次,3 000×g离心15 min,分离出血浆,用ELISA试剂盒检测血浆中BNP浓度。
1.2.5 紫外分光光度法检测蛋白质羰基 取大鼠的同一部分心肌及股二头肌,在PBS液中冲洗3次,用于快速蛋白质羰基含量的检测。称取约0.1 g心肌和骨骼肌样品,各加入1 mL提取液,充分匀浆后于4℃,5 000×g离心10 min,按照蛋白质羰基含量检测试剂盒说明书用紫外分光光度计于370 nm处进行测定。
1.2.6 免疫组化染色检测蛋白质羰基表达情况 心肌标本保存于AF液(即95%的乙醇∶40%甲醛原液=9∶1的混合固定液)中,24 h后石蜡包埋,切片,用于免疫组化染色检测羰基的表达情况。二甲苯脱蜡,梯度乙醇洗脱,用胰酶进行抗原修复,抗DNP抗体(1∶2 000)进行免疫杂交,并用苏木素染核,脱水,中性树胶封片。对于免疫组化结果,每张片子选取5个不同的高倍镜视野,各视野计数100个细胞,半定量法计算各视野阳性细胞百分率。
1.3 统计学方法 采用SPSS 17.0软件分析。符合正态分布的计量资料以均数±标准差(±s)表示,多组间比较用单因素方差分析,组间多重比较用SNK−q检验,计数资料用χ2检验。以P<0.05为差异有统计学意义。
2 结果
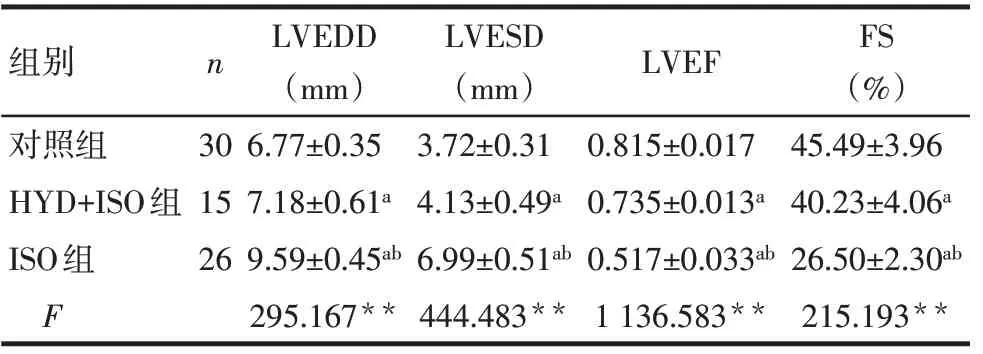
2.1 各组大鼠心功能比较 对照组、HYD+ISO组及ISO组LVEDD、LVESD依次升高,LVEF和FS依次降低(P<0.05),见表1。
Tab.1 Comparison of cardiac function between three groups of rats表1 3组大鼠心功能比较 (±s)
Tab.1 Comparison of cardiac function between three groups of rats表1 3组大鼠心功能比较 (±s)
**P<0.01;a与对照组比较,b与HYD+ISO组比较,P<0.05
组别对照组HYD+ISO组ISO组F n 30 15 26 LVEDD(mm)6.77±0.35 7.18±0.61a 9.59±0.45ab 295.167**LVESD(mm)3.72±0.31 4.13±0.49a 6.99±0.51ab 444.483**LVEF 0.815±0.017 0.735±0.013a 0.517±0.033ab 1 136.583**FS(%)45.49±3.96 40.23±4.06a 26.50±2.30ab 215.193**
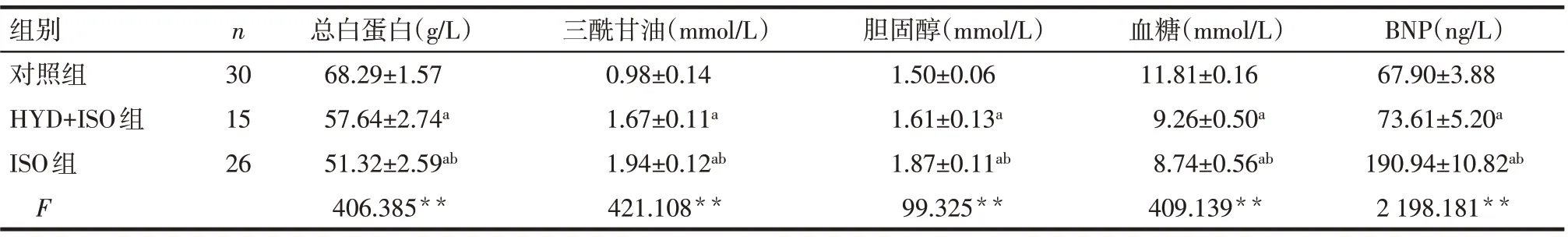
2.2 生化指标和心衰指标检测结果 对照组、HYD+ISO组及ISO组血清总白蛋白及血糖依次降低,血清三酰甘油、胆固醇、BNP依次升高(P<0.05),见表2。
2.3 蛋白质羰基含量测量结果 对照组、HYD+ISO组及ISO组大鼠心肌和骨骼肌中蛋白质羰基浓度均依次升高(P<0.05),见表3。
Tab.2 Comparison of biochemical nutritional indicators and heart failure indicators between three groups of rats表2 各组大鼠生化营养指标及心衰指标比较 (±s)
Tab.2 Comparison of biochemical nutritional indicators and heart failure indicators between three groups of rats表2 各组大鼠生化营养指标及心衰指标比较 (±s)
**P<0.01;a与对照组比较,b与HYD+ISO组比较,P<0.05
组别对照组HYD+ISO组ISO组F n 30 15 26总白蛋白(g/L)68.29±1.57 57.64±2.74a 51.32±2.59ab 406.385**三酰甘油(mmol/L)0.98±0.14 1.67±0.11a 1.94±0.12ab 421.108**胆固醇(mmol/L)1.50±0.06 1.61±0.13a 1.87±0.11ab 99.325**血糖(mmol/L)11.81±0.16 9.26±0.50a 8.74±0.56ab 409.139**BNP(ng/L)67.90±3.88 73.61±5.20a 190.94±10.82ab 2 198.181**
Tab.3 Protein carbonyl concentrations in myocardial and skeletal muscle of three groups of rats表3 3组大鼠心肌和骨骼肌中蛋白羰基浓度 (±s)

Tab.3 Protein carbonyl concentrations in myocardial and skeletal muscle of three groups of rats表3 3组大鼠心肌和骨骼肌中蛋白羰基浓度 (±s)
**P<0.01;a与对照组比较,b与HYD+ISO组比较,P<0.05
组别对照组HYD+ISO组ISO组F n 30 15 26心肌(µmol/g)3.62±0.73 15.07±2.51a 23.88±2.03ab 947.838**骨骼肌(µmol/g)3.13±0.56 5.37±1.21a 18.58±0.97ab 2 307.111**
2.4 免疫组化染色检测蛋白质羰基化结果 蛋白质羰基阳性细胞胞质呈棕黄色。对照组、HYD+ISO组及ISO组大鼠心肌和骨骼肌中蛋白质羰基化阳性细胞百分率依次增高(P<0.05),见表4、图1。
Tab.4 Percentages of protein carbonyl positive cells in myocardial and skeletal muscle of three groups of rats表4 3组大鼠心肌和骨骼肌中蛋白质羰基阳性细胞百分率(%,±s)

Tab.4 Percentages of protein carbonyl positive cells in myocardial and skeletal muscle of three groups of rats表4 3组大鼠心肌和骨骼肌中蛋白质羰基阳性细胞百分率(%,±s)
**P<0.01;a与对照组比较,b与HYD+ISO组比较,P<0.05
组别对照组HYD+ISO组ISO组F n 30 15 26心肌32.46±3.16 65.76±2.92a 90.00±1.61ab 3 344.541**骨骼肌27.68±3.07 51.63±2.96a 78.53±1.71ab 2 607.814**
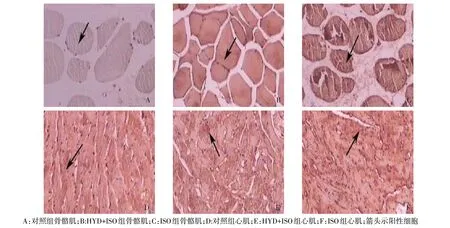
Fig.1 The expression of skeletal muscle protein carbonyl(DAB staining,×100)图1 骨骼肌蛋白质羰基表达情况(DAB染色,×100)
3 讨论
心衰恶病质发病率高,死亡率高,但其发病机制尚未明确,有研究认为其可能由全身炎症和肿瘤坏死因子驱动所致[7]。另有研究发现,蛋白质羰基化参与了甲亢所致的心力衰竭[8]。本研究结果显示,ISO组心肌和骨骼肌中蛋白质羰基化的水平高于对照组和HYD+ISO组,ISO组大鼠BNP的水平也明显比对照组和HYD+ISO组升高,表明羰基化反应参与了心衰恶病质发生和发展,提示利用强抗氧化剂HYD后可以部分抑制蛋白质羰基化的形成,并下调心衰的严重程度,考虑可能原因为强抗氧化剂抑制了大鼠体内氧化应激的形成,从而抑制了大鼠体内蛋白质羰基化的形成。蛋白质羰基化是最常见的非酶促翻译后修饰的类型,通过直接氧化或间接非氧化机制将羰基引入蛋白质中。氧自由基在短时间内的适度增加能够激活信号传导通路,使细胞尽快适应环境改变,同时免受压力对肌纤维的进一步的影响[9]。然而当氧自由基过度增多或抗氧化剂合成减少会过度激活信号传导通路,加速蛋白质的分解,最终导致细胞死亡[10]。蛋白质氧化特别是蛋白质羰基化会使酶活性、转录因子等发生变化,使蛋白质更易发生降解[11]。蛋白质羰基化能通过诱导关键蛋白质的修饰,改变细胞的结构和代谢,进一步改变肌肉的功能。更重要的是,羰基化的蛋白质可能更容易被骨骼肌纤维中的蛋白水解系统迅速降解,这是组织中蛋白质降解的重要形式,会增加晚期慢性病患者恶病质的发生率。
在诱导心衰恶病质模型时,本研究选取的是月龄为12个月,体质量500~600 g的老年SD大鼠,老年大鼠体质量变化小,机体功能下降,心脏功能下降,易于诱导心衰恶病质模型。已有用异丙肾上腺素诱导大鼠心衰恶病质的报道,此方法较为成熟,得到了一致认可。在本研究中,ISO组心衰恶病质模型的成功率为86.67%,与文献报道一致[12]。
另外,本研究中ISO组血清总蛋白和血糖水平比对照组和HYD+ISO组明显降低,三酰甘油水平明显升高,说明在心衰恶病质阶段,糖类、脂类及蛋白质代谢紊乱,改变了正常的代谢途径。这与Fulle等[13]研究结果相似。另外,低血糖也可能与恶病质状态下肝脏糖原储备减少有关,而外周血胆固醇增加与脂肪组织分解增加有关[14],也可能与心衰恶病质体内胰岛素水平异常升高有关,但本研究未涉及对胰岛素水平变化的探讨。
综上所述,ISO所致的心衰恶病质大鼠模型蛋白质羰基化水平升高;HYD可抑制心衰恶病质大鼠体内蛋白质羰基化的形成。氧化应激反应参与心衰恶病质的发生、发展,降低氧化应激反应、减少蛋白质的羰基化有可能阻止心衰恶病质的发生、发展。

