miR−149抑制结直肠癌细胞迁移的分子机制研究
刘晓柱,李银凤
结直肠癌(colorectal cancer,CRC)是一种来源于腺上皮的恶性肿瘤,其发病率在世界范围内排名第三[1−2]。由于我国经济水平和生活水平的不断提高,人们的饮食习惯与饮食结构发生了较大的变化,同时老龄化群体不断壮大,导致CRC发病率明显增高,极大地危害着居民健康,影响其生活质量[3]。miR−149是最近几年来研究比较多的一个microRNA(miRNA),作为抑癌基因参与调控肝癌[4]、乳腺癌[5]、胰腺癌[6]等多种癌症的发生及发展过程,也可以作为多种癌症的生物标志物及预后因子[7]。信号转导及转录激活蛋白3(signal transducer and activator of transcription 3,STAT3)为STAT蛋白家族的一员,在正常生理状态下,STAT3被快速且短暂地活化,表达强度和水平有限。然而在多种肿瘤细胞中,STAT3呈现出高水平、持续性地表达[8],这种表达的失调与卵巢癌[9]、胰腺癌[10]、乳腺癌[11]以及非小细胞肺癌[12]等肿瘤的进程密切相关。在CRC细胞中,激活STAT3的表达,可增强CRC细胞的生长与增殖能力[13]。STAT3、miR−149[14]作为重要的肿瘤调控因子,均参与调节CRC细胞增殖、侵袭等恶性生物学行为,但两者之间关系尚不明确。本研究拟探讨miR−149通过靶向结合STAT3对CRC细胞增殖、侵袭和凋亡的影响。
1 材料与方法
1.1 实验材料、仪器及试剂 本研究所用的转移潜能细胞系SW620、低转移潜能细胞系LS174T及正常的人结肠上皮细胞FHC均购自中国科学院上海生命科学研究院细胞资源中心,在RPMI 1640培养基(含有10%胎牛血清)中培养,培养条件为5%CO2、37℃恒温培养。
伯乐T100实时荧光定量聚合酶链反应仪、伯乐1658001电泳仪、转膜仪(美国Bio−Rad公司),JS−680B全自动凝胶成像系统(上海培清科技有限公司)、MultiskanMK3酶标仪(Thermo Fisher公司)。RNA提取试剂Trizol、细胞转染试剂Lipofectamine 2000、pGL3 promotor载体均购自美国Invitrogen公司。反转录试剂盒与实时荧光定量PCR试剂盒购自普洛麦格(北京)生物技术有限公司;Transwell小室购自美国康宁公司,STAT3抗体、p−STAT3抗体(鼠单抗)以及β−actin抗体购于美国Abcam公司,二抗(羊抗兔/鼠)购于广州优迪生物科技股份有限公司。miR−149 mimics、miR−149逆转录引物、实时荧光定量PCR引物均购自苏州吉玛基因股份有限公司,序列见表1。
1.2 实时荧光定量PCR(quantitative real−time fluorescence PCR,qPCR)检测CRC细胞中miR−149的表达 按照Trizol试剂说明书步骤提取SW620、LS174T及FHC细胞总RNA,核酸蛋白仪测定总RNA浓度。提取的总RNA按照反转录试剂盒说明书进行反转录反应。按照SYBR Green试剂盒说明对miR−149表达水平进行检测,反应条件为95℃变性15 s,55℃退火30 s,72℃延伸10 s,进行40个循环扩增,以U6作为内参对照。采用2−△△Ct法分析miR−149表达量。
1.3 细胞转染 采用qPCR法扩增人STAT3基因(NM_139276.2)开放阅读框(open reading frame,ORF),PCR产物纯化后连接到表达载体pEGFP−C1上,重组质粒命名为pEGFP/STAT3。取对数生长期,细胞密度为5×105个/孔的SW620、LS174T细胞接种于6孔板中培养24 h,利用Lipofectamine 2000分别转染miR−NC、miR−149 mimics、质粒pEGFP/STAT3以及各自的对照序列或载体于细胞中,并分为3组:miR−NC组、miR−149 mimics组、miR−149 mimics+pEGFP/STAT3组。
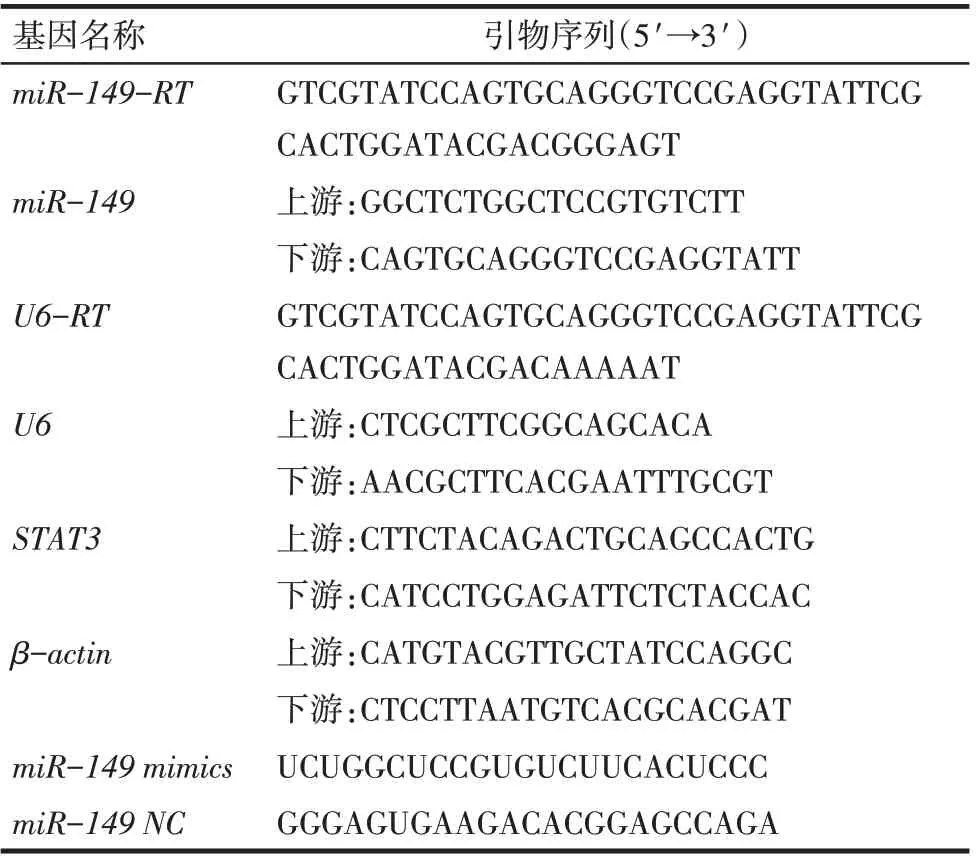
Tab.1 Primers and mimics used in this study表1 本研究中所用引物、mimics序列
1.4 双荧光素酶报告基因实验验证STAT3与miR−149的靶向关系 将包含miR−149可能结合位点的STAT3(NM_004443)完整的3′UTR连接到pGL3 promotor载体上。利用定点突变试剂盒进行位点的直接突变,得到野生型与突变型荧光素酶报告载体pGL3/STAT3wt、pGL3/STAT3mut。将构建好的pGL3/STAT3wt、pGL3/STAT3mut报告载体分别与miR−149 mimics、mimics−NC共转染到SW620细胞中,48 h后裂解细胞,双荧光素酶检测试剂盒检测荧光素酶活性。
1.5 Western blot检测miR−149对CRC细胞中STAT3、p−STAT3表达的影响 PBS清洗转染miR−149 mimics、mimics−NC以及miR−149 mimics+pEGFP/STAT3 48 h后的SW620、LS174T细胞,RIPA裂解液(50 mmol/L Tris−Cl、150 mmol/L NaCl、1%TritonX−100、0.1%SDS)裂解提取细胞蛋白。采用BCA法测定蛋白浓度。以β−actin为内参,10% SDS−PAGE检测提取STAT3、p−STAT3蛋白,转膜后5%脱脂牛奶封闭。加入一抗STAT3抗体(1∶1 000),4℃孵育过夜,TBST缓冲液洗膜。加入辣根过氧化物酶标记的二抗(1∶1 000),室温孵育1 h后进行显影,采用Image J软件分析靶蛋白带的灰度水平。
1.6 CCK−8法检测miR−149对CRC细胞增殖的影响 使用RPMI 1640培养基稀释CCK−8溶液至浓度为10%,转染miR−149 mimics、mimics−NC以及miR−149 mimics+pEGFP/STAT3的SW620、LS174T细胞悬浮于CCK−8稀释液中,37℃恒温培养箱中培养4 h,450 nm处检测光密度(OD)值,以OD值代表细胞增殖水平。
1.7 Transwell法检测miR−149对CRC细胞侵袭的影响 消化转染miR−149 mimics、mimics−NC以及miR−149 mimics+pEGFP/STAT3 24 h后的SW620、LS174T细胞,重悬于无血清RPMI 1640培养基中,接种到Matrige(l终浓度为1 g/L)覆盖的Transwell上层小室内,小室底部为常规培养基。24 h后取出小室,甲醛和乙酸的混合液固定细胞15 min,PBS清洗,再用棉签擦去未穿过小室膜的细胞。结晶紫进行染色,染色后使用PBS冲洗。随机读取3个视野显微镜下进行拍照计数,计算每个视野下发生侵袭的平均细胞数目。
1.8 细胞划痕实验检测miR−149对各组CRC细胞迁移的影响 将转染miR−149 mimics、mimics−NC以及miR−149 mimics+pEGFP/STAT3的SW620及LS174T细胞制备成1×106个/mL的细胞悬液,加入到6孔板,过夜培养。用10µL的枪头在单层细胞上划横线,PBS洗3次,洗去脱落的细胞。显微镜下拍照并计算划痕的宽度,培养24 h后再取出进行拍照并再次测量划痕的宽度。细胞相对迁移率=(初始划痕宽度−培养24 h后划痕宽度)/初始划痕宽度。
1.9 流式细胞法检测miR−149对各组CRC细胞凋亡的影响 PBS洗涤转染miR−149 mimics、mimics−NC以及miR−149 mimics+pEGFP/STAT3的SW620细胞,1×Binding buffer将各组细胞稀释成1×106个/mL的细胞悬液。加入annexin V−fluorescein isothiocyanate(FITC)至各组细胞悬液中,室温下轻轻混匀(避光),孵育10 min。加入碘化丙啶(propidium iodide,PI),继续室温下孵育5 min(避光)。利用流式细胞仪对各组染色的细胞进行检测。
1.10 统计学方法 采用SPSS 16.0统计软件分析,所有实验在相同条件下独立重复3次,计量资料以±s表示。2组均数间比较用成组t检验,多组均数间比较用单因素方差分析,组间多重比较采用LSD−t检验。P<0.05为差异有统计学意义。
2 结果
2.1 miR−149在CRC细胞中的表达水平 qPCR检测结果显示,miR−149在CRC细胞SW620、LS174T中相对表达水平分别为0.39±0.03、0.30±0.02,均低于正常的结肠上皮细胞FHC(1.00±0.09),差异有统计学意义(n=3,F=141.225,P<0.01)。
2.2 miR−149靶向结合STAT3双荧光素酶报告基因实验结果 3组细胞相对荧光活性比较差异有统计学意义(n=3,F=104.058,P<0.01)。与转染miR−149 NC组(1.01±0.10)相比,过表达miR−149 mimics后,相对荧光活性为0.33±0.05,相对荧光活性降低(P<0.05);突变STAT3与miR−149结合后,相对荧光活性为0.94±0.03,与miR−149 NC组比较差异无统计学意义。
2.3 转染miR−149 mimics抑制CRC细胞STAT3的表达 qPCR检测结果表明,转染miR−149 mimics的SW620与LS174T细胞中STAT3 mRNA表达水平与miR−NC组相比均降低(P<0.01),见表2;Western blot检测结果显示,转染miR−149 mimics的2种细胞中STAT3与p−STAT3蛋白表达水平均较miR−NC组降低(P<0.01),见表2、图1。
Tab.2 The relative expressions of STAT3 and p-STAT3 in mRNA and protein levels of each group表2 各组STAT3、p-STAT3 mRNA与蛋白表达量(n=3,±s)

Tab.2 The relative expressions of STAT3 and p-STAT3 in mRNA and protein levels of each group表2 各组STAT3、p-STAT3 mRNA与蛋白表达量(n=3,±s)
**P<0.01
组别miR−NC组miR−149 mimics组t组别miR−NC组miR−149 mimics组t SW620细胞STAT3 mRNA 1.01±0.09 0.27±0.03 13.566**LS174T细胞STAT3 mRNA 1.00±0.03 0.36±0.01 39.192**STAT3蛋白1.00±0.06 0.26±0.02 21.465**STAT3蛋白1.01±0.04 0.39±0.02 24.855**p−STAT3蛋白1.00±0.05 0.17±0.03 25.997**p−STAT3蛋白1.01±0.04 0.29±0.03 28.597**

Fig.1 Detection of STAT3 and p−STAT3 protein expression using Western blot analysis图1 Western blot检测STAT3与p−STAT3蛋白表达水平
2.4 miR−149通过靶向STAT3抑制CRC细胞的增殖 miR−149 mimics、mimics−NC以 及miR−149 mimics+pEGFP/STAT3转染至SW620、LS174T细胞后,CCK−8法分析结果显示,miR−149 mimic组细胞增殖能力在24、48、72 h低于miR−NC组(P<0.05);与miR−149 mimics组细胞相比,转染miR−149 mimics+pEGFP/STAT3组细胞的增殖能力则在24、48、72 h提高(P<0.05),见表3。
2.5 miR−149通过靶向STAT3抑制CRC细胞的侵袭 Transwell法检测结果显示,miR−149 mimic组每个视野下的侵袭细胞数低于miR−NC组(P<0.05);miR−149 mimics+pEGFP/STAT3组每个视野下的侵袭细胞数高于miR−149 mimic组(P<0.05),见图2、表4。
2.6 miR−149通过靶向STAT3抑制CRC细胞的迁移 细胞划痕实验结果显示,在CRC细胞中,转染miR−149组相对细胞迁移率低于miR−NC组细胞(P<0.05),miR−149 mimics+pEGFP/STAT3组相对细胞迁移率则高于miR−149 mimics组(P<0.05),见图3、表5。
2.7 miR−149通过靶向STAT3促进CRC细胞的凋亡 流式细胞术分析了转染miR−NC、mimics−NC、miR−149 mimics+pEGFP/STAT3 SW620细胞凋亡情况。3组细胞凋亡率比较差异有统计学意义(n=3,F=1 453.983,P<0.01),miR−149mimic组细胞凋亡率为(11.21±0.45)%,高于miR−NC组(0.41±0.02)%,而miR−149mimics+pEGFP/STAT3组细胞凋亡率(1.34±0.12)%则低于miR−149 mimics组(均P<0.05),见图4。
Tab.3 The proliferation levels of CRC cells of each group表3 各组细胞增殖水平 (n=3,OD值,±s)
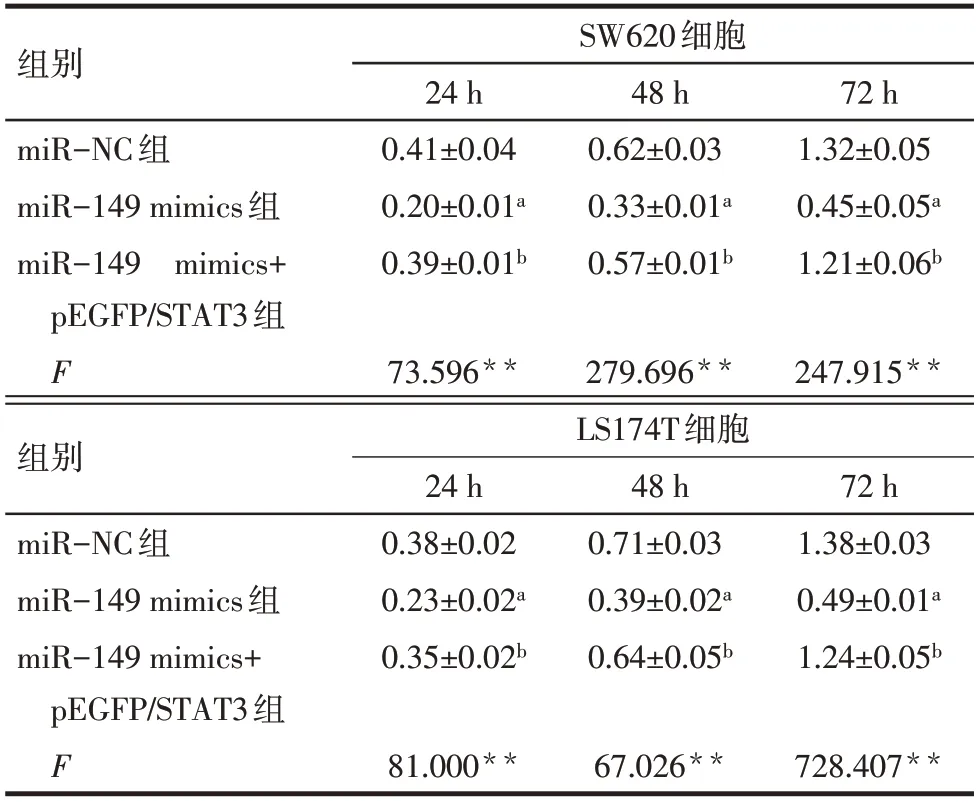
Tab.3 The proliferation levels of CRC cells of each group表3 各组细胞增殖水平 (n=3,OD值,±s)
**P<0.01;a与miR−NC组比较,b与miR−149 mimics组比较,P<0.01;表4~5同
组别miR−NC组miR−149 mimics组miR−149 mimics+pEGFP/STAT3组F组别miR−NC组miR−149 mimics组miR−149 mimics+pEGFP/STAT3组F SW620细胞24 h 0.38±0.02 0.23±0.02a 0.35±0.02b 81.000**48 h 0.71±0.03 0.39±0.02a 0.64±0.05b 67.026**72 h 1.38±0.03 0.49±0.01a 1.24±0.05b 728.407**
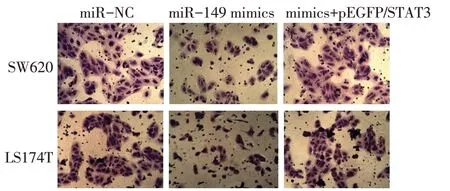
Fig.2 miR−149 inhibited invasion of CRC cells by targeting STAT3(×100)图2 miR−149通过靶向STAT3抑制CRC细胞的侵袭(×100)
Tab.4 The invasion number per unit field of view of each group表4 单位视野下各组细胞侵袭数 (n=3,个/视野,±s)
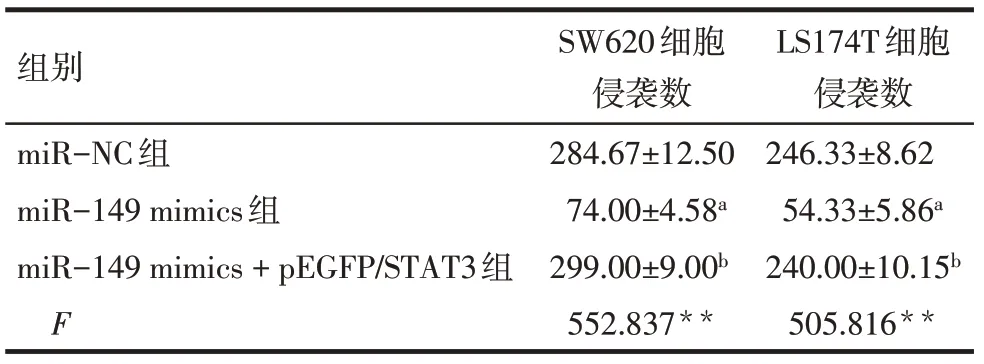
Tab.4 The invasion number per unit field of view of each group表4 单位视野下各组细胞侵袭数 (n=3,个/视野,±s)
组别miR−NC组miR−149 mimics组miR−149 mimics+pEGFP/STAT3组F SW620细胞侵袭数284.67±12.50 74.00±4.58a 299.00±9.00b 552.837**LS174T细胞侵袭数246.33±8.62 54.33±5.86a 240.00±10.15b 505.816**
3 讨论

Fig.3 miR−149 inhibited migration of SW620 and LS174T cells by targeting STAT3(×100)图3 miR−149通过靶向STAT3抑制SW620和LS174T细胞的迁移(×100)
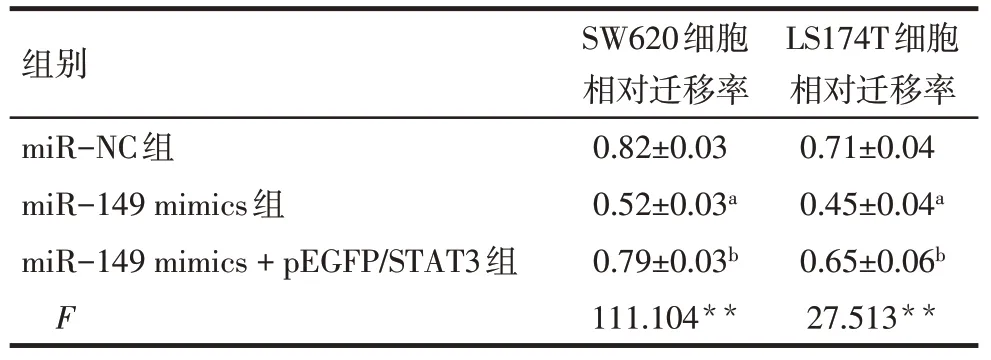
Tab.5 The relative cell migration rate of each group表5 各组细胞相对迁移率
miR−149是近年来受到广泛关注的一种非编码RNA,长度为23 nt,可通过与靶mRNA的3′UTR结合,抑制其翻译,发挥着转录后调控作用。越来越多的证据表明,miR−149作为原癌基因或抑癌基因,参与调控乳腺癌、胃癌、肝癌、肺癌等多种肿瘤的发生发展过程,在肿瘤细胞中的异常表达增强了肿瘤细胞增殖、侵袭、迁移等恶性生物学行为[4,14−15]。Xu等[16]在CRC细胞株HCT116、LoVo和SW480中证实,过量表达miR−149导致CRC侵袭与迁移能力降低,具有抑制CRC细胞恶性生物学行为的功能。本研究则进一步分析了miR−149对CRC细胞株SW620和LS174T细胞学行为的影响,发现SW620和LS174T细胞中过量表达miR−149使得细胞的增殖、侵袭与迁移行为均受到抑制,细胞的凋亡被诱发。这与Xu等[16]的研究结果较为一致,进一步明确了miR−149在CRC细胞中的调控作用。
STAT3为STAT家族一员,在结直肠癌肿瘤组织中异常表达,其表达水平与淋巴结转移、TNM分期以及肿瘤患者恶性程度有关。此外,STAT3还影响CRC细胞增殖、侵袭、迁移以及血管生成等恶性生物学行为,但其作用分子信号调控网络仍未明确。本研究明确了在CRC细胞中STAT3为miR−149的一个靶基因,miR−149可通过靶向STAT3抑制结直肠癌细胞的增殖、侵袭与迁移,同时促进细胞的凋亡。本研究确认了在CRC细胞中miR−149与STAT3之间的靶向调控关系,进一步明确了CRC发生的分子信号网络。

Fig.4 The CRC apoptosis detected by flow cytometry analysis in SW620 cells图4 流式细胞术检测结直肠癌细胞的凋亡
miR−149对靶基因的调控并非一对一的关系。研究发现,miR−149可通过靶向结合FOXM1,抑制结直肠癌细胞的侵袭和迁移[16]。miR−149通过调节靶基因SP1、SRPX2,控制基因的甲基化水平,影响结直肠癌患者5年生存率[17−18]。在CRC细胞中STAT3、FOXM1、SP1以及SRPX2均被证实为miR−149的靶基因,但它们之间的关系如何,是否有交叉,如何联系,依然未知,还需要深入探讨。此外,Shi等[19]研究还发现,miR−149通过下调WFDC2基因编码的人类附睾蛋白4(human epididymis protein 4,HE4)的表达,调控CRC患者对不同放射性辐射治疗的敏感性。这表明miR−149在结直肠癌细胞中的作用较为广泛,那么miR−149在结直肠癌中多重调节之间有无共同的上游或者下游通路,需要进一步研究。
Wang等[20]研究发现miR−124在结直肠癌组织通过靶向结合STAT3发挥抑癌基因作用,可作为CRC潜在治疗靶点。Liu等[21]研究表明,在人CRC细胞中,miR−221和miR−222作为一个正向反馈环(positive feedback loop)可调节STAT3的表达。可见,在结直肠癌细胞中,miR−149、miR−124、miR−221和miR−222均可通过调节STAT3表达,调控CRC细胞行为,那么三者之间均聚焦到STAT3上,具体仍需进一步明确。
综上所述,本研究证实了STAT3在CRC细胞中为miR−149的一个靶基因,参与调节CRC细胞的恶性生物学行为,进一步丰富了miR−149所调控的靶基因,为CRC的治疗提供了新的思路。

