氧化苦参碱对H9c2心肌细胞损伤的保护作用
张仲柏,李艳春,陈润都,李园鑫,张 梅
冠状动脉粥样硬化性心脏病(coronary atherosclerotic heart disease,CAD)是指冠状动脉粥样斑块形成使血管腔狭窄或阻塞,导致心肌细胞缺血、缺氧而引起的心脏病。CAD在全球的发病率及死亡率呈逐年上升趋势,同时氧化应激(oxidative stress,OS)被认为是一个明确促进细胞凋亡的病理过程,与多种心血管疾病密切相关[1,2]。因此,探究CAD的发病机制,寻找有效的预防及治疗途径显得尤为重要。
氧化苦参碱(oxymatrine,OMT)是从苦参和苦豆子中提取出来的生物碱,具有抗炎、抗肿瘤、镇静催眠等多种药理作用[3-5],另外OMT在心血管领域也有着广泛的应用前景,如调节血压、抗心律失常、抗病毒性心肌炎等[6-8]。随着国内外学者大量研究,OMT对心血管疾病的保护机制也逐渐被揭晓[9-11],心肌组织核因子相关因子2(NF-E2-related factor 2,Nrf2)/血红素氧化酶-1(heme oxygenase-1,HO-1)信号通路是人体内重要的抗氧化通路[12],但OMT在心肌细胞OS损伤中的保护机制与该通路的关系尚未明确,因此,本研究通过建立H9c2心肌细胞OS损伤模型,探讨OMT对心肌细胞OS损伤的保护作用与Nrf2 /HO-1信号通路的关系,进一步了解OMT保护心肌细胞的作用机制并对临床开发新药做出指导。
1 材料与方法
1.1 材料与试剂
1.1.1 细胞系 H9c2心肌细胞株取自本实验室,接种于含有10%胎牛血清的高糖DMEM培养液中,并放置于含5% CO2、37 ℃的恒温培养箱中进行培养,2~3 d传代一次。
1.1.2 主要材料与试剂 高糖DMEM 培养液(美国Gibco公司) ,胎牛血清(美国Gibco公司),磷酸盐(phosphate buffer saline,PBS)缓冲液(北京Solarbio有限公司),过氧化氢(hydrogen peroxide,H2O2)试剂(美国Sigma公司),BCA蛋白定量试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)、丙二醛(malondialdehyde,MDA) 、超氧化物歧化酶(superoxide dismutase,SOD) 、还原型谷胱甘肽(glutathione,GSH)、过氧化氢酶(catalase,CAT)检测试剂盒 (南京建成生物工程研究所) ,Nrf2、HO-1、β-actin抗体(美国Proteintech Group公司),HRP 标记山羊抗兔二抗(美国Proteintech Group公司),TRIzol Reagent细胞裂解液(美国Invitrogen公司),反转录-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)试剂盒(北京康为世纪生物科技有限公司),PCR引物(北京生工生物工程股份有限公司)。
1.2 方法
1.2.1 分组 取处于对数生长期的细胞,随机分为4组:对照组,不给于任何处理;模型组,在细胞培养液中加入终浓度为100 μmol/L的H2O2培养4 h;OMT低、高浓度预处理组,分别用含有10 μmol/L和50 μmol/L的OMT且不含有血清的DMEM完全培养液预处理12 h,再加入终浓度为100 μmol/L的H2O2培养4 h。
1.2.2 细胞形态学观察 各组细胞800 r/min离心5 min后弃上清,PBS缓冲液冲洗2~3次后用去离子水进行洗涤,加入苏木精浸染5 min,用去离子水冲洗后置入伊红液中2 min,置于通风处晾干后通过倒置光学显微镜观察细胞形态及细胞个数,并进行拍照。
1.2.3 Hoechst凋亡染色 将各组细胞以1×104个/孔接种于24孔板内,放置于含5% CO2、37 ℃的细胞培养箱中培养12 h后按照上述实验方法分别对细胞进行处理并吸尽培养液,根据Hoechst3325S染色试剂盒说明书,每孔加入固定液后,置于4 ℃冰箱内过夜。去除固定液时避光、摇床上用PBS缓冲液洗涤2~3遍,再加入Hoechst染色液孵育5 min,随后吸去染色液并用PBS缓冲液洗涤2~3遍,最后滴入封片液封片,同时在340 nm波长的紫外光下激发,观察荧光强弱。
1.2.4 细胞活力的检测 采用MTT法。将各组细胞分别接种于96孔培养板中,每孔接种细胞数为1×105个,接种完毕后置于细胞培养箱中培养12 h,待细胞完全贴壁后按照上述实验方法分别对不同分组的细胞进行处理。随后加入浓度为5 g/L MTT溶液20μL,培养箱孵育4 h后弃上清,并在每孔中加入二甲基亚砜(dimethyl sulfoxide,DMSO)150 μl,振荡10 min后用酶标仪测定490 nm波长的OD值,各组取平均值后计算细胞存活率:细胞存活率(%)=(实验组OD值/对照组OD 值)×100%。
1.2.5 细胞培养液中LDH水平的检测 取各组细胞培养上清液,按照LDH试剂盒操作步骤,通过全自动化酶标仪检测每组细胞上清液中的LDH含量。
1.2.6 心肌细胞中SOD、MDA、GSH、CAT水平的检测 取各组细胞培养液,在6孔板中每孔加入2 ml PBS洗涤2~3次,采用超声破碎仪冰水浴中破碎细胞, 3~5 s超声1次,间隔4次,而后经4 ℃离心机1500 r/min离心4 min取上清,最后按照不同试剂盒的操作步骤采用全自动化酶标仪测定各组细胞裂解液中SOD、MDA、GSH、CAT水平。
1.2.7 RT-PCR检测Bcl-2 mRNA、Bax mRNA、Casepase3 mRNA、Nrf2 mRNA、HO-1 mRNA表达 通过Trizol法提取各组心肌细胞的信使RNA(messenger RNA,mRNA),运用反转录试剂盒将其反转录成互补脱氧核糖核酸(complementary DNA,cDNA),最后以cDNA为模板,采用RT-PCR法检测各组中B细胞淋巴瘤/白血病-2(B cell lymphoma/ leukemias-2,Bcl-2)、Bcl-2相关蛋白X(bcl-2 associated x protein,Bax)、含半胱氨酸的天冬氨酸蛋白水解酶3(cysteinyl aspartate specific proteinase 3,Casepase3)、Nrf2、HO-1 mRNA的表达。
1.2.8 Western Blot检测Nrf2 、HO-1蛋白表达 按照实验分组处理细胞,用PBS缓冲液洗涤2~3次,收集细胞并加入细胞裂解液4 ℃裂解20 min,离心后收集细胞上清液。用BCA蛋白测定盒测定蛋白总量。取细胞裂解液上清样于SDS-PAGE聚丙烯酰胺凝胶进行电泳。结束后将蛋白转至聚偏氟乙烯(poly vinylidene fluoride,PVDF)膜上。加入封闭液、一抗4 ℃孵育过夜,洗膜,加入二抗工作液室温进行孵育1 h,洗膜,用化学发光试剂盒检测靶蛋白的表达。每组实验均重复3次。
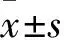
2 结 果
2.1 OMT对OS损伤的H9c2心肌细胞形态的影响 对照组心肌细胞生长状态良好,细胞呈长梭形、胞质饱满且结构完整,胞浆透明,细胞排列紧密,贴壁良好(图1A)。模型组出现大量悬浮细胞,镜下显示细胞明显失去基本结构,皱缩明显,胞间间隙增大(图1B)。细胞在低、高浓度OMT预处理后状态明显好转,基本结构较清晰,胞间间隙缩小(图1C、D)。

图1 不同浓度的OMT对H9c2心肌细胞形态的影响(HE, ×100)
A.对照组;B.模型组; C. OMT 10 μmol/L预处理组; D. OMT 50 μmol/L预处理组
2.2 OMT对OS损伤的H9c2心肌细胞存活率及LDH漏出量的影响 模型组心肌细胞存活率较对照组降低,LDH漏出量升高,差异均有统计学意义。经OMT低、高浓度预处理后心肌细胞较模型组存活率升高, LDH漏出量降低,差异均有统计学意义(P<0.01,表1)。


组别存活率(%)LDH(U/L)对照组97.25±0.11158.63±8.53模型组39.53±0.25①472.22±15.54①OMT 10 μmol/L预处理组57.40±0.12②367.72±12.53②OMT 50 μmol/L预处理组77.51±0.23②275.35±12.48②
注:与对照组比较,①P<0.01;与模型组比较,②P<0.01
2.3 OMT对OS损伤的H9c2心肌细胞凋亡的影响 模型组心肌细胞较对照组胞质皱缩,细胞核内可见大量蓝色荧光(图2A、B),通过计算凋亡率,模型组高于对照组[(86.65%±4.31%)vs(11.08%±3.21%)],差异有统计学意义(P<0.01)。经OMT低、高浓度预处理后细胞形态恢复,细胞核内蓝色荧光减少,凋亡率下降(图2C、D)[(49.02%±4.21%)vs(35.60%±2.62%)],差异有统计学意义(P<0.01)。

图2 不同浓度的OMT对H9c2心肌细胞凋亡的影响(Hoechst, ×100)
A.对照组;B.模型组; C. OMT 10 μmol/L预处理组; D. OMT 50 μmol/L预处理组
2.4 OMT对OS损伤的H9c2心肌细胞中SOD、MDA、GSH、CAT含量的影响 与对照组比较, 模型组心肌细胞胞内SOD、GSH、CAT含量降低,MDA含量升高,差异有统计学意义。与模型组相比,经OMT低、高浓度预处理后细胞内SOD、GSH、CAT含量升高,MDA含量下降,且随着药物浓度的增加变化显著,差异均有统计学意义(P<0.01,表2)。
2.5 OMT对OS损伤的H9c2心肌细胞Bcl-2 mRNA、Bax mRNA、Casepase3 mRNA、Nrf2 mRNA、HO-1 mRNA表达影响 通过RT-PCR检测分析发现,模型组较对照组心肌细胞中Bax mRNA、Casepase3 mRNA表达升高,Nrf2 mRNA、HO-1 mRNA表达呈上升趋势,差异均有统计学意义。经OMT低、高浓度预处理后心肌细胞内Bcl-2 mRNA、Nrf2 mRNA、HO-1 mRNA表达较模型组升高, Bax mRNA、Casepase3 mRNA表达较模型组降低,差异均有统计学意义(P<0.05,表3)。


组别SOD(U/mgprot)MDA(nmol/mgprot)GSH(μmol/gprot)CAT(U/ml)对照组193.05±7.541.33±0.0760.46±0.9950.72±1.24模型组64.51±5.37①6.70±0.05①28.43±1.72①21.26±1.01①OMT 10 μmol/L预处理组90.55±2.27②4.75±0.09②36.87±1.17②34.74±2.41②OMT 50 μmol/L预处理组130.52±5.94②3.22±0.03②44.69±1.96②44.71±1.66②
注:与对照组比较,①P<0.01;与模型组比较,②P<0.01


组别Bcl-2BaxCasepase3Nrf2HO-1对照组11111模型组0.33±0.31①2.13±0.11①3.61±0.43①1.59±0.27①1.51±0.46②OMT 10 μmol/L预处理组0.68±0.43④1.83±0.21④2.71±0.32③1.98±0.33④1.91±0.38④OMT 50 μmol/L预处理组0.81±0.26③1.63±0.47③1.91±0.57③2.24±0.21③2.22±0.41③
注:与对照组比较,①P<0.01,②P<0.05;与模型组比较,③P<0.01,④P<0.05
2.6 OMT对OS损伤的H9c2心肌细胞Nrf2 、HO-1蛋白表达的影响 Western Blot结果显示,模型组心肌细胞较对照组Nrf2、HO-1蛋白表达显著升高,差异有统计学意义。与模型组相比,OMT低、高浓度预处理组心肌细胞Nrf2、HO-1蛋白表达呈上升趋势,差异均有统计学意义(P<0.05,图3,表4)。

图3 不同浓度OMT对H9c2心肌细胞OS损伤后Nrf2和HO-1的western blot 结果
A. 对照组;B.模型组; C. OMT 10 μmol/L预处理组; D. OMT 50 μmol/L预处理组


组别Nrf2HO-1对照组0.87±0.050.54±0.04模型组1.57±0.03①0.73±0.03①OMT 10 μmol/L预处理组1.88±0.03②0.94±0.03②OMT 50 μmol/L预处理组1.94±0.05②1.06±0.01②
注:与对照组比较,①P<0.01;与模型组比较,②P<0.01
3 讨 论
OS的实质是体内氧自由基(reactive oxygen species,ROS)产生过多,超过了自身清除能力而发生的溶酶体、线粒体等损伤[13]。H2O2是体内氧化代谢产物之一,通过与细胞核内的铁离子反应从而产生活性较强的氧自由基引起细胞损伤,同时它还能够通过脂质氧化代谢产物MDA促进蛋白质聚合,诱导细胞凋亡[14]。
凋亡即一种程序性死亡,形态学变化以细胞皱缩、核溶解及 DNA 断裂为特征[15]。心肌细胞凋亡以线粒体凋亡途径为主,该途径主要由Bcl-2家族参与。Bcl-2家族主要由促凋亡蛋白Bax和抗凋亡蛋白Bcl-2组成,通过调节线粒体膜通透性来确定细胞坏死与细胞凋亡的程度[16]。Caspase家族在细胞凋亡中同样发挥着重要作用,当Bax结合到线粒体膜时,线粒体内外膜之间的离子浓度发生改变使细胞色素C流到细胞质中,与含半胱氨酸的天冬氨酸蛋白水解酶9(cysteinyl aspartate specific proteinase 9,Casepase 9)形成凋亡体并激活Caspase 3诱发细胞凋亡[17]。通过RT-PCR发现OMT能够增加Bcl-2,降低Bax和Casepase 3的mRNA表达量,该结果与赵阳[11]实验的蛋白水平表达结果相吻合,说明OMT可以通过抑制线粒体凋亡途径保护心肌细胞。另外本次实验又分别通过形态学染色、Hoechst凋亡染色等对该结论进行补充说明,更加全面地论证OMT这一保护机制。
正常生理状态下,血清中LDH含量较低,仅在细胞膜损伤后细胞内的LDH才能够大量释放,同时SOD作为体内重要的内源性抗氧化剂,可以清除体内过多的氧自由基,减少线粒体损伤,维持细胞稳态[18,19]。研究发现OMT预处理组的细胞上清液中LDH含量和细胞内MDA含量较模型组显著下降,细胞内SOD含量明显升高,说明OMT具有良好的抗氧化损伤作用。这一实验结论与赵阳[11]的研究结论也符合,另外通过对细胞内其他抗氧化剂GSH、CAT的含量进行测定也得出了相同结论,充分证明了OMT提升细胞抗氧化能力的作用。但OMT在心肌细胞损伤中的抗氧化机制目前并不清楚,同时这也是本次实验的研究重点,希望通过进一步了解OMT的保护机制为今后研发新型抗心肌损伤药物提供新的参考方向。
正常情况下Nrf2在细胞质中与Kelch样ECH相关蛋白1重组蛋白(recombinant kelch like ECH associated protein 1,Keap1)以无活性的二聚体形式存在,受到OS损伤后迅速与Keap1分离并进入细胞核。在细胞核内,通过启动下游能够编码抗氧化蛋白基因和Ⅱ相抗氧化酶HO-1等的表达发挥保护作用[20]。同时有研究表明,Nrf2还能够上调Bcl-2的表达发挥抗凋亡作用[21]。本次实验通过RT-PCR与Western Blot分别从RNA与蛋白水平上发现OMT能够通过增加Nrf2的核转移和下游基因HO-1的表达发挥抗氧化作用,表明OMT的抗氧化作用可能与Nrf2/ HO-1信号通路有关。但通过上游哪些基因转录激活Nrf2进入细胞核,同时产生哪些细胞因子促使其激活下游HO-1目前尚不清楚,因此在后续的实验过程中应加以研究探讨。
综上所述,OMT对OS损伤的H9c2心肌细胞具有保护作用,其作用机制可能与OMT上调Nrf2/ HO-1信号通路,提高心肌细胞内SOD、GSH、CAT等抗氧化酶活性,抑制细胞凋亡有关。希望通过对OMT分子机制的研究使其作用靶点逐渐明确,为今后临床用药提供理论依据。

