Bispora sp. MEY-1 来源嗜酸果胶甲酯酶性质分析及其应用研究
王志云, 罗会颖, 姚斌, 徐波, 涂涛*
(1.江西农业大学生物科学与工程学院, 南昌 330045;2.中国农业科学院饲料研究所, 农业农村部饲料生物技术重点实验室, 北京 100081)
果胶低聚糖(pectin oligosaccharide,POS)又称为果胶寡糖,是果胶物质经过解聚反应后产生的具有多种生理功能的低分子质量寡糖产物,以半乳糖醛酸为基本单元,通过α-1, 4糖苷键连接形成,聚合度一般介于2~18,分子量介于200~2 000 Da[1]。目前果胶低聚糖一般通过天然原料中分离、人工合成以及果胶降解等方法获得。工业生产中,常以柑橘皮、苹果渣、甜菜渣、山楂渣等富含果胶的农业食品废弃物为原料,通过化学方法、物理方法和生物酶法将果胶降解以获得果胶低聚糖[2]。通过果胶酶酶解果胶原料既可以实现对农业食品废弃物的再利用,减少资源浪费,同时又产生不同结构和聚合度的果胶寡糖[3],创造新的经济价值。
内切多聚半乳糖醛酸酶通过对底物链随机切割,产生单糖、二糖和三糖,不仅可以有效降解果胶为低聚糖[4],也可以避免物理方法和化学方法在聚合度和结构类型方面难以控制的问题。但是由于农业食品废弃物中果胶来源和种类非常复杂,天然果胶一般包含高酯果胶和低甲氧基果胶(low-methoxyl pectin),而且不同来源的果胶其甲基化程度往往不同,苹果的甲基化程度高达57%,沙棘、梨、豌豆、韭菜叶子和新鲜南瓜中的甲基化程度分别是32%、30%、28%、25%和18%[5]。而已有研究报道,内切多聚半乳糖醛酸酶水解能力因半乳糖醛酸分子上甲酯化程度的增高而降低[6]。PG8fn是来源于Achaetomiumsp. Xz8的典型的GH28 家族的高比活内切多聚半乳糖醛酸酶,能够特异性地水解多聚半乳糖醛酸产生半乳糖醛酸、二聚半乳糖醛酸以及三聚半乳糖醛酸等果胶低聚糖产物[7]。利用内切多聚半乳糖醛酸酶PG8fn与果胶甲酯酶协同降解果胶原料可以从食品加工副产物中高效获取低酯果胶低聚糖。
果胶甲酯酶(pectin methylesterase)属于羧酸酯水解酶。大多存在于植物组织中,广泛存在于胡萝卜、番茄、马铃薯、脐橙、苹果、番木瓜以及葡萄等植物中,在曲霉、假单胞菌和芽孢杆菌中也有报道。目前研究的果胶甲酯酶适应pH范围较为广泛,有酸性、中性和碱性三类,大多数植物来源的果胶甲酯酶的最适pH及其等电点都偏中性或碱性[8-10],理论分子量集中在20~40之间。而真菌来源,如来源于黑曲霉的果胶甲酯酶,一般是嗜酸性的[11-12]。嗜酸真菌Bisporasp. MEY-1 能分泌产生多种重要的工业用酶,其中包括木聚糖酶[13]、β-葡聚糖酶[14]、半乳糖苷酶[15]、果胶酶[16]等。本研究从嗜酸真菌Bisporasp. MEY-1基因组成功克隆了一个果胶甲酯酶基因,并命名为Pem8A,在毕赤酵母中成功高效表达,并进行了酶学特征的研究,对其在食品加工副产物中的再利用进行了初步探讨。
1 材料与方法
1.1 菌株、载体及试剂
Bisporasp. MEY-1分离自江西省山南“721矿”的铀矿废水。大肠杆菌Trans1-T(TransGen,北京,中国)和毕赤酵母GS115(Invitrogen,Carlsbad,CA,USA)分别用于DNA测序和异源表达宿主。 pEASY-T3(TransGen)和pPIC9(Invitrogen)质粒分别用作基因克隆和表达载体。试验所用的总RNA提取试剂盒和反转录试剂盒分别购自Promega(Madison, Wisconsin, USA)和TOYOBO(Osaka, Japan);高保真DNA聚合酶Fastpfu Fly购自北京全式金生物技术有限公司(北京,中国);质粒提取试剂盒购自Omega(Norcross, Georgia,USA),T4 DNA连接酶和限制性内切核酸酶均购自TaKaRa (Otsu, Japan)。酯化程度为50%~70%的橘皮果胶来自Sigma(San Diego, CA, USA),用于果胶甲酯酶酶活测定。其他常见化学试剂均为分析纯,购自西陇科学股份有限公司。
1.2 培养基配制
试验中所用培养基有诱导培养基(0.5% (NH4)2SO4, 0.1% KH2PO4, 0.05% KCl, 0.05% MgSO4·7H2O, 0.001% FeSO4·7H2O, 0.01% CaCl2, 1.0%果胶)、马铃薯葡萄糖液体培养基(PDB)、LB液体培养基、LB固体培养基、MD固体培养基、BMGY培养基、BMMY培养基和YPD培养基[17]。
1.3 基因序列信息的获取及分析
根据Bisporasp. MEY-1的全基因组测序结果,查找到一个8家族果胶甲酯酶基因,命名为Pem8A,并对该基因进行生物信息学分析。将果胶甲酯酶Pem8A的基因序列通过BLASTx(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行同源序列检索,从而对该基因的新颖性进行评估,通过Signal P 4.1(http://www.cbs.dtu.dk/services/SignalP/)对N-末端信号肽进行预测,NetNGlyc 1.0(http://www.cbs.dtu.dk/services/NetNGlyc/)和NetOGlyc 4.0(http://www.cbs.dtu.dk/services/NetOGlyc/)预测可能的N-糖基化和O-糖基化位点。利用Vector NTI Advance 11.5软件将基因序列翻译成氨基酸序列后,用于预测的分子量和理论等电点。用Discovery Studio 2017(Accelrys,USA)软件进行同源性建模。
1.4 果胶甲酯酶基因Pem8A的克隆与毕赤酵母表达载体构建
为了诱导果胶甲酯酶产生,将Bisporasp. MEY-1 菌株接种在含有1.0%果胶的诱导培养基中,并于 30 ℃下200 r·min-1震荡诱导培养3 d。收集峰值时期的菌丝,置于预冷的灭菌研钵中,立即倒入液氮研磨至粉末状。采用RNA分离系统提取菌丝总RNA,然后参照ReverTra Ace-a-TM kit反转录试剂盒方法,将RNA反转录合成cDNA。设计分别含有EcoRI和NotI酶切位点的引物(Pem8AF:5’-CGGAATTCATGAAAGCAT-TCGATTTCCTCACTTGCGCGT-3’,Pem8AR:5’-CTAACTAAGATATGAGGTATCTACAAACGAGCG-GCCGCAA-3’,其中下划线处指酶切位点),然后以cDNA为模板进行PCR扩增。PCR反应体系:5×FastpfuFly buffer 10 μL,dNTP 5μL,cDNA 2 μL,引物Pem8AF 1 μL,引物Pem8AR 1 μL,FastpfuFly 1 μL,ddH2O 30 μL,总体积50 μL。PCR扩增程序:95 ℃ 5 min;95 ℃ 30 s, 65 ℃ 30 s, 72 ℃ 40 s,30个循环;72 ℃ 10 min;4 ℃保存。
1.5 果胶甲酯酶基因Pem8A的异源表达及纯化
将经测序验证正确的表达载体pPIC9-Pem8A用限制性内切酶BglⅡ线性化处理后,通过电击转入毕赤酵母GS115感受态细胞中,将转化子涂布组氨酸缺陷型的MD平板于30 ℃培养箱培养3 d,然后挑取96个单克隆菌落于3 mL BMGY液体培养基中培养(30 ℃、250 r·min-1),培养2 d后4 500 r·min-1离心5 min,弃上清并收集菌体,然后重悬于1.0 mL的BMMY诱导培养基中诱导培养2 d。最后,通过酶活检测挑选出活性最高的克隆子于1 L摇瓶中进行放大培养。将筛选的高酶活转化子在YPD培养基中经3 d活化(30 ℃、200 r·min-1),接种于300 mL BMGY液体培养基中,接种量为1.0%。30 ℃条件下培养72 h后,4 500 r·min-1离心5 min,收集菌体转入200 mL含有0.5%甲醇的BMMY液体培养基继续培养48 h,诱导期间每隔12 h补加1.0 mL甲醇,使甲醇终浓度控制在0.5%左右。
诱导结束后,将诱导后的培养液12 000 r·min-1冷冻离心15 min,弃去菌体及其不溶性杂质,用截留分子量为5 kD的Vivaflow 200膜包(Vivascience,Hannover,Germany)超滤浓缩上清液至20 mL,然后于pH 6.0、10 mmol·L-1柠檬酸-磷酸盐缓冲液中在4 ℃条件下过夜透析脱盐处理。将透析处理的酶液通过阴离子交换层析缓冲液过夜透析脱盐,脱盐后的粗酶液通过阴离子交换柱(HiTrap Q HP 5 mL FPLC,GE Healthcare, Uppsala, Sweden)系统纯化,获得纯化的目的蛋白,所有的纯化步骤都在4 ℃条件下执行。取纯化后的酶液用Endo H(New England Biolabs, Ipswich, MA, USA)在37 ℃水浴中温育2 h进行脱N糖基化处理。最后,将纯化后的蛋白与去除N-糖基化修饰的蛋白进行SDS-PAGE电泳分析。
1.6 酶学性质测定
1.6.1果胶甲酯酶PEM8A的活力测定 果胶甲酯酶PEM8A活力测定所使用的底物为酯化程度为50%~70%的橘皮果胶,反应体系为25 mL,质量分数为0.1%的橘皮果胶在终浓度为117 mmol·L-1NaCl条件下,加入1 mL适当稀释过的酶液,在一定pH和温度下孵育反应10 min;在孵育反应过程中通过2 mmol·L-1的NaOH对反应体系的pH进行调试,使反应体系的pH和设定值保持一致直至反应停止,通过NaOH缓冲液的补偿体积计算酶活,每组3个重复;活性定义为在标准条件下每min释放1 μmol羧酸,即为一个酶活力单位(U·mL-1)。
1.6.2PEM8A的最适pH测定 选择50%~70%的橘皮果胶为底物,通过适当稀释纯化后的PEM8A于55 ℃,在不同pH条件(pH 2.5~7.0)下进行酶促反应以测定其酶活力,其中测定酶活最高时对应的pH即为该酶的最适pH。pH 稳定性的测定方法为:将纯化的酶液调至pH 2.0~10.0范围内,37 ℃孵育1 h,然后于pH 3.5条件下60 ℃反应10 min,测定其剩余酶活,计算不同pH处理下的相对剩余酶活。
1.6.3PEM8A的最适温度测定 选择50%~70%的橘皮果胶为底物,在pH 3.5条件下,分别在40、50、55、60、65、70、80 ℃温度条件下测定PEM8A酶活力,其中测定酶活最高时对应的温度条件即为该酶的最适温度。将纯化的PEM8A分别在55、60和65 ℃条件下孵育2~60 min不等时间,然后测定其剩余酶活。以0 ℃处理的样品为对照(100%),分别计算不同温度不同时间处理后样品的剩余酶活。
1.6.4不同金属离子和化学试剂对PEM8A活力的影响 在酶促反应体系中分别加入1.0 mmol·L-1金属离子及有机溶剂(K+、Ca2+、Co+、Cr2+、Mn2+、Mg2+、Ni2+、Pb2+、Cu2+、Zn2+、Li+、EDTA、SDS、β-巯基乙醇)研究其对酶活性的影响。在pH 3.5和60 ℃下测定PEM8A活力,以未加金属离子及有机溶剂酶活力为对照,将其定义为100%。每组试验设置3个重复。
1.6.5PEM8A的动力学常数测定 选用酯化程度为50%~70%的橘皮果胶,在0.01~1.0 mg·mL-1底物浓度的反应体系和60 ℃、pH 3.5条件下5 min测定酶活,通过GraphPad Prism 5软件进行数据处理分析,计算其比活、Vmax、Km值。
对于税负的多少来说,不仅受收入和费用的影响,税率也是影响其大小的关键之一。本次个税改革,税率没有变更,但是税率级距增加了(如表2所示)。税率不变,税率级距的增加则会让更多的中低收入者的收入划入税率较低的档,从而减少应纳个人所得税额。
1.6.6PEM8A对橘皮、苹果渣粗提果胶酶活的测定 以质量体积分数为0.1%酯化程度的50%~70%果胶和橘皮、苹果渣粗提果胶为底物,pH 3.5,60 ℃条件下测量酶活,每个反应体系设置3个重复和空白对照。
1.6.7PEM8A酶与多聚半乳糖醛酸酶PG8fn的协同作用 首先,在最适条件下对已纯化的内切多聚半乳糖醛酸酶PG8fn进行酶活的测定,测定方法为:取100 μL适当稀释倍数的酶液(200 mmol·L-1Na2HPO4-柠檬酸 Buffer,pH 6.0)于900 μL 0.33%多聚半乳糖醛酸(200 mmol·L-1Na2HPO4-柠檬酸 Buffer,pH 6.0),45 ℃反应10 min,加入1.5 mL DNS终止反应。以反应结束加入1.5 mL DNS 终止后补加100 μL 稀释酶液作为对照组,每组3个重复,反应体系在沸水中煮5 min,冰水冷却后在540 nm下测定OD值,酶活计算方法参考华婷等[18]。
在25 mL质量体积分数0.1%的橘皮、苹果渣果胶粗提物、终浓度为117 mmol·L-1NaCl的反应体系中加入39.2 U单位的已纯化的果胶甲酯酶PEM8A,pH条件为3.5,放置于60 ℃的恒温水浴震荡摇床中200 r·min-1分别酶解0、4、8、12、24 h。以处理过的质量体积分数为0.1%的橘皮、苹果渣果胶粗提物为底物,pH调至6.0,在PG8fn的标准反应体系下分别进行酶活测定,每组3个重复。
2 结果与分析
2.1 果胶甲酯酶基因Pem8A的克隆与序列分析
从嗜酸真菌Bisporasp. MEY-1成功克隆到果胶甲酯酶基因Pem8A,分析可知Pem8A的全长DNA和cDNA序列均为1 002个碱基对,不存在内含子序列。对其编码的氨基酸序列进行信号肽预测,结果表明,cDNA可编码316个氨基酸,N端1~18个氨基酸为信号肽序列,成熟肽部分的理论分子量为33.7 kD,预测等电点为3.95。PEM8A的氨基酸序列与来源于Coniellalustricola的果胶甲酯酶的氨基酸序列相似性高达98%。PEM8A与已报道晶体结构的果胶甲酯酶的相似性较高,其中与黑曲霉来源的果胶甲酯酶的晶体结构5C1E的序列相似性高达93%,而与胡萝卜来源的果胶甲酯酶晶体结构1GQ8的序列相似性为79%。以PDB中ID号为5C1E的果胶甲酯酶晶体为模板对 PEM8A进行同源建模(图1),从结构上分析,催化中心包含Gln176、Asp177、Asp198和Arg267,Arg267通过侧链上的两个氧原子与Asp198上的氢形成氢键,作为亲和攻击的位点,而Asp177在催化过程中起酸碱的作用。谷氨酰胺Gln154和Gln176的侧链可以形成一个阴离子孔,主要是稳定带负电荷的甲基化的D-半乳糖醛酸单元(图1)。
2.2 果胶甲酯酶PEM8A的表达和纯化
将诱导获取的粗酶液进行浓缩纯化后,对纯化蛋白进行SDS-PAGE电泳验证,结果(图2)表明,毕赤酵母表达的果胶酸裂解酶PEM8A的表观分子量最小,接近37 kD,并且存在3条蛋白条带,相较预测理论分子量(33.7 kD)更大,分析PEM8A的氨基酸序列,有可能因糖基化造成分子量偏大。通过液相色谱-电喷雾串联质谱(LC-ESI-MS)对SDS-PAGE分离的PEM8A蛋白条带进行分析,3条蛋白条带检测的肽段分别对应于PEM8A序列(图2)。其中每个蛋白条带中均检测到与目的序列相匹配的氨基酸序列“VETTNFKMYNINVK”和“VLTADLGYITASGR”,其覆盖度为15.99%,充分证明其为目的蛋白PEM8A。在通过Endo H脱糖基后PEM8A的分子量均明显变小,但依然比其理论分子量大许多,表明PEM8A除了发生N糖基化,还存在部分O糖基化。网站预测其糖基化修饰位点,发现N糖基化修饰位点分别为N90、N125、N127、N130和N236,O糖基化修饰位点分别为T22、S26、E302、S305和E308。
2.3 PEM8A酶学性质测定
pH、温度和时间对PEM8A酶活的影响结果(图3)显示,PEM8A的最适pH为3.5,整体嗜酸。且在pH 2.5~5.0范围内,维持50%以上酶活力,pH在7.0基本检测不到酯酶活性,表明PEM8A是一类嗜酸性酶,在酸性范围内具有较高酶活性。PEM8A具有很好的pH稳定性,在酸性环境中保持稳定,在pH 2.0~5.0时仍保持88%以上的剩余酶活,在pH 6.0时仍保持60%以上的剩余酶活。
由于全自动电位滴定仪中pH电极的耐受最高温度为80 ℃,PEM8A的最适温度为60 ℃,在55~80 ℃有80%左右的相对酶活,但在40 ℃时仅有48%左右的相对酶活,表明PEM8A是一类嗜热酶。PEM8A具有较好的热稳定性,55 ℃环境中处理1 h后仍可保持82%的剩余酶活,高度稳定;60 ℃环境中处理30 min,仍有60%的剩余酶活;65 ℃环境中处理30 min,仍有45%的剩余酶活。
2.4 PEM8A的动力学常数测定
PEM8A在pH 3.5、温度60 ℃,以酯化程度为50%~70%的橘皮果胶为底物的比活为(485.02±10.3) U·mg-1,Vmax值为476.8 μmol·min-1·mg-1,Km值为0.034 mg·mL-1。
2.5 金属离子及有机溶剂对PEM8A活性的影响
在酶促反应体系中添加不同金属离子和有机溶剂后PEM8A的酶活结果(表1)显示,在1 mmol·L-1的终浓度下,Ni2+、Cu2+、Li+、EDTA、SDS和β-巯基乙醇对PEM8A活性具有显著促进效应,与CK相比,PEM8A活性分别提高58.7%、51.5%、62.3%、57.5%、58.7%和57.0%。K+、Co+、Zn2+对PEM8A的酶活促进效果不显著。金属离子Ca2+、Cr2+、Mn2+、Mg2+、Pb2+对PEM8A的酶活具有一定的抑制效果。
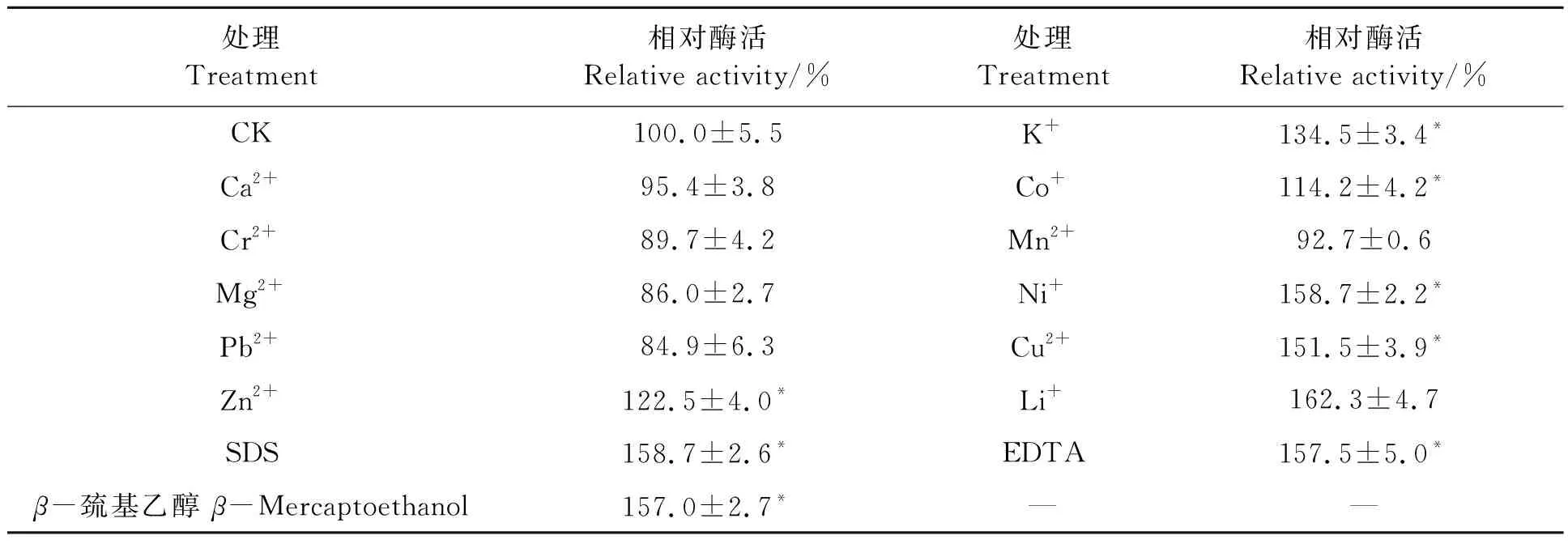
表1 不同金属离子或化学试剂处理对PEM8A活力的影响Table 1 Effects of metal ions and chemical reagents on the activity of PEM8A
2.6 橘皮、苹果渣果胶的提取率测定
在果胶低聚糖的可能来源中,食品废弃物是主要的研究对象。近年来,利用农业食品工业中的橘皮和苹果渣等食品废弃物获取果胶低聚糖已经成为一个越来越重要的问题。食品废弃物橘皮和苹果渣中果胶的含量结果(表2)可知,砂糖橘皮和苹果渣的果胶提取率差异较大,苹果渣的果胶产率仅为3.3%,而砂糖橘皮果胶产率为15.01%。因此,柑橘皮类材料常作为工业上提取果胶的优选原材料。
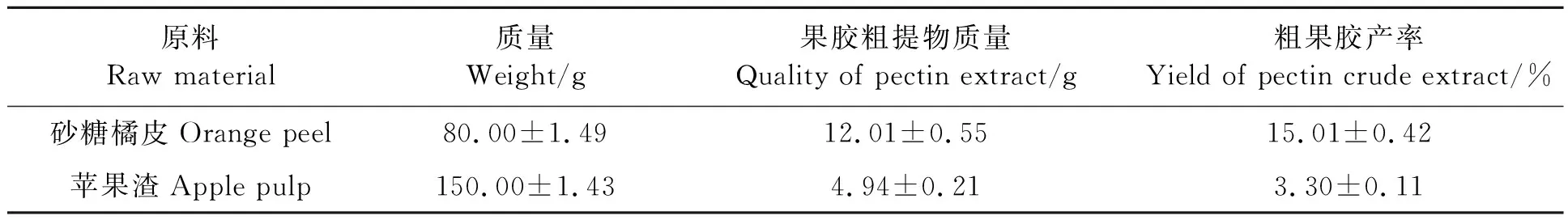
表2 橘皮、苹果渣果胶的提取率Table 2 Extraction rate of orange peel and apple pulp pectin
2.7 PEM8A酶对橘皮、苹果渣粗提果胶酶活的测定
PEM8A对酯化度为50%~70%的橘皮果胶及橘皮、苹果渣粗提果胶的比活分别为(391.7±4.2)、(276.6±4.1)、(287.8±5.1)U·mg-1(图4),表明PEM8A对橘皮、苹果渣粗提果胶均具有较高的活性,说明PEM8A可以有效降低橘皮、苹果渣粗提果胶的甲基化。
2.8 果胶甲酯酶PEM8A与多聚半乳糖醛酸酶PG8fn协同降解
在内切多聚半乳糖醛酸酶PG8fn的最适条件下,以质量体积分数0.33%的多聚半乳糖醛酸为底物测定的PG8fn的比活为(11 005.5±272.8) U·mg-1。对经PEM8A分别酶解0、4、8、12、24 h的苹果渣、橘皮果胶粗提物进行内切多聚半乳糖醛酸酶PG8fn活性测定,结果(图5)表明,未经PEM8A处理的果胶中PG8fn活性明显较低,分别只有(397.2±41.3)、(1 865.0±113.7)U·mg-1,随着PEM8A对橘皮、苹果渣果胶粗提物的酶解时间延长,PG8fn的酶活也逐步增高,当PEM8A的处理时间延长至24 h,PG8fn对经PEM8A去甲基化的苹果渣、橘皮果胶粗提物的酶活分别达到(3 807.4±59.2)和(3 744.4±105.7)U·mg-1,较未处理前分别提高了8.5倍和1倍左右。
3 讨论
经过NCBI 基因库的比对和同源建模验证,发现来源于Bisporasp. MEY-1的Pem8A是第8家族的果胶甲酯酶基因,与表达质粒pPIC-9r连接后成功在毕赤酵母中表达。经纯化后的PME8A分子量大小为37 kD,其比活为(485.02±10.3)U·mg-1,Vmax值为476.8 μmol·min-1·mg-1,Km值为
0.034 mg·mL-1。Xia等[19]和 Zhang等[20]分别实现了产黄青霉和黑曲霉的果胶甲酯酶在毕赤酵母中异源高效表达,摇瓶水平表达量分别为1.09 和77.1 U·mL-1,而TalaromycesleycettanusJCM12802[18]来源果胶甲酯酶在发酵罐水平表达量高达428 U·mL-1。本研究中重组果胶甲酯酶PME8A摇瓶水平表达量为47.2 U·mL-1,其表达量具有一定的优势,为工业化大规模应用提供了参考。
据报道大多数植物来源的果胶甲酯酶都是中性或碱性的,其最适pH范围在7.0~9.0之间。如来源于葡萄[21]和刺果番茄枝[22]的果胶甲酯酶最适pH为7.0,来源于脐橙和向日葵花盘的果胶甲酯酶最适pH为7.6和7.5,来源于番茄[23]和大豆细胞壁[24]的果胶甲酯酶最适pH为8.0,来源于柑桔和金尾虎果的果胶甲酯酶最适pH为9.0。而PEM8A是一类嗜酸的果胶甲酯酶,最适pH为3.5,在酸性至中性环境中稳定,在pH 2.0~5.0时仍保持88%以上的剩余酶活。PEM8A成熟肽的预测等电点为3.95,在嗜酸性酶的研究中发现导致该酶嗜酸的原因可能是pI值低和带负电荷多分布在分子的表面[25]。与碱性果胶甲酯酶结构相比,可知PEM8A在蛋白质表面(Asp118、Asp122、Asp123、Asp152和Glu194)和催化中心分布的带负电荷氨基酸可能与PEM8A的嗜酸性有关[26]。
真菌来源的果胶甲酯酶大多属于中温酶,最适温度在50~70 ℃之间,如来源于Clostridiumthermocellum的CtPME最适温度为60 ℃[8],来源于TalaromycesleycettanusJCM12802的PmeT最适温度为75 ℃[20]。本研究中,PEM8A最适温度为60 ℃,属于中温型真菌果胶甲酯酶,其有效作用温度整体偏高,在中温(40 ℃)环境中也有48%左右的相对酶活,在55~80 ℃的环境中也有80%左右的相对酶活。PEM8A在55 ℃环境中处理1 h后仍可保持82%的剩余酶活,具有较好的温度稳定性。如来源于Erwiniachrysanthemi3937的PMEA[27]和来源于ErwiniachrysanthemiB374的PME[28]都只能在中低温下保持稳定。从PEM8A的氨基酸序列分析可知,PEM8A的氨基酸组成中Ser和Thr含量丰富,分别在氨基酸总数中占13.6%和11.4%,Ser和Thr残基容易发生O糖基化,SDS-PAGE凝胶电泳分析也验证了O糖基化的存在,而糖基化作用能够有效稳定蛋白质骨架,增加酶的热稳定性[29-31]。
目前果胶甲酯酶主要应用在通过提高果粒的硬度来改善果粒饮料的口感[32],和通过果胶甲酯酶对高酯果胶进行去甲基化来获取低酯果胶[33]等方面。但是利用果胶甲酯酶对果胶进行去甲基化获取低酯果胶,再通过内切多聚半乳糖醛酸酶降解低酯果胶来获取果胶低聚糖的研究较少。本研究中通过极端嗜酸真菌Bisporasp. MEY-1来源的果胶甲酯酶PEM8A对食品加工副产物橘皮和苹果渣来源的果胶粗提物进行去甲基化处理,再利用来源于Achaetomiumsp. Xz8的典型GH28家族的内切多聚半乳糖醛酸酶PG8fn降解果胶。以苹果渣和橘皮粗提物为底物,测得PG8fn的活性较低,分别只有(397.2±41.3)和(1 865.0±113.7)U·mg-1,是因为苹果渣和橘皮来源的果胶都有不同程度的甲基化,而内切多聚半乳糖醛酸酶仅能裂解游离的聚半乳糖醛酸却不能裂解甲基化的底物[34]。通过PEM8A降解果胶中的甲基,随着PEM8A反应时间的延长,PG8fn酶活力逐步增加。PEM8A的处理时间延长至24 h时,相较未处理前,苹果渣和橘皮粗提物中的PG8fn酶活分别提高了8.5倍和1倍。结果表明,PEM8A对橘皮、苹果渣果胶粗提物具有显著的去甲基化作用,能够为内切多聚半乳糖醛酸酶PG8fn进一步水解果胶来获取果胶低聚糖过程中去除甲基化带来的影响。

