小麦类钙调素新亚型基因TaCML25/26调控抗叶锈性
刘鹏, 韦杰, 杨毅清, 张娜, 温晓蕾,2, 范学锋,杨文香*, 刘大群*
(1河北农业大学植物病理学系,河北省农作物病虫害生物防治工程技术研究中心,国家北方山区农业工程技术研究中心,河北 保定 071001;2 河北科技师范学院农学与生物科技学院,河北 秦皇岛 066004)
小麦叶锈病由小麦叶锈菌(Pucciniatriticina)引起,在世界范围内普遍发生,发生严重时可造成40%甚至更高的产量损失[1],严重威胁粮食安全。抗病基因的利用是控制小麦叶锈病的有效途径。Ca2+-CaM信使系统在小麦抗病过程发挥着重要作用[2-4]。Ca2+是多种生物胁迫和非生物胁迫信号转导中的第二信使,其广泛存在于植物细胞中,通过将来自胞外刺激传递至胞内,调节胞内反应[5]。植物中Ca2+结合蛋白包括CaMs(钙调蛋白)、CMLs(钙调蛋白类蛋白)、CDPKs/CPKs(Ca2+依赖性蛋白激酶)、CBLs(钙调蛋白类蛋白)和CIPKs(CBL互作蛋白激酶)。CaM在结构上高度保守,存在于所有真核生物中,而CMLs、CPKs以及CBLs仅存在于植物和原生生物中[6]。钙调蛋白(CaM)是细胞内主要的Ca2+受体,通过EF-hand结构域识别并结合特定的Ca2+信号,通过与靶钙调蛋白结合蛋白(CaMBP)的钙调蛋白结合结构域(CaMBD)互作来转移Ca2 +信号[7-8]。CML是与CaM相似性较高的钙离子结合蛋白大家族,具有2~6个EF-hand结构域,无任何其他已知的功能结构域[9-10]。
CaM/CML的许多靶蛋白直接或间接调节植物对环境胁迫的反应[11]。已有研究表明,拟南芥中AtCML20[12]、AtCML36[13]和AtCML39[14]及番茄中的ShCML44[[15]在植物的抗逆过程中发挥重要作用。同时发现植物的CaM/CML基因在植物的不同组织中具有表达特异性。前人通过组织RNA印迹和荧光定量分析发现小麦[16]、马铃薯[17]、大豆[18]的CaM/CML基因在不同器官中均有不同程度的表达。水杨酸(salicylic acid, SA)、脱落酸(abscisic acid, ABA)作为重要的信号分子调控植物的抗病反应[19-20]。外源植物激素脱落酸诱导TaCaM5上调表达,水杨酸诱导其下调表达[3];拟南芥中AtCML24负向调节植物对ABA抗性[21];受钙/钙调素信号控制的AtSR1/CAMTA3转录因子可以抑制R基因激发的抗病信号基因EDS1和NDR1的表达进而防止SA的过度产生[22]。
CaMs和CMLs也被证明参与植物的防御反应。Choi等[23]发现辣椒钙调蛋白CaCaM1参与细胞死亡和防御反应,而且是活性氧(reactive oxygen species, ROS)和一氧化氮(NO)形成所必需的。拟南芥中,AtCML24[21]、AtCML9[24]、AtCML8[25]、AtMPK8[26]、AtCBP60g[27]和AtCAMTA3[28]参与植物的防御反应。AtCML9[24]和AtCML8[25]正向调节对丁香假单胞菌的防御反应;AtMPK8[26]调节ROS含量、CaM结合蛋白CBP60g[27]调节SA含量及AtCAMTA3负向调节SA合成基因EDS1的表达,参与植物的防御反应[28],CaM还可通过调节氨基丁酸(γ-aminobutyric acid, GABA)合成和GABA分流代谢途径间接参与调节ROS含量参与植物的免疫反应[29]。
目前,从小麦(TriticumaestivumL.)中鉴定出40个CaM基因,这些基因分别编码13个钙调蛋白CaM[5]。根据TaCaMs的系统发育树及其基因结构和基序,将这些TaCaM基因分为三个亚家族:TaCaM I、TaCaM Ⅱ和TaCaM Ⅲ[6]。研究表明,小麦类钙调素基因TaCML20[30]通过调节水溶性碳水化合物(water soluable carbohydrate, WSC)的浓度参与植物的干旱反应,TaCML79基因在根和地上部分受到热激、NaCl、渗透和冷胁迫的诱导或抑制,推测该基因可能与植物抗逆有密切相关性[31]。小麦类钙调素基因TaCML36通过调节乙烯信号通路中可能存在的抗病相关基因的表达,参与对土传真菌Rhizoctoniacerealis防御反应[32];TaCaM5可能通过茉莉酸和乙烯等信号途径参与小麦对条锈菌的防御反应,同时参与机械伤害、低温和干旱环境下Ca2+-CaM信号转导途径[3]。
前期研究表明,Ca2+-CaM/CML信使系统可能在小麦抗叶锈病过程中起着重要作用[2],并且不同的CaM亚型可能调控不同的抗病途径[33]。Wang等[34]通过实时定量试验发现钙调蛋白结合转录激活因子TaCAMTA4在小麦抵抗叶锈菌侵染过程前期起负调控作用。然而CAMs/CMLs参与小麦—叶锈菌互作信号通路的分子机制尚不清楚,关于CaMs/CMLs在小麦抗叶锈菌中的作用有待深入研究。
本研究前期发现在TcLr19和其感病突变体中存在一个显著差异表达的CaM/CML基因,该基因与抗叶锈性之间的关系有待于明确。因此,本研究从小麦cDNA中分离克隆抗感不同文库中显著表达的CML基因,分析其基本特性和小麦与叶锈菌互作及激素SA、ABA诱导下的表达特征,研究为深入分析与了解CML基因的功能及其在抗病中的作用奠定基础。
1 材料与方法
1.1 试验材料及处理
小麦抗叶锈病近等基因系TcLr19、小麦感病突变体Mu19、小麦叶锈菌种THTT(对TcLr19表现低毒力,对Mu19表现高毒力)皆由河北农业大学小麦叶锈病研究中心提供。
将TcLr19和Mu19的种子播种于直径为10 cm,高度为10 cm的花盆中播种,每盆种10~15粒,置于温度18~25 ℃、光照10~14 h的温室内培养。待幼苗长至一叶一心期,将叶锈菌菌株THTT的夏抱子均匀接种在部分幼苗叶片上,接种后喷水雾保湿,置黑暗条件下14~16 h,然后继续转入温室培养。取剩余幼苗分别用5 mmol·L-1SA、0.01 mmol·L-1溶液喷洒叶片表面直至溶液滴下,然后继续转入温室培养。分别于接种或喷洒激素后0、6、12、24、36、48、72、96、120 和144 h剪取叶片0.1 g,液氮速冻,-80 ℃储藏备用。其中,小麦叶片接种或喷洒清水为对照。生长2周的幼苗根、茎和叶用于不同组织表达研究。
1.2 试验仪器和试剂
试验使用的仪器包括:PCR扩增仪(德国Eppendorf公司)、Real-time PCR定量仪(Lightcycler®96, Rocle公司)、电子天平(美国Adventurer公司)。
TaKaRa MiniBEST Plant RNA Extraction Kit购自日本TaKaRa公司,DNA回收试剂盒、DNA小量抽提试剂盒均为上海生工生物工程有限公司生产,荧光定量试剂为北京全式金公司生产,反转录试剂盒采用ABM公司的5×All-In-One RT MasterMix。引物合成及测序工作由上海生工生物工程有限公司完成。
1.3 植物总RNA的提取及cDNA第1链的合成
采用TaKaRa MiniBEST Universal RNA Extraction试剂盒提取植物RNA,每个样品设置4个生物学重复。cDNA第1链的合成利用ABM公司的5×All-In-One RT MasterMix。
1.4 小麦TaCML25/26基因的克隆
以小麦近等基因系TcLr19的cDNA为模版,利用Primer 5已经设计好的引物进行PCR扩增。上游引物TaCML25/26-F:3’-A A T T T G G T G A C A A G G T T G C T A GG,下游引物TaCML25/26-R:3’-G G G C A A A A C A A T G A AT G A A T G AA。
PCR反应体系:cDNA 1 μL,10×PCR buffer 2.5 μL,dNTP mix 0.5 μL,10 μmol·L-1的上下游引物各0.5 μL,DNA聚合酶(1.5 U) 0.5 μL,ddH2O 9.5 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。回收PCR产物片段与pMD19-T Vector(TaKaRa)连接,转化E.coliDH5α,酶切筛选阳性克隆,并对阳性克隆进行测序验证。
1.5 TaCML25/26 生物信息学分析
使用NCBI的Blastx对TaCML25/26基因进行序列分析;使用ProtParam(http://web.expasy.org/protparam/)预测CML蛋白质分子量和理论等电点;用NetPhos 2.0 Server(http://www.Cbs.dtu.dk/services/NetPhos/)预测CML蛋白质磷酸化位点;用SingalP 5.0 Server预测CML氨基酸序列的信号肽;用TMHMM Server V.2.0 预测CML氨基酸序列的跨膜结构域;用TargetP预测CML蛋白的亚细胞定位;用DNAMAN进行CML氨基酸的多序列比对;利用MEGA 6构建CML的系统进化树;用SWISS-MODEL space(https://www.swissmodel.expasy.org/)构建CML的三维模型。
1.6 实时荧光定量PCR
参照TransStartTop Green qPCR SuperMix试剂盒的实时荧光定量PCR引物原则,设计目标基因qRT-PCR引物,上游引物TaCML25/26-qRT-F:3’-G A C C A T G G TG G T A C C G T CG;下游引物TaCML25/26-qRT-R:3’-C G G A T A T G T C C T C G C C C A AG。 以小麦GAPDH为内参,实时荧光定量PCR反应体系 25 μL:qPCR Master Mix(2×) 12.5 μL、cDNA模板4 μL、10 μmol·L-1的上下游引物各0.8 μL和去离子水6.9 μL。反应条件:94 ℃ 30 s;94 ℃ 5 s,58 ℃ 30 s,72 ℃ 10 s,35个循环。根据扩增曲线确定每个基因和样本相应的Ct值,以GAPDH为内参基因,采用2-ΔΔCt[35]方法计算。
2 结果与分析
2.1 TaCML25/26基因克隆及序列分析
根据本研究前期获得的文库中的显著差异表达的CaM/CML序列,从小麦近等基因系TcLr19的cDNA中扩增获得一条长度为458 bp的序列,编码147个氨基酸,理论等电点为4.55,分子量为16.59 kD。序列分析结果显示TaCML与粗山羊草AtCML25/26相近,相似性为99%,将该基因命名为TaCML25/26。保守结构域预测表明该蛋白具有一个EF-hand_8结构以及多个EFh保守结构域结构,分别位于序列314~449和36~445区(图1)。
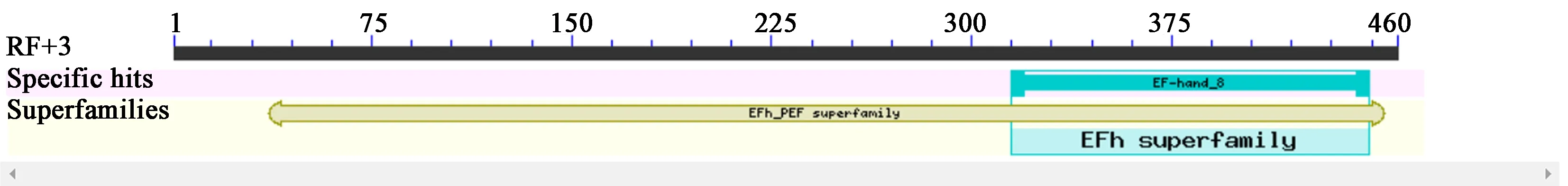
图1 TaCML25/26蛋白的EF手型保守结构域Fig.1 EF-hand domains in TaCML25/26
将TaCML氨基酸序列与其他物种进行同源比对,分析结果表明,TaCML25/26与粗山羊草的CML的亲缘关系最近,与穿心莲的亲缘关系次之(图2)。

图2 TaCML25/26 与其他物种CML的进化树分析Fig.2 Phylogenetic tree of TaCML25/26 and other CML
通过氨基酸序列比对和系统进化树分析发现(图3),TaCaM Ⅰ与TaCaM Ⅱ有两个氨基酸的差异,分别位于第125、139位氨基酸。与TaCaM Ⅰ和TaCaM Ⅱ相比,TACaM Ⅲ(TaCaM 2-1(AAC49581.1))N端前24个氨基酸特异性较强,TaCaM5与TaCaM Ⅰ和TaCaM Ⅱ相比,存在21个差异氨基酸,均匀分布于整个氨基酸序列,与TaCaM Ⅲ相比共有39个差异氨基酸,其中19个氨基酸集中分布N端,其余差异氨基酸均匀分布于整个氨基酸序列。本研究克隆到的小麦CML基因TaCML25/26,编码147个氨基酸,与TaCaM Ⅰ、TaCaM Ⅱ、TaCaM Ⅱ和TaCaM5相比,序列形似性分别为31.21%、31.21%、28.76%和29.30%。对其蛋白结构进行分析发现,这些基因均含有Ca2+结合位点和EFh保守结构域,与TaCaM Ⅰ、TaCaM Ⅱ、TaCaM Ⅲ和TaCaM5相比,TaCML25/26含有EF-hand_8结构域和多个EFh保守结构域,Ca2+结合位点位于N端,与上述基因家族存在显著差异,聚类分析显示该蛋白单独聚为一类(图4)。因此可以确定TaCML25/26为一个新的小麦CML亚型基因。
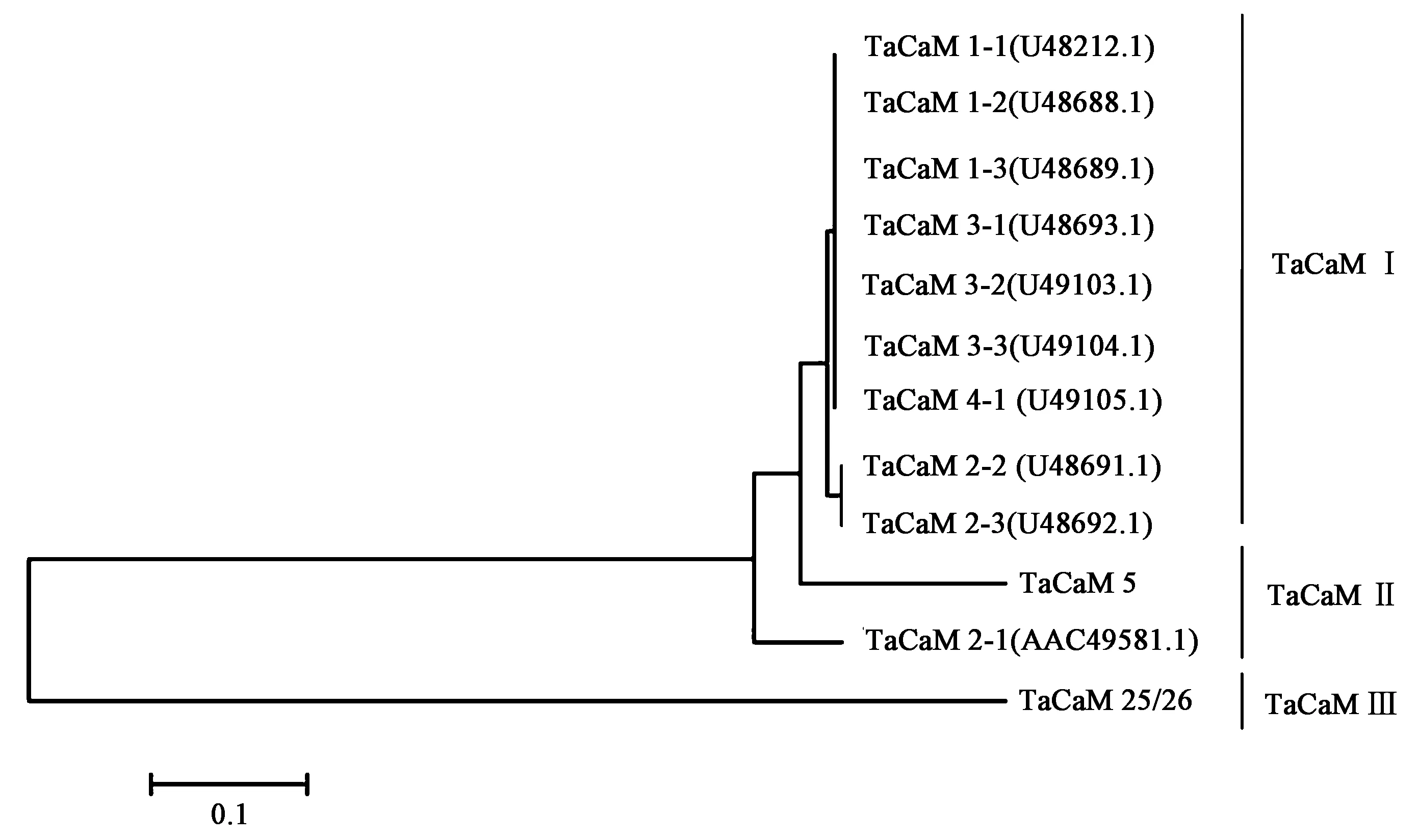
图3 TaCML25/26与小麦其他CaM亚型的进化树分析Fig.3 Phylogenetic tree of TaCML25/26 and other wheat CaM isoforms
2.2 TaCML25/26理化性质
依据ProtParam预测TaCML25/26编码29个酸性氨基酸(Asp+Glu),16 个碱性氨基酸(Arg+Lys)。使用NetPhos 2.0 Serve进行磷酸化位点预测,结果显示TaCML25/26编码的两条氨基酸序列中均含有1个苏氨酸(threonine)位点、2个丝氨酸(serine)位点和3个酪氨酸(tyrosine)位点,说明钙调蛋白的活性可能受磷酸化作用的调控。
使用Singal P 5.0 Server进行信号肽预测,结果显示TaCML25/26编码的氨基酸序列均无信号肽位点,可以判断钙调蛋白属于非分泌性蛋白质。使用TMHMM Server V. 2.0预测显示TaCML25/26编码的氨基酸序列无跨膜结构。TargetP预测显示TaCML25/26在cTP(叶绿体转运肽)、mTP(线粒体靶向肽)和SP(分泌通路信号肽)值分别为0.389、0.050、0.189,而在其他细胞器的预测值高达0.263,表明钙调蛋白主要存在于线粒体以外的其他细胞器中。使用SWISS-MODEL space模拟CML蛋白的三维结构,如图4所示。可以看出,蛋白两端含有多个β折叠,中间以无规卷曲相连接,β角的势能为-3.38,残基包埋值为-0.55,扭转角为-0.06,QMEAN值为-0.96。
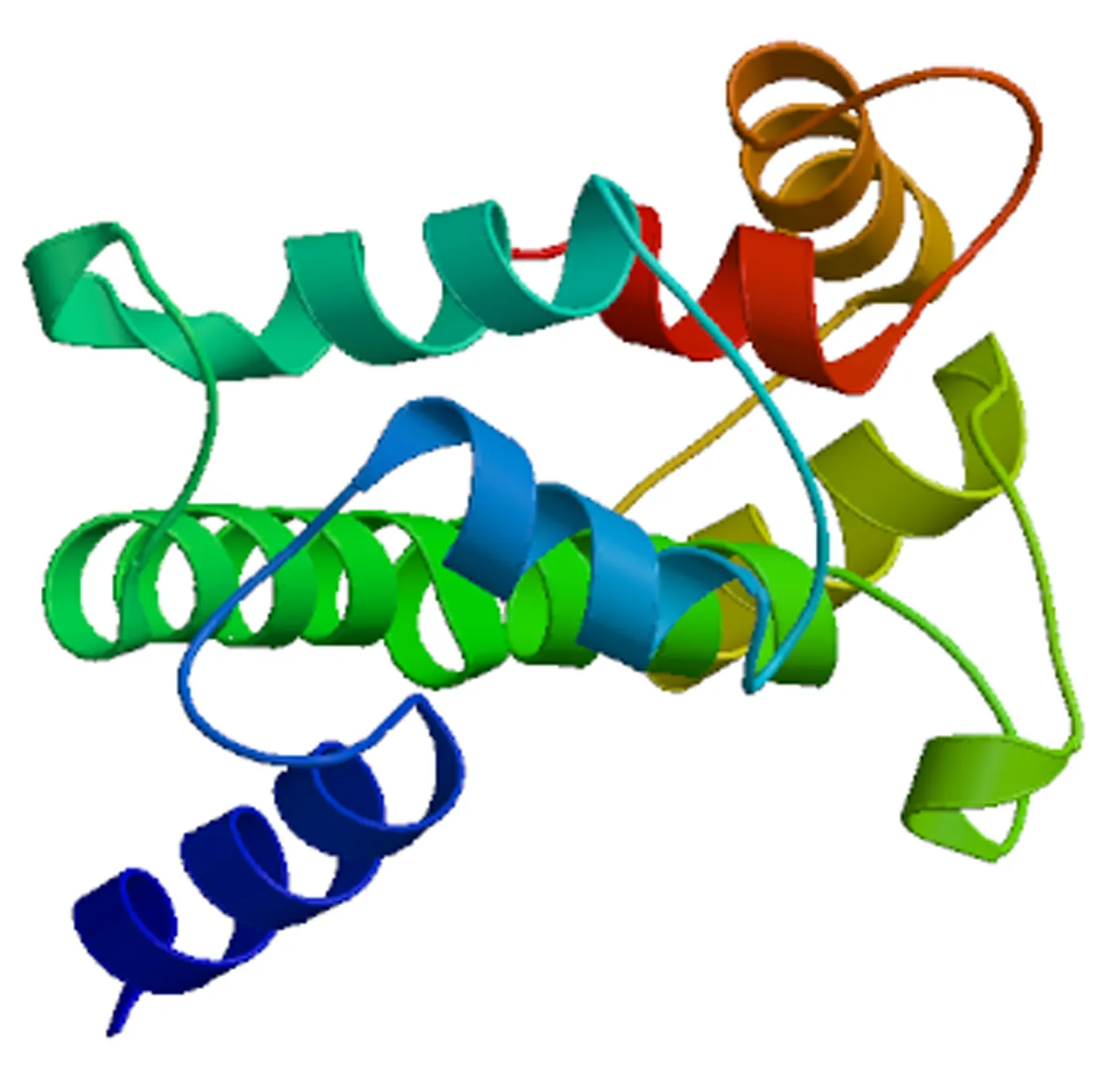
图4 TaCML25/26蛋白三维结构Fig.4 3-D structure of TaCML25/26 protein
2.3 TaCML25/26基因的表达特性
2.3.1叶锈菌诱导TaCML25/26基因的表达模式 为了解TaCML25/26基因在小麦与叶锈菌互作过程中不同时间点的表达特征,设计特异引物进行了荧光定量PCR的检测。结果发现,TaCML25/26基因的转录表达受小麦叶锈菌的诱导(图5),在小麦近等基因系TcLr19中,接种24 h后,TaCML25/26上调表达,为在Mu19中表达量的4倍,之后表达量有所下降。在接种叶锈菌120 h时,该基因在感病突变体Mu19中达到高峰,比在TcLr19的表达高峰晚出现96 h,但此时比在TcLr19中的表达量高7.5倍,之后有所下降,但仍显著高于在TcLr19中的表达量。该基因在Mu19和TcLr19中基因的表达趋势与转录组数据库中的表达一致。
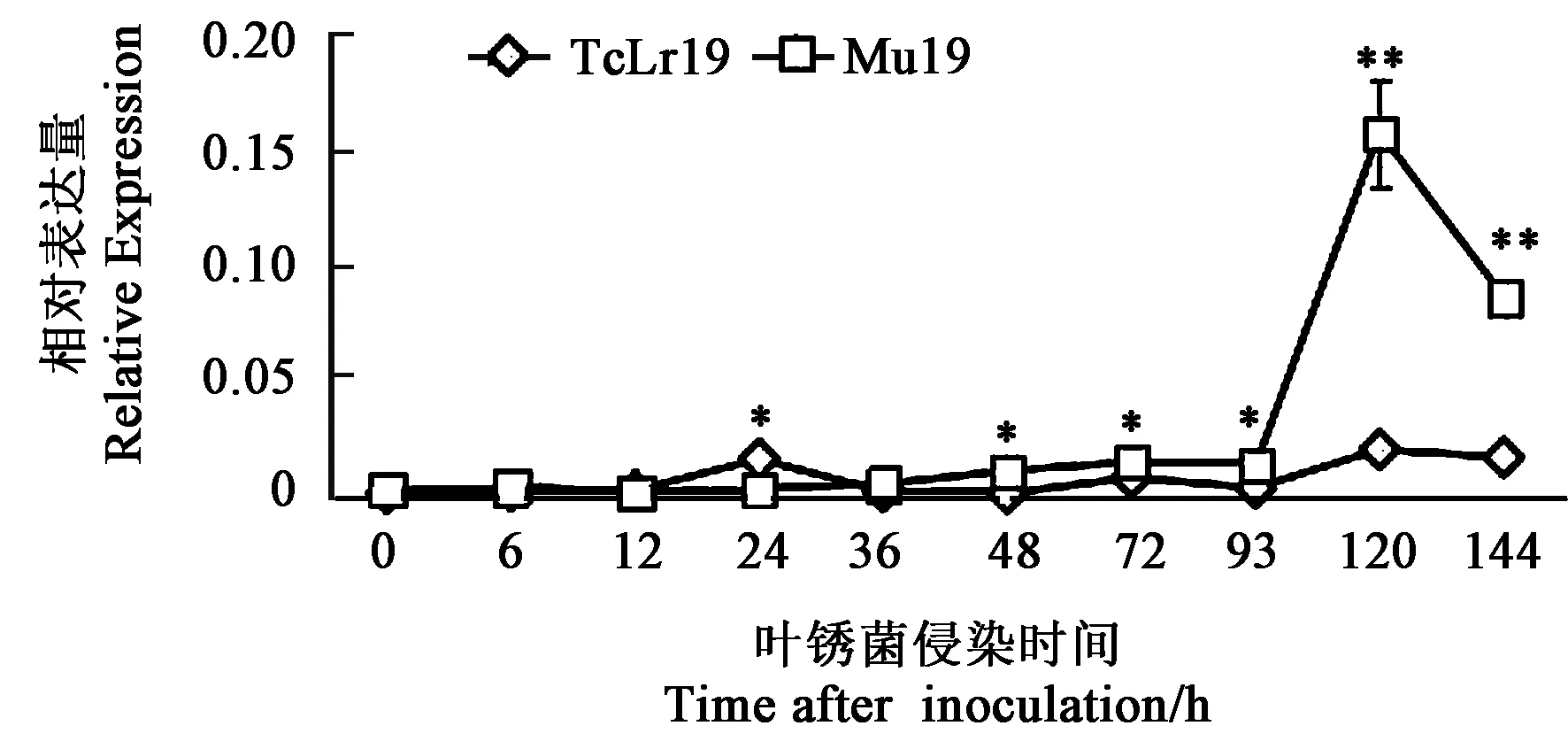
注:*和**表示差异在P<0.05和P<0.01水平具有统计学意义。Note: * and ** indicate significant difference at P<0.05 and P<0.01 levels, respectively.图5 TaCML25/26基因在叶锈菌与TcLr19和Mu19互作过程中表达特征Fig.5 Expression pattern of TaCML25/26 in the interaction between leaf rust and TcLr19 and Mu19
2.3.2SA、ABA诱导下TaCML25/26基因的表达模式 用5 mmol·L-1SA处理TcLr19,TaCaM25/26基因在0~6 h表达量上升,在6 h达到第一个表达高峰,随后下降,12 h再次上升,24 h达到第二个表达高峰,略微下调后再次上调表达,48 h到达到表达量的最大值(第三个高峰)后再次下降,72 h表达量再次上升,于96 h达到表达量的第四个高峰,随后急剧下降(图6)。差异显著性分析结果表明,在6、48 和96 h时,5 mmol·L-1SA处理下TcLr19中TaCaM25/26基因的表达量显著高于清水对照(图6)。
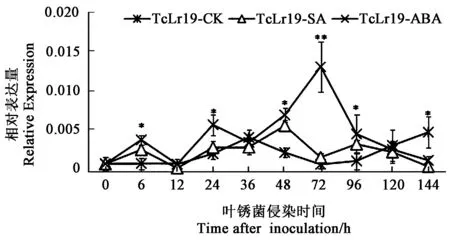
注:*和**表示差异在P<0.05和P<0.01水平具有统计学意义。Note: * and ** indicate significant difference at P<0.05 and P<0.01 levels, respectively.图6 TaCML25/26在不同激素处理下的表达特征Fig.6 Expression pattern of TaCML25/26 under different hormone treatments
用0.01 mmol·L-1ABA处理TcLr19,TaCaM25/26基因在0~6 h表达量上升,在6 h达到表达量的第一个高峰,随后下降,12 h时再次上升,24 h到达到表达量的第二个高峰后再次下降,36 h时表达量再次上升,于72 h达到表达量的第三次高峰,此时表达量最高随后下降,144 h时又有所上升(图6)。差异显著性分析结果表明,在6、24 和72 h时,0.01 mmol·L-1ABA处理下TcLr19中TaCaM25/26基因的表达量显著的高于清水对照(图6)。
2.3.3TaCML25/26基因组织表达特征 定量结果显示,TaCML25/26在根、茎、叶等组织中均表达,表达量在根部最高,茎部次之,叶部最少, 约为根部表达量的 1/8 (图7)。
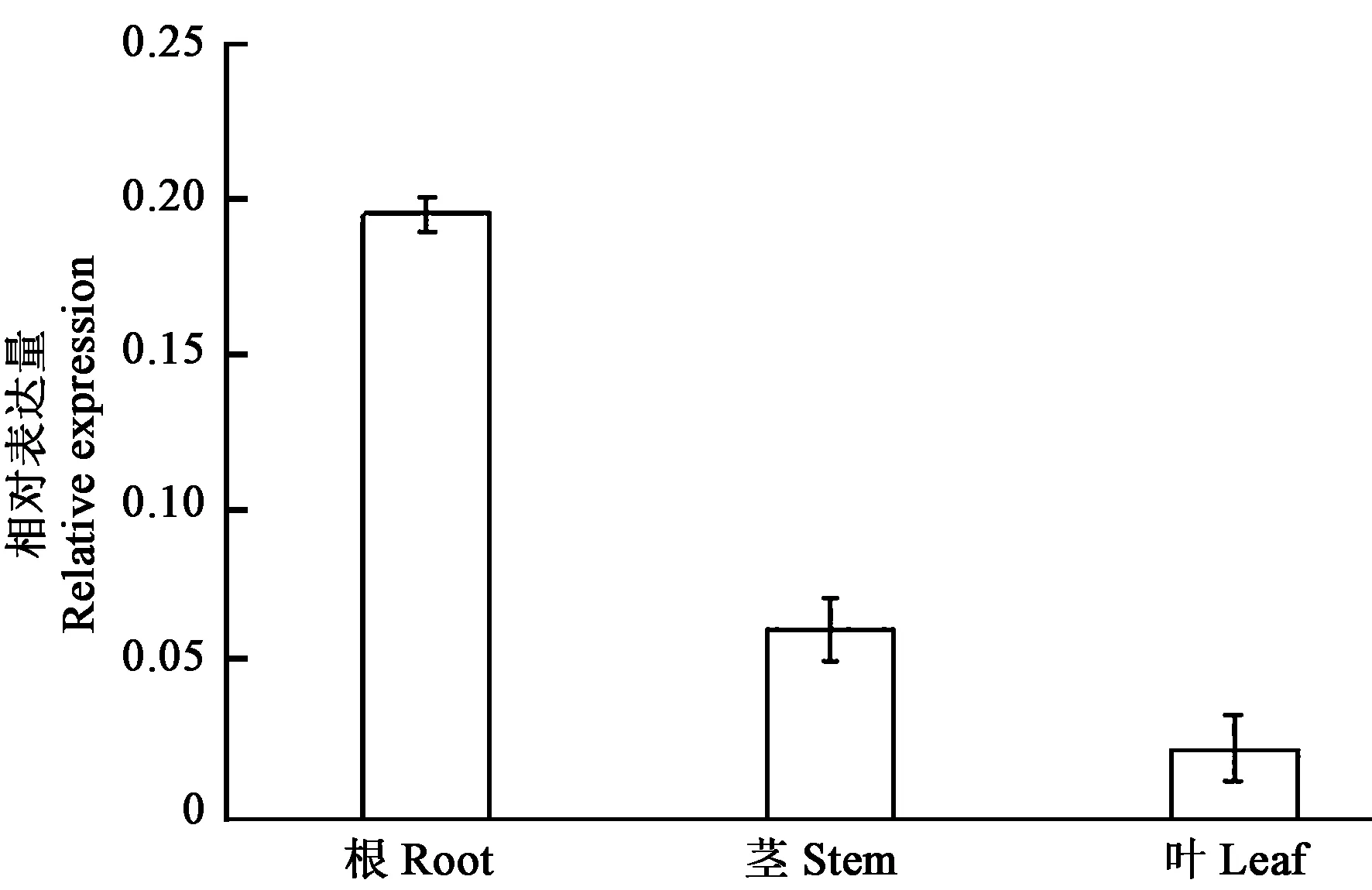
图7 TaCML25/26 在小麦不同组织中的表达量Fig.7 Expression pattern of TaCML25/26 in different wheat organs
3 讨论
钙离子(Ca2+)是植物中的次级信号分子,广泛存在于植物细胞中,主要为胞内信使,与钙调蛋白(CaM)同源的Ca2+结合蛋白的互作进行Ca2+的信号传导,其将来自细胞外的刺激传递至细胞内,调节胞内反应[5]。典型的CaM非常保守,一般由149个氨基酸组成,具有4个EF-hand结构域,CML是与CaM相似性较高的钙离子结合蛋白大家族,蛋白长度一般为83~315个氨基酸不等,具有2~6个EF-hand结构域[9-10]。本研究通过PCR方法克隆得到一个小麦基因TaCML25/26,生物信息学分析显示,TaCML25/26基因ORF序列大小是458 bp,编码147个氨基酸;蛋白序列的同源比对和系统进化树分析显示,TaCML25/26与粗山羊草的CML25/26的亲缘关系最近,并且TaCML25/26具有一个EF-hand_8结构以及多个EFh保守结构域,与小麦钙调素类其他家族存在显著差异,说明该基因为小麦中新发现的CML基因。其是否具有结合Ca2+的特性还需更深入的研究。
植物激素调节是植物中非常重要的抗病机制,其中水杨酸、脱落酸作为重要的信号分子调控植物的抗病反应[19-20]。TaCaM5[3]、TaABCF[36]受植物激素SA和ABA诱导表达。本研究发现,TaCML25/26在SA和ABA处理下,6 h达到第一表达高峰,随后下调表达,在12 h后均开始上调表达,SA处理后,48 h达到表达最大值,ABA处理在72 h达到表达最大值,说明TaCML25/26受水杨酸和脱落酸诱导表达。
小麦[16]、马铃薯[17]、大豆[18]的CaM/CML基因在不同器官中均有不同程度的表达。本研究表明,TaCML25/26在小麦根、茎、叶等组织中均有表达,但在不同器官中表达量存在明显差异,其中表达量在根部最高,茎部次之,叶部最少,约为根部表达量的1/8(图7)。具体其在各器官中的功能有待于进一步研究。
CML基因广泛参与到植物的多种信号通路中,研究证实,Ca2+依赖性CaM/CML信号转导通路在植物防御反应中起重要作用[2-4]。CaCaM1过表达激活辣椒中ROS和NO产生,诱发过敏性坏死反应(hypersensitive response,HR)和防御相关基因表达[23],沉默NtCaM13后发现烟草对病毒、病原细菌和真菌的感病性增加[37],过表达拟南芥中APR134同源基因AtCML43能够增强植株的过敏性坏死反应[38],而拟南芥CML24敲除突变体对Pst无毒株侵染的植株的HR反应明显减弱[21]。小麦中TaCaM5[3]则可能通过茉莉酸和乙烯等信号途径参与小麦对条锈菌的防御反应,钙调蛋白结合转录激活因子TaCAMTA4在小麦抵抗叶锈菌侵染过程前期中起负调控作用[34]。本研究发现小麦叶锈菌侵染小麦叶片后,TaCML25/ 26 在感病的Mu19 中表现出对叶锈菌侵染的敏感,接种后96 h 该基因的表达量迅速上升, 120 h 到达表达高峰,远远高于抗病的TcLr19,说明小麦细胞内钙调素可能作为后期的信号分子参与叶锈侵染过程。从叶锈病的发展过程上看,接种后120 h,叶锈菌在感病的寄主上已经完成侵染,并且在不断扩展,为夏孢子的形成做准备,此时该基因的高表达可能与叶锈菌的扩展和孢子形成有关。在TcLr19 中,接种24 h 时TaCML25/ 26表达量上升且达到高峰,而此时叶锈菌在努力与抗病基因进行互作,抗病基因在积极响应病原物的刺激,叶锈菌与寄主细胞存在大量的信号交换和互作,这个过程中涉及到过敏性的反应的发生,TaCML25/ 26 可能参与了这一过程。TaCML25/ 26 在抗病和感病寄主中扮演的具体角色尚需今后开展深入研究,在后续工作中将通过BSMV-VIGS 等技术研究TaCML25 / 26 基因的功能及其作用的靶标。

