真武汤对肾阳虚水肿大鼠模型的保护作用及对IL-17表达的影响*
崔言坤 高彦宇 高博文 杨楚琪 李 冀
(黑龙江中医药大学,黑龙江 哈尔滨 150000)
肾为水之脏,肾阳虚水无所制,则泛溢而为肿。肾阳虚水肿指先天禀赋不足,后天失养,或年老体衰,或久病失养以致肾阳虚衰,膀胱气化失司,水液停留体内,临床常表现为头面、四肢甚至全身浮肿,小便不利或夜尿频多,腰重足冷[1]。现代医学对于水肿一病,主要依赖于利尿剂、白蛋白等对症处理方案,而中医辨证论治的特色治疗手段,疗效显著。前期通过采用数据挖掘的方法,对临床治疗肾阳虚水肿选方用药经验进行分析,基于聚类分析基础上选取真武汤作为实验药物进一步研究其作用机制。真武汤源自汉·张仲景所著之《伤寒论》,由炮附子、茯苓、白术、白芍、生姜组成,乃是温阳化水之代表方剂,临床应用广泛,不仅用于肾脏疾病的治疗,如肾病综合征、糖尿病肾病、心肾综合征等,还多用于循环系统疾病、呼吸系统疾病等一系列表现为肾阳虚的病证[2]。有研究显示,真武汤药理作用是通过多路径实现的,其作用机制与调整垂体-肾上腺素轴、调节渗透压调定点、调控细胞凋亡等都密切相关[3]。本研究通过病症结合的模式,建立肾阳虚水肿模型,利用现代科学手段深入探讨真武汤“温阳利水”的作用及其机理,为临床合理用药提供依据。
1 材料与方法
1.1 实验动物 实验采用SPF级SD大鼠,4~5周龄,体质量200~230 g,雄性,购自北京维通利华实验动物技术有限公司,许可证编号为:SCXK(京)2019-0001。实验动物均饲养于实验动物中心,室温18~24℃、相对湿度40%~50%,给予自由饮水及标准饲料,实验期间保持昼夜节律正常。本研究获得黑龙江中医药大学实验动物伦理委员会批准,实验均符合中国伦理委员会有关动物研究指导原则,批准号:2019051001。
1.2 试药与仪器 真武汤,组方:炮附子、茯苓、白术、芍药、生姜按3∶3∶2∶3∶3比例称质量(购于黑龙江中医药大学附属医院药局)。各药物先以10倍量蒸馏水浸泡,煎煮3次,每次1 h,减压浓缩成生药量1.9 g/mL的药液,备用。氢化可的松(上海现代哈森药业,国药准字H41021930);注射用盐酸阿霉素(山西普德药业股份有限公司,国药准字H14023143);盐酸贝那普利(北京诺华制药有限公司,国药准字H20030514);大鼠环磷酸腺苷(cAMP)、环磷酸鸟苷(cGMP)、醛固酮(ALD)、白细胞介素-17(IL-17)酶联免疫吸附测定(ELISA)试剂盒(南京建成生物工程研究所,批号20190725)。尿蛋白定量试剂盒(南京建成生物工程研究所,批号20191213);低温高速离心机(湖南湘仪实验室仪器开发有限公司);OLYMPUS BX42电子显微镜(日本奥林巴斯公司);YT-6B组织贴片机(北京凯扬自动化科技有限公司);RM2135石蜡组织切片机(德国LEICA公司);Tecan infinite 200 PRO酶标仪(郑州博赛生物工程有限责任公司)。
1.3 模型制备 大鼠适应性饲养7 d后制备肾阳虚模型。除正常组8只大鼠外,其余大鼠于第1日及第8日早8∶00通过尾静脉注射阿霉素溶液,两次注射剂量分别为3.5、3 mg/kg;同时,每天腹腔注射氢化可的松,注射剂量为3.75 mg/kg,连续14 d。
1.4 分组与给药 将造模成功的大鼠24只随机分为模型组、真武汤组、阳性药组,每组8只。真武汤组每日灌胃1.9 g/mL真武汤药溶液;阳性药组灌胃1.2 mg/mL盐酸贝那普利;其余各组灌胃等体积0.9%氯化钠注射液,连续21 d。
1.5 标本采集与检测 1)实验过程中,记录大鼠行为活动,毛发状态,进食情况,粪便情况,体质量。2)于造模后及末次给药后,将大鼠分别置于代谢笼中,收集24 h尿液,并记录尿量,4℃、3 500 r/min离心15 min,取上清,采用考马斯亮蓝G-250染料结合法(CBB),检测大鼠24 h尿液尿蛋白定量,严格按照试剂盒说明书操作。3)末次给药24 h后腹主动脉采血,4℃、3 500 r/min离心10 min,2次,取上清,采用全自动生化分析仪,测定血清尿素氮(BUN)、血清肌酐(Scr)含量。4)采用酶联免疫吸附法,按照试剂盒说明检测血清中cAMP、cGMP、ALD、IL-17含量。5)免疫组化法检测肾脏组织IL-17表达。取肾脏组织常规脱蜡、封闭,滴加IL-17抗体,4℃孵育12 h,滴加二抗,显微镜下DAB显色,封片,光学显微镜观察。
1.6 统计学处理 应用SPSS21.0统计软件。计量资料以()表示,采用t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠一般状态观察 见表1。正常组大鼠被毛光泽,反应迅速,二便正常;与正常组比较,造模后各组大鼠精神萎靡、毛发枯槁、聚堆、大便稀薄,体质量减轻,差异具有统计学意义(P<0.01),提示造模成功;给药第21日,与正常组比较,模型组大鼠体质量增长缓慢(P<0.01);与模型组比较,真武汤组和阳性药组体质量显著增长(P<0.01)。
表1 各组大鼠体质量比较(g,±s)
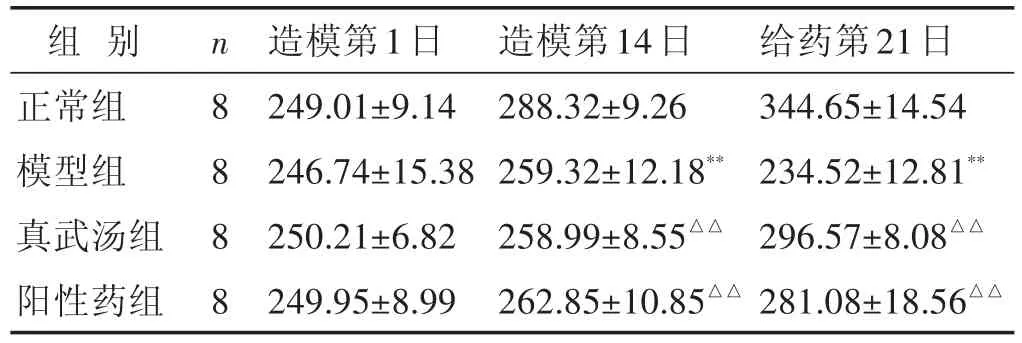
表1 各组大鼠体质量比较(g,±s)
与正常组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01。下同
组别正常组模型组真武汤组阳性药组n 8 8 8 8造模第1日249.01±9.14 246.74±15.38 250.21±6.82 249.95±8.99造模第14日288.32±9.26 259.32±12.18**258.99±8.55△△262.85±10.85△△给药第21日344.65±14.54 234.52±12.81**296.57±8.08△△281.08±18.56△△
2.2 各组大鼠24 h尿量及尿蛋白定量比较 见表2。造模后,与正常组比较,各组大鼠尿蛋白及尿量均显著升高(P<0.01),提示造模成功;给药后,与模型组比较,真武汤组和阳性药组尿蛋白及尿量均显著下降(P<0.01)。
表2 各组大鼠24 h尿量及尿蛋白定量比较(±s)
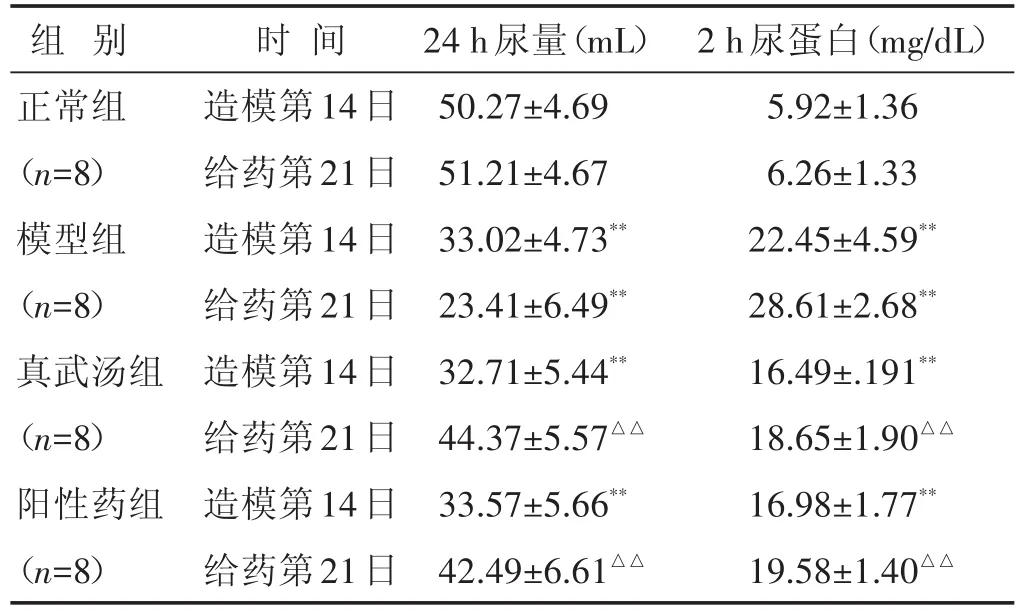
表2 各组大鼠24 h尿量及尿蛋白定量比较(±s)
组别正常组(n=8)模型组(n=8)真武汤组(n=8)阳性药组(n=8)时间造模第14日给药第21日造模第14日给药第21日造模第14日给药第21日造模第14日给药第21日24 h尿量(mL)50.27±4.69 51.21±4.67 33.02±4.73**23.41±6.49**32.71±5.44**44.37±5.57△△33.57±5.66**42.49±6.61△△2 h尿蛋白(mg/dL)5.92±1.36 6.26±1.33 22.45±4.59**28.61±2.68**16.49±.191**18.65±1.90△△16.98±1.77**19.58±1.40△△
2.3 各组大鼠血清cAMP、cGMP及cAMP/cGMP水平比较 见表3。与正常组比较,模型组大鼠cAMP、cAMP/cGMP水平降低,cGMP水平升高(P<0.05或P<0.01);与模型组比较,真武汤组cAMP、cAMP/cGMP水平升高,cGMP水平降低(P<0.05或P<0.01)。
表3 各组大鼠血清cAMP、cGMP及cAMP/cGMP水平比较(±s)
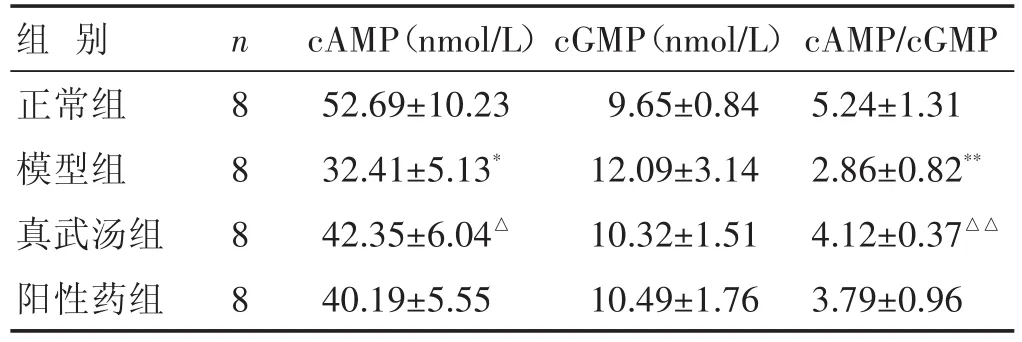
表3 各组大鼠血清cAMP、cGMP及cAMP/cGMP水平比较(±s)
组别正常组模型组真武汤组阳性药组n 8 8 8 8 cAMP(nmol/L)52.69±10.23 32.41±5.13*42.35±6.04△40.19±5.55 cGMP(nmol/L)9.65±0.84 12.09±3.14 10.32±1.51 10.49±1.76 cAMP/cGMP 5.24±1.31 2.86±0.82**4.12±0.37△△3.79±0.96
2.4 各组大鼠血清Scr、BUN含量比较 见表4。与正常组比较,模型组大鼠Scr、BUN含量均显著升高(P<0.05或P<0.01);与模型组比较,真武汤组和阳性药组Scr、BUN含量均显著下降(P<0.05)。
表4 各组大鼠血清Scr、BUN含量比较(mmol/L,±s)
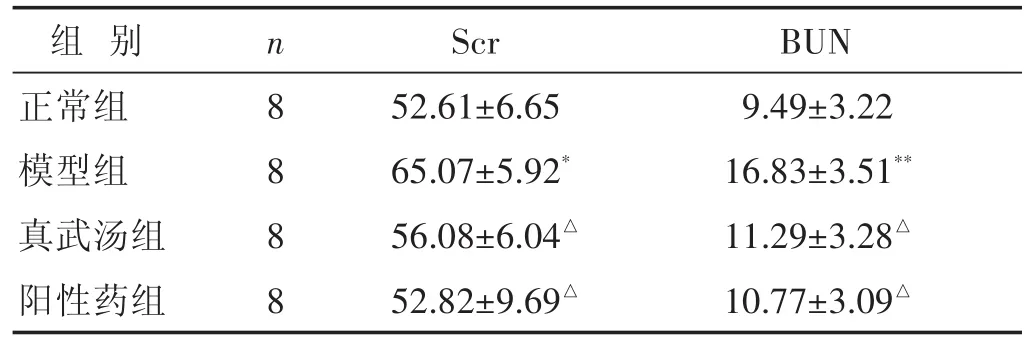
表4 各组大鼠血清Scr、BUN含量比较(mmol/L,±s)
组别正常组模型组真武汤组阳性药组n 8 8 8 8 Scr 52.61±6.65 65.07±5.92*56.08±6.04△52.82±9.69△BUN 9.49±3.22 16.83±3.51**11.29±3.28△10.77±3.09△
2.5 各组大鼠血清ALD、IL-17含量比较 见表5。与正常组比较,模型组大鼠ALD、IL-17含量均显著升高(P<0.01);与模型组比较,真武汤组和阳性药组ALD、IL-17含量均显著下降(P<0.05或P<0.01)。
表5 各组大鼠血清ALD、IL-17含量比较(±s)

表5 各组大鼠血清ALD、IL-17含量比较(±s)
组 别n ALD(mL/kg)IL-17(ng/L)正常组模型组真武汤组阳性药组8 8 8 8 234.52±62.56 446.14±80.51**303.72±65.76△274.16±60.61△△14.34±2.66 30.67±5.86**16.26±3.67△△17.26±4.41△△
2.6 各组大鼠肾脏IL-17表达比较 见图1。结果显示,正常组肾脏组织中有少量IL-17表达,多集中在肾小管;与正常组比较,模型组IL-17在肾小管上表达显著,肾小球有少量表达,呈深棕色;与模型组比较,真武汤组和阳性药组IL-17表达明显降低,弱阳性表达,呈浅棕色。
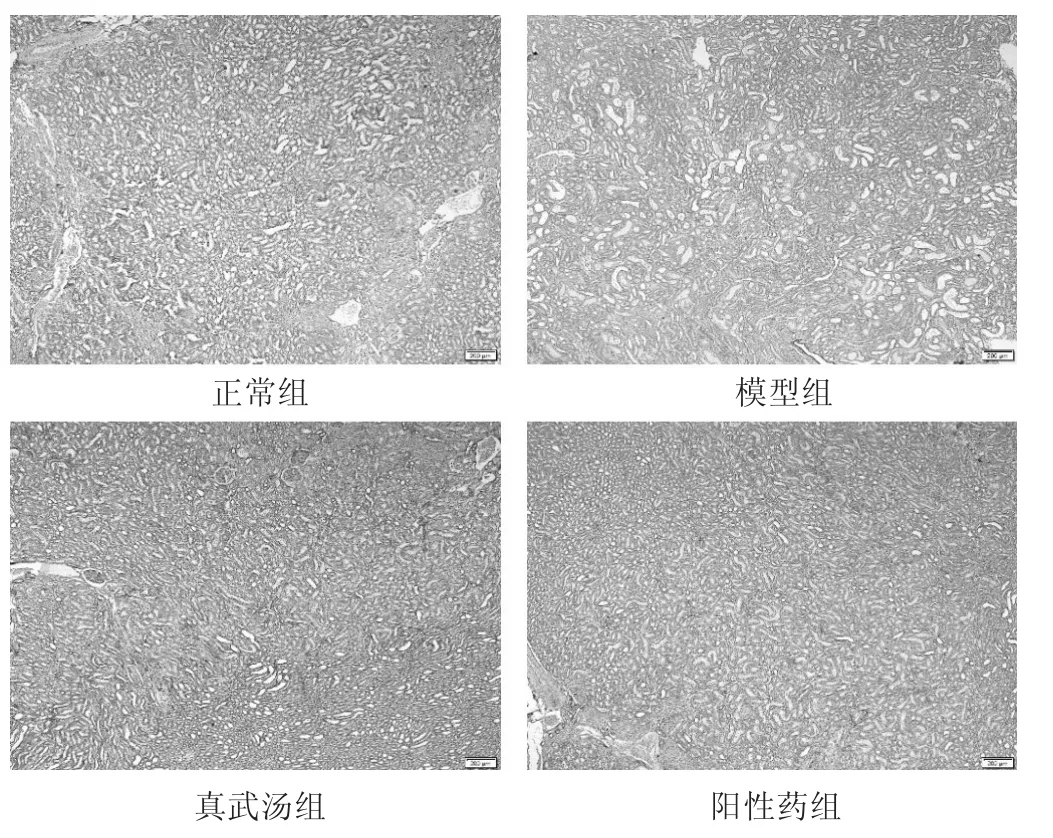
图1 各组大鼠肾脏IL-17表达(DAB染色,400倍)
3 讨 论
近年来,随着中医药在许多疾病的治疗上显示出其独特的优势,利用现代药理学手段建立中医病症结合模型,已经成为科研的必要方式。本实验选取氢化可的松联合阿霉素方式,通过腹腔注射氢化可的松干预下丘脑-垂体-靶腺轴模拟传统中医病因学复制大鼠肾阳虚模型[4],同时尾静脉注射阿霉素诱导肾源性水肿,从而建立大鼠肾阳虚水肿模型[5]。阿霉素及其代谢产物可直接损伤足细胞,导致滤过膜的分子屏障受损而引发蛋白尿,其具有的肾毒性会进一步促使炎性细胞分泌,破坏肾小管上皮细胞,从而引起水肿病症[6]。氢化可的松可抑制促肾上腺皮质激素分泌,使下丘脑-垂体-肾上腺轴(HPA)反馈受到抑制,当外来皮质激素突然撤退,则暴露出HPA轴的抑制状态,继而表现出一系列阳虚症状,且其所具有的肾毒性,会进一步加重肾脏水肿[7]。
肾阳虚则机体失于温煦,阴寒内生,气化功能失调,表现出一系列症状,如神疲乏力,四肢不温,大便稀溏等构建肾阳虚模型需要确保其符合临床实际[8]。本实验结果表明,造模后各组大鼠均表现出一定程度的倦怠少动,不欲饮食,体质量下降,被毛枯槁,便溏,符合肾阳虚证。cAMP与cGMP是一对相互拮抗又制约的物质,共同参与细胞的调控,这与中医学“阴阳学说”相对应[9]。研究报道,阳虚时表现为cAMP含量降低,cGMP含量升高,cAMP/cGMP降低,因此通常将cAMP、cGMP含量作为肾阳虚模型的考察指标之一[9]。
肾素-血管紧张素-醛固酮系统广泛存在于人体组织中,在体液调节中起到关键作用,ALD是其重要的活性因子之一[10]。ALD是人类主要的盐皮质激素之一,在肾脏疾病中可作为独立危险因素,是调节机体水盐代谢的基础,作用于远端小管,具有排钠保钾作用,同时在受体活化介导下具有促纤维化和促炎的作用[11];有研究报道,ALD水平与水肿呈正相关,可能与其通过激活盐皮质激素受体,损伤大鼠足细胞和肾小管上皮细胞发生自噬相关[12]。蛋白尿是水肿的重要指标,肾功能也与其紧密相关,Scr和BUN是常用的肾功能检测指标,二者血清水平变化反映了肾小球滤过率的改变。IL-17是TH17细胞重要效应分子之一,由多种免疫细胞分泌,可诱导促炎因子的表达而加重炎症反应,损伤靶器官,研究证实,IL-17与肾脏疾病的发生发展关系密切,可直接诱导肾脏足细胞的凋亡,且与蛋白尿水平呈正相关[13]。
真武汤是温阳利水之代表方剂,《古今名医方论》谓真武汤“真武一方,为北方行水而设”[14]。方中附子为君,走肾温经,峻补元阳;茯苓甘淡渗湿,益脾助阳,白术甘苦而温,燥湿实脾,二者共为臣药;生姜辛温,既助附子化气,又可助苓、术温中健脾;芍药酸敛,既防附子伤阴,又缓急止痛,并取其利小便行水之功,全方诸药相配,共奏温阳利水之功。本实验结果显示,与模型组比较,真武汤组大鼠一般情况得到改善,体质量显著增长,cAMP、cAMP/cGMP水平显著升高,cGMP水平显著降低,说明真武汤显著改善了阳虚症状;尿蛋白、BUN、Scr显著降低,尿量显著升高,提示真武汤能有效改善肾功能;同时,血清ALD、IL-17显著升高,肾脏组织IL-17表达增强。
综上,真武汤对肾阳虚水肿有治疗作用,通过改善肾脏功能,调剂HPG轴达到利尿消肿的功效,其机制可能与抑制IL-17介导的足细胞凋亡有关。本研究为进一步拆分真武汤有效组分配伍奠定了基础。

