不同条件下CIM试验检测耐碳青霉烯类肠杆菌科细菌的评价
李小月,曹 蕾,罗庆礼
1.安徽省安庆市第一人民医院检验科,安徽安庆 246003;2.安徽医科大学病原生物学教研室,安徽合肥 230000
20世纪80年代,非典型β-内酰胺类抗菌药物——碳青霉烯类抗菌药物成为对抗革兰阴性菌严重感染的最后防线[1]。近年来,随着抗菌药物的广泛使用,耐碳青霉烯类肠杆菌科细菌(CRE)日益增多并广泛流行,已逐渐成为全球的焦点[2-3]。研究发现,50% CRE耐药是产酶基因介导的,因此,提高碳青霉烯酶携带菌株的检测能力,对早期阻断其播散具有重要意义[4]。VAN等[5]在2015年提出碳青霉烯类抑制法(CIM),该方法选用美罗培南作为指示底物,来判断试验效果。目前,国内上市的碳青霉烯类抗菌药物有亚胺培南、美罗培南、帕尼培南、厄他培南、比阿培南和多尼培南。本研究结合安庆市第一人民医院(以下简称“本院”)肠杆菌科细菌耐药情况,采用亚胺培南、美罗培南和厄他培南3种底物来评价CIM试验效果。再以美罗培南作为底物,分别在孵育0.5、1、2、4 h条件下进行试验,寻找最佳孵育时间。
1 材料与方法
1.1菌株来源 收集本院2012年1月至2017年12月临床分离的对碳青霉烯类抗菌药物耐药[即亚胺培南的最低抑菌浓度(MIC)≥4]的肠杆菌科细菌120株。其中肺炎克雷伯菌73株,大肠埃希菌24株,阴沟肠杆菌9株,产气肠杆菌5株,弗氏枸橼酸杆菌5株,粘质沙雷菌4株。大肠埃希菌ATCC 25922、肺炎克雷伯菌ATCC BAA-1705、肺炎克雷伯菌ATCC BAA-1706标准菌株均来自原卫生部临床检验中心。
1.2仪器与试剂 VITEK 2 Compact全自动微生物分析系统及配套板卡,哥伦比亚血琼脂、M-H琼脂平板购自法国生物梅里埃公司;药敏纸片购自英国Oxoid公司;PCR扩增仪、凝胶成像仪和电泳仪购自美国BIO-RAD公司;2×Es Taq Master Mix、50×TAE购自北京天恩泽公司;琼脂糖购自法国BLOWEST;引物由大连宝生物公司合成。
1.3方法
1.3.1细菌鉴定及药敏试验 120株菌株复苏后均采用VITEK 2 Compact全自动微生物分析仪进行鉴定和药敏试验,经验证亚胺培南对所有菌株的MIC≥4。
1.3.2不同底物的CIM试验 取规格为1.5 mL的Eppendorf管3支,每支加入400 μL无菌水,分别用10 μL接种环刮取1环血琼脂平板上过夜培养的细菌,加入后振荡混匀。将亚胺培南、美罗培南、厄他培南(10 μg)药敏纸片分别作为底物浸入菌悬液中,35 ℃孵育2 h。用无菌棉签蘸取0.5麦氏浊度的大肠埃希菌ATCC 25922菌悬液沿3个方向在M-H琼脂平板上密集均匀涂布。用接种环将孵育后的3种药敏纸片从菌悬液中取出,挤干,贴在已接种指示菌ATCC 25922的M-H琼脂平板上,于35 ℃孵育过夜后读取结果。结果判读:如果细菌产碳青霉烯酶,则会水解纸片上的药物,指示菌ATCC 25922的生长不受限制,不出现抑菌圈,将抑菌纸片直径记录为6 mm,结果判断为阳性;若细菌不产碳青霉烯酶,则不能水解纸片上的药物,指示菌ATCC 25922的生长受限制,出现抑菌圈,且抑菌圈直径≥6 mm,结果判读为阴性。以肺炎克雷伯菌ATCC BAA-1705、肺炎克雷伯菌ATCC BAA-1706分别作阳性和阴性对照,以无菌水浸泡的药敏纸片作为空白对照。
1.3.3不同孵育时间的CIM试验 取规格为1.5 mL的Eppendorf管3支,每支加入400 μL无菌水,分别用10 μL接种环刮取1环血琼脂平板上过夜培养的细菌,加入后振荡混匀。将美罗培南(10 μg)药敏纸片分别作为底物浸入菌悬液中,35 ℃分别孵育0.5、1、2、4 h。后续的接种及结果判读相关操作同1.3.2。
1.3.4碳青霉烯酶基因检测 采用加热煮沸法提取菌株DNA作为PCR模板。参照文献[6]合成碳青霉烯酶基因blaKPC、blaNDM、blaVIM、blaIMP、blaOXA-48、blaOXA-23和blaGES引物。PCR扩增体系共20 μL:上、下游引物(10 μmol/L)各 1 μL,2×Taq Master Mix 10 μL,双蒸水(ddH2O) 7 μL,模板 1 μL。PCR 扩增参数:预变性95 ℃ 5 min;变性95 ℃ 30 s,退火56 ℃ 30 s,延伸72 ℃ 1 min,共30个循环;总延伸72 ℃ 7 min。扩增产物经12 g/L 琼脂糖凝胶电泳观察结果。PCR扩增阳性产物由大连宝生物公司进行双向测序,测序结果经BLAST比对分析以确定基因型。
1.4统计学处理 采用SPSS22.0软件对数据进行统计处理及分析,计数资料以例数或百分率表示,组间比较采用χ2检验。同时计算3种底物CIM试验和PCR结果的一致率(一致性比例即总体的分类精度)和Kappa值。Kappa值为0.41~0.60,表示一致性强度中等,Kappa值为>0.60~0.80,说明一致性强度为较好;Kappa值为>0.80~1.00,说明一致性强度为极好。以P<0.05为差异有统计学意义。
2 结 果
2.1基因检测结果 PCR检测碳青霉烯酶耐药基因结果显示,120株对碳青霉烯类抗菌药物耐药的肠杆菌细菌中,93株菌携带1种或多种耐药基因,其中仅携带1种基因的菌株为60株,携带多种基因的菌株为33株,但均未检测到blaGES基因,其余27株均未检出耐药基因。
2.2不同底物CIM试验的结果 分别用亚胺培南、美罗培南、厄他培南作为指示底物进行CIM试验,PCR检测碳青霉烯酶耐药基因,120株CRE中阳性93株,阴性27株。3种底物的CIM试验结果与PCR结果相比,三者的灵敏度分别是98.9%、90.3%、69.9%,差异有统计学意义(χ2=18.43,P<0.01),三者的特异度均为88.9%。与PCR结果相比,3种底物的一致率分别为96.7%、90.0%、74.2%,Kappa值分别是0.90、0.73、0.44。指示底物为亚胺培南时,其灵敏度、一致率和Kappa值都高于其他两种。有3株细菌在3种底物下的CIM试验结果为阳性,但均未检测到基因型;1株携带blaKPC/NDM的产气肠杆菌,3种底物均为指示阴性。见表1、2。
2.3不同孵育时间CIM试验的结果 120株CRE中24株在4种孵育条件下均显示阴性。孵育0.5、1、2和4 h后,灵敏度分别为46.2%(43/93)、58.1%(54/93)、90.3%(84/93)和90.3%(84/93)。2 h和0.5、1 h相比,差异有统计学意义(χ2=27.31,P<0.05),而孵育2 h和4 h,结果间差异无统计学意义(P>0.05)。见表3。
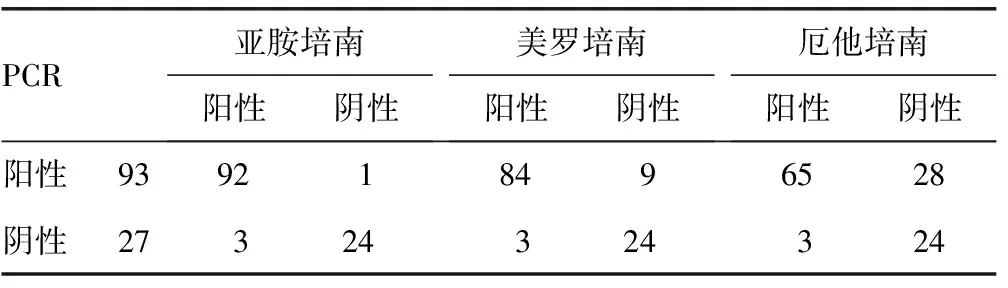
表1 不同底物CIM试验和PCR检测结果(n)
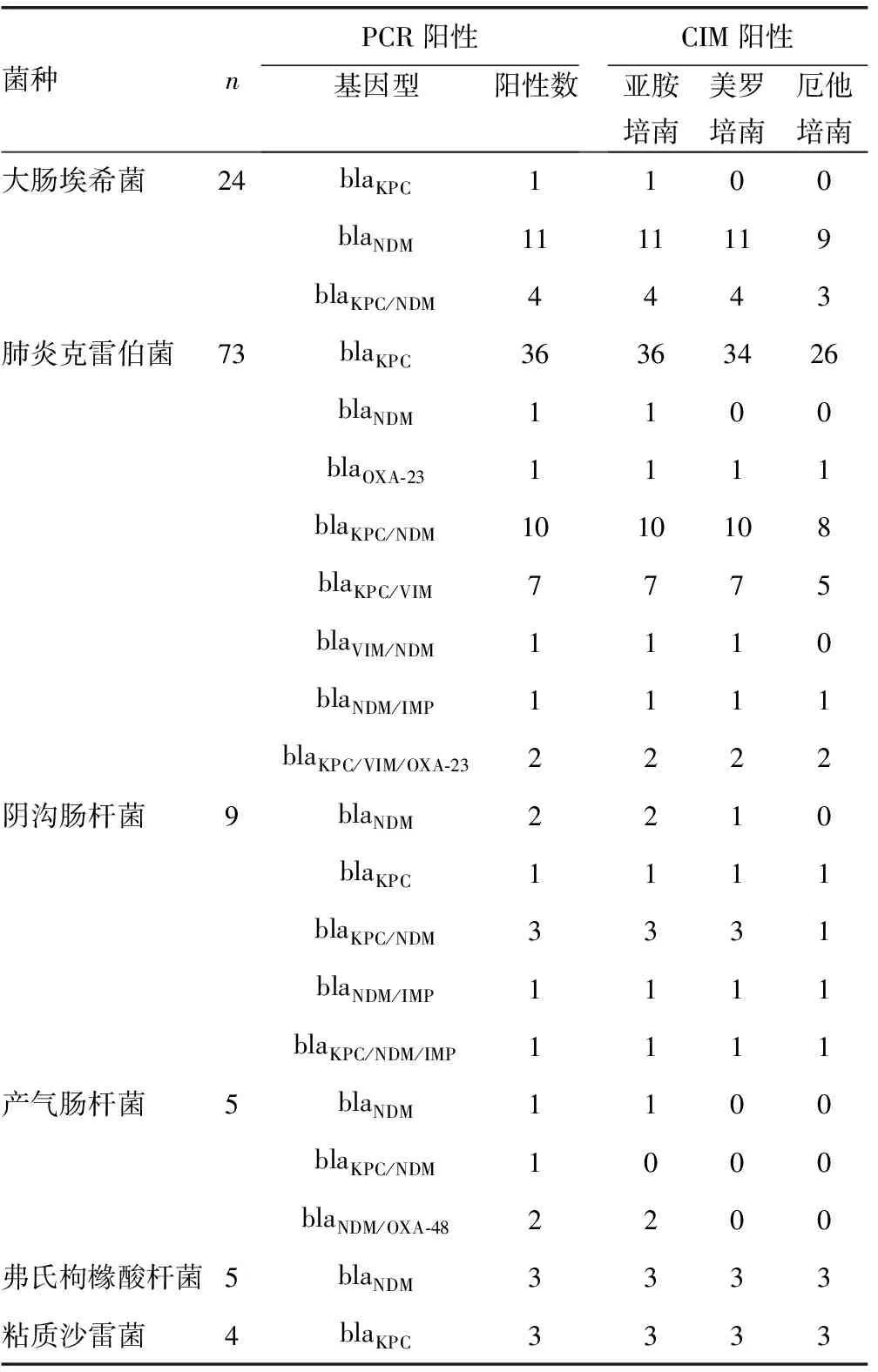
表2 不同基因型不同底物CIM试验阳性结果(n)
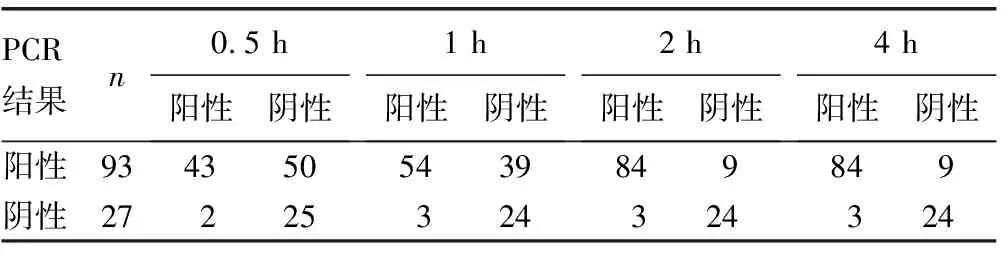
表3 不同孵育时间CIM试验结果和PCR结果比较(n)
3 讨 论
CRE耐药的机制主要有产碳青霉烯酶,青霉素结合蛋白的改变,药物主动外排泵过度表达,细菌生物膜系统的改变,产β-内酰胺酶,如ESBLs酶或AmpC酶联合外膜孔蛋白缺失或减少。菌株产生碳青霉烯酶是介导细菌耐药的主要机制之一[7-8]。碳青霉烯酶表型的筛选试验有多种方法,目前检测碳青霉烯酶的表型确证试验包括CIM、基质辅助激光解析电离飞行时间质谱技术(MALDI-TOF MS)、碳青霉烯水解试验、Carba NP试验和电化学测定(BYG试验)。这些方法能够检测到碳青霉烯酶的活性,还能区分碳青霉烯酶的种类。各种试验指示底物均不相同,CIM试验推荐使用的底物是美罗培南,而对于其他底物的效果,仍需更多试验确证。
GAUTHIER等[9]用3种底物进行CIM试验,结果显示亚胺培南的灵敏度达到100%,与本试验结果基本一致。亚胺培南是应用于临床的第一代碳青霉烯类抗菌药物,临床使用率高,作为指示底物进行CIM试验,其灵敏度、一致性和Kappa值均高于其他两种底物。美罗培南是第一种被单独使用的碳青霉烯类抗菌药物,是第二代碳青酶烯类抗菌药物的代表,安全性高,但是它是一种时间依赖性抗菌药物,其发挥抗菌活性需维持一定的药物浓度和作用时间[10]。作为CIM试验推荐使用的底物,本研究发现,其检出率、一致性和Kappa值均低于亚胺培南,也低于相关报道[11-13]。厄他培南是由Astra Zeneca公司研发的注射用广谱长效碳青霉烯类抗菌药物。但是其作为CIM试验指示底物,灵敏度较差,与其他两种药物相比,存在较大差异;与PCR结果相比,一致性不高。有3株细菌在3种底物下的CIM试验均为阳性,但未检测到基因型,其原因可能与本研究中检测的基因型不够全面有关。1株携带blaKPC/NDM的产气肠杆菌,3种底物CIM试验均显示阴性;有8株携带耐药基因的菌株,仅亚胺培南显示阳性,其余两种底物均显示阴性。有研究显示,当菌株携带的酶含量较低时,以美罗培南作为指示底物进行CIM试验可能出现假阴性结果[9]。另外,余佳佳等[14]也发现,在试验中用接种环挑取待测菌时,要保证一满环的菌量,若挑取的菌量太少,菌悬液浓度低,则纸片水解不完全,亦会导致假阴性结果。
CRE治疗中,早期发现、早期治疗对细菌的传播进行阻断是非常重要的[15]。CIM试验主要缺点为需要两次孵育,时间长,不能在1 d内得出结果[9]。细菌和药敏纸片共孵育是CIM试验中的关键环节,细菌水解抗菌药物受菌量、孵育时间、温度等各方面的影响。本研究发现,从0.5 h延长到2 h,药物水解得更充分,灵敏度增加,但是2 h和4 h之间,差异无统计学意义(P>0.05),说明孵育2 h即可充分水解药敏纸片,实际工作中可大大节约试验时间。
碳青霉烯酶表型的筛选试验中,CIM试验成本较低,无需特殊试剂和设备,人员要求不高,适合临床微生物实验室和基层实验室,亚胺培南和美罗培南均具有较好的检出率、一致性和Kappa值,与PCR试验结果高度一致,均可作为合适的底物。在孵育时间上,2 h是最佳的孵育时间。

