脂肪血浆去除乳糜微粒前后的对比分析
易中梅,罗 岚,廖元梦,张 红,阮潜瑛
陆军军医大学第一附属医院输血科/中国人民解放军重庆血站,重庆 400038
世界卫生组织(WHO)提出,当一个国家献血率为10‰~30‰时,可基本满足本国临床用血需求。经过多年不懈努力,在2018年的政府工作报告中,国家卫生和健康委员会报告我国2017年的献血率约为11‰,达到WHO倡导的下限水平[1]。随着社会老龄化的加剧,适龄献血人群逐步退出,新的献血人群补给不足,血液供应紧张的局面依然存在[2]。要缓解血液供应的缺口,一方面应加强招募宣传,正确引导献血;另一方面应从技术上进行创新,减少非传染性检测指标导致的血液制品报废。在非传染性检测指标报废原因中,脂肪血浆报废占比最高,这在各类型血站的学术报告中均有报道[3-6]。脂肪血浆报废的主要原因是乳糜微粒(CM)水平过高,导致血浆外观清晰度不合格。本方法通过改进制备耗材、制备流程及制备参数对脂肪血浆进行CM去除,对血浆外观、FⅧ因子、FV 因子、纤维蛋白原(Fib)及血浆总蛋白(TP)水平等指标进行比较,分析去除CM后血浆的质量是否符合国家质量标准;并同步进行输血相关传染病标志物检测,验证其是否具备输注的安全性,最终达到减少脂肪血浆报废的目的,现报道如下。
1 材料与方法
1.1标本来源 选取本血站2018年3-9月,输血相关传染病标志物检测(依照《血站技术操作规程》)结果均为合格,仅因CM水平过高导致外观不符合质量要求而被确定为脂肪血浆的30袋普通血浆作为研究对象。
1.2仪器与试剂 转移袋(四川南格尔,批号:180411),大容量低温离心机(型号:6000i,美国Thermo),全自动生化分析仪(型号:AU5400,美国贝克曼;原装试剂,批号:AUZ6508),CA-1500 型全自动血凝分析仪(Dade Behring Marburg,德国),纤维蛋白原测定试剂盒( 批号:547544,德国),凝血因子 FⅧ、FV测定试剂盒( 批号:500759AA,504966,德国),酶标分析仪(MK3,德国Thermo),酶联免疫吸附试验试剂盒。
1.3CM去除方法 每袋脂肪血浆无菌接驳分装入CM分离袋(图1)中,容量均为(100±2)mL,放入-50 ℃冰箱速冻成块备用。集中将30袋冰冻的脂肪血浆置于(3±2)℃冰箱中过夜(14 h)缓慢融化,次日以5 000 g、(2±2)℃、离心12 min,分离出下层血浆,混匀后即得到去除CM后的血浆,上层CM留于原血浆袋中,后按照《医疗废物处置办法》处理。

图1 改装的脂肪血浆CM分离袋示意图
1.4标本留取 每袋脂肪血浆-50 ℃冰冻前留取6 mL标本冰冻保存,在脂肪血浆去除CM的过程中取出放入4 ℃冰箱;将去除CM后的血浆标本也留取6 mL,两组标本置于37 ℃水浴箱中复温并混匀,同时送检。
1.5质量分析
1.5.1外观观察 观察血浆外观,乳糜程度是否有所改善,参考《全血成分血质量检测指南(WS/T 550-2017)》[7],用正常血浆作为标准品进行对比确定乳糜程度改善效果,并以酶联免疫吸附试验检测酶标板版图(字体为宋体5号和7号)为背景进行清晰度及能见度比较。
1.5.2细菌培养 从去除CM的30份血浆标本中每份取出3 mL,在百级净化超净工作台上放入巯基乙酸脂培养基中,置于37 ℃培养箱中培养7 d,观察结果。
1.5.3化学指标测定 检测血浆中FⅧ因子、FV因子、Fib、TP、三酰甘油(TG)、总胆固醇(Tch)等水平及进行输血相关传染病标志物检测,对比分析血浆质量的变化及确认输注的安全性。

2 结 果
2.1血浆外观观察 脂肪血浆去除CM后与去除前相比,乳糜程度改善良好。去除前对背景字体完全不可见(图2A),去除后血浆清晰度和能见度均明显改善(图2B)与正常血浆相当(图2C),外观合格。
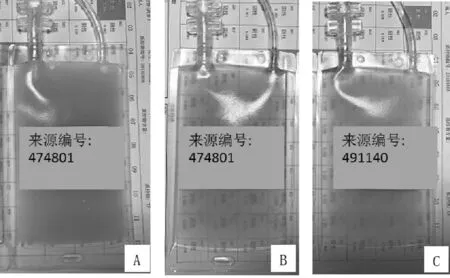
注:A为脂肪血浆;B为A去除CM后的血浆;C为正常血浆。
图2脂肪血浆去除CM前后的外观变化及与正常血浆外观比较
2.2去除CM后的血浆标本细菌培养均为无菌生长,符合国家标准(中华人民共和国国家标准)[8]质量要求。
2.3脂肪血浆去除CM前后血浆中部分凝血因子水平比较 FⅧ因子(t=1.359,P=0.606)、FⅤ因子(t=6.179,P=0.908)及Fib(t=0.045,P=0.538)水平差异均无统计学意义(P>0.05),凝血因子水平未受影响。见表1。

表1 去除CM前后部分凝血因子检测结果比较
注:a凝血因子以100%百分比活性=0.74 IU进行换算。
2.4脂肪血浆去除CM前后血浆中TG、Tch及TP水平比较 去除CM后血浆中TG水平明显降低(P<0.01),Tch水平降低(P<0.05),CM去除效果较好; TP水平差异无统计学意义(P>0.05),TP水平无降低,说明TP水平未受影响。见表2。
2.5脂肪血浆去除CM前后输血相关传染病标志物检测对照 人类免疫缺陷病毒(HIV)感染标志物(抗HIV-1、HIV RNA)、梅毒螺旋体特异性抗体(抗TP)、丙型肝炎病毒(HCV)感染标志物(抗HCV、HCV RNA)、乙型肝炎病毒(HBV)感染标志物(HBsAg、HBV DNA)及丙氨酸氨基转移酶(ALT)均合格。见表3。

表2 去除CM前后TG、Tch 及TP水平比较
注:与去除CM前相比,aP<0.01;bP<0.05。

表3 去除CM前后相关传染病标志物检测结果比较
3 讨 论
CM及极低密度脂蛋白(VLDL)水平过高均会引起血浆浊度加重,VLDL引起的血浆浑浊一般较轻,导致的血液报废较少,CM水平高引起的混浊度较重,极易造成血浆外观不合格最终以“脂肪血”报废。文中去除CM的步骤为“冰冻-复融-离心”,已达到去除的目的,与其他文献去除CM的方法比较有一定改良[9-10]:在制备材料上改进了CM分离袋,将分离管开口在袋底,管路接驳了滤膜壶,内含的滤膜材料为普通采血袋滤盘材质的无纺布,目的是避免在去除CM的同时,离心后聚集的脂肪微粒混入转移袋中,因此滤膜不会造成血浆TP、Fib水平的丢失(表1);在制备环节上,增加了冰冻环节,在不冰冻的条件下,脂肪血浆需要放置较长时间才可让CM分层,国家标准规定血浆在复融后,应于24 h内输注完毕;若将脂肪血浆长时间(>24 h)静置[11],即便CM上浮被分离去除,浑浊度改善,血浆外观合格,也需要证明血浆中的凝血因子成分水平未减少才算真正达到要求。基于此,作者对照了本方法去除CM前后血浆中FⅧ因子及FⅤ因子水平,均无明显降低。分析其原因,是因为经过冰冻环节,CM固化,后在低温中解冻,上浮时间缩短,再次离心后,分离保留下层血浆,与冷沉淀、凝血因子的制备技术原理相同,留下的是底部沉淀物(含凝血因子及纤维蛋白原等)和中层血浆,弃去的是残留在血浆袋中的离心后上浮的CM,制备程序符合《血站技术操作规程(2019版)》要求,可最大限度地保障血浆中FⅧ因子等凝血因子水平不受影响[9]。普通血浆对FⅧ因子未做要求,本研究中的脂肪血浆是普通血浆,无论是CM去除前或者去除后,血浆中所含凝血因子FⅧ因子均>40 IU,符合新鲜血浆的标准。分析原因,主要因本血站配备了定期转运外采全血的运血车,即使采血任务并未结束,运血车也能保证在全血采集后的5~6 h内将全血送回血站进行制备处理,减少血浆中凝血因子的损失,保障了血浆中的重要成分水平处于高质量水平。
有文献报道,在不同的检测方法下,CM水平对ALT测定结果的影响不同[12-13]。《血站技术操作规程(2019版)》规定,针对血液筛查ALT的检测方法是速率法,因血液安全性要求较高,笔者用速率法检测了去除CM前后脂肪血浆的ALT水平,并同步进行了HIV、抗TP、HCV、HBV的酶联免疫吸附试验及核酸病毒检测,结果显示,脂肪血浆去除CM前后检测结果并无差异,且均在《血站技术操作规程(2019版)》规定的范围内。所以,血液筛查ALT及其他输血相关传染病标志物检测合格的脂肪血浆,去除CM后仍然合格,不会影响血液安全。
随着医学的发展,血液中生化指标水平与疾病相关性研究越来越精细,诸多学者的流行病学调查及临床研究表明,高TG、高Tch是心血管疾病风险增加的生物学标志,与急性胰腺炎、冠心病等重大疾病的发生具有相关性,甚至与其他物质联合作用对记忆力等健康因素也有不同程度的影响[14-16]。笔者对脂肪血浆去除CM前后TG、Tch两项指标进行对比分析,首先,脂肪血浆去除CM后的TG、Tch水平较去除前均降低,一方面表明去除CM的方法可行,去除效果较好;另一方面说明CM水平是TG、Tch水平的重要影响因素,国家标准中将脂肪血浆列为报废血液,即不允许将高水平TG、Tch血浆直接用于患者输注,因此脂肪血浆须经技术处理,有效降低TG、Tch水平,避免诱发相关疾病。
综上所述,参考冷沉淀、凝血因子的制备原理,对于高CM水平的脂肪血浆,将普通离心用转移袋改装为CM分离袋,进行CM去除后,在不影响血液输注安全的条件下,FⅧ因子、FⅤ因子、Fib水平均无明显降低,各项生化指标均符合国家标准质量要求,符合临床输注的条件,可在采供血机构进一步推广。

