前列腺癌中HMBOX1的表达水平及其对细胞上皮间质化的影响*
陈立,谢波,叶文鑫,张心男
(浙江省立同德医院 泌尿外科,浙江 杭州 310012)
前列腺癌(prostate cancer, PC)在男性恶性肿瘤发病率中居第2 位,并呈逐年递增的趋势[1]。PC 发病隐匿,确诊时往往发展至晚期,存在肿瘤浸润或远处转移等,失去根治性手术治疗的机会,因此PC 早期诊断及治疗水平的提高迫在眉睫[2]。Homeobox 基因家族在胚胎与器官发育、肿瘤的形成发展中发挥着重要的调控功能[3]。HMBOX1(Homeobox containing 1)是2006年在人胰腺cDNA 文库中新发现的基因,属于Homeobox 家族中的肝细胞核因子基因簇(HNF class),广泛表达于人体各器官组织中。作为一种新型的转录抑制因子调控胚胎发育和细胞分化以及肿瘤的发生、发展[4]。本研究旨在探究HMBOX1 在PC 中的表达变化及其对前列腺癌上皮间质化的影响。
1 资料与方法
1.1 一般资料
选取2015年10月—2017年10月在浙江省立同德医院泌尿外科确诊为PC 并接受根治性前列腺切除术的68 例作为研究对象(PC 组)。其中,年龄32 ~74 岁,平均(60.50±8.03)岁;肿瘤直径<2.5 cm 31 例,≥2.5cm 37 例;Gleason 评分2 ~4 分24 例,5 ~7分30 例,8 ~10 分14 例;TNM 临 床 分 期Ⅰ、Ⅱ期30 例,Ⅲ、Ⅳ期38 例;前列腺特异抗原(prostate specific antigen, PSA)水平<10ng/ml 33 例,≥10ng/ml 35 例;有淋巴结转移36 例,无淋巴结转移32 例。选取同期本院就诊的良性前列腺增生(benign prostatic hyperplasia, BPH)患者70 例作为对照组(BPH 组)。纳入标准:①经病理学检测首次确诊为PC 患者并行根治性前列腺切除术;②所有患者术前未接受手术、放化疗等抗癌治疗;③临床及随访资料完整;④无糖尿病、冠状动脉粥样硬化性心脏病、高血压、严重自身免疫性疾病或其他恶性肿瘤;两组患者的年龄比较,差异无统计学意义(P>0.05)。研究经本院医学伦理委员会批准,且所有患者自愿签署知情同意书。
1.2 主要试剂与仪器
细胞系PC-3 购自上海科兴生化试剂,pMD2.0 G 和pAXAS2 质粒购自山东维真生物科技有限公司,E-钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)和HMBOX1 兔多克隆抗体均购自英国Abcam 公司,DAB显色液和苏木精染色液购自北京中杉金桥生物科技有限公司,HRP 标记二抗、PEG8000、嘌呤霉素均购自生工生物工程(上海)股份有限公司,Transwell 小室、Matrigel 基质胶购自美国Corning 公司,普通光学显微镜、荧光显微镜均购自日本Olympus 公司。
1.3 免疫组织化学法检测HMBOX1 的表达
组织标本常规脱水、透明、包埋、切片处理后,依次于二甲苯Ⅰ、二甲苯Ⅱ、无水乙醇Ⅰ、无水乙醇Ⅱ、95%乙醇、80%乙醇、70%乙醇中处理4min。自来水冲洗,柠檬酸盐缓冲液中煮沸10min,蒸馏水冲洗2 次,5min/次。3%过氧化氢溶液孵育10min,磷酸盐缓冲液(PBS)洗涤2 次,每次5min。1%牛血清清蛋白室温封闭1h。1 ∶300 稀释Anti-HMBOX1 兔多克隆抗体,4℃孵育过夜。PBS 洗涤2 次,每次5min。辣根过氧化物酶标记的二抗室温孵育1h,PBS 洗涤2 次,每次5min。双花扁豆凝集素显色液显色10min,流动自来水冲洗5min。苏木精复染1min,自来水冲洗5min。1%盐酸乙醇分化3s,自来水冲洗5min。依次在70%、80%、90%、95%、100%梯度乙醇、二甲苯Ⅰ、二甲苯Ⅱ中处理4min,中性树胶封片。判定标准:每张切片随机选择3 个高倍视野,综合阳性细胞比例和染色强度进行评分。阳性细胞比例:0 分为阳性细胞比例<5%,1 分为阳性细胞比例5%~<25%,2 分为阳性细胞比例25%~<50%,3 分为阳性细胞比例50%~<75%,4 分为阳性细胞比例≥75%。染色强度:0 分为不着色,1 分为淡黄色,2 分为黄色,3 分为棕黄色或褐色。阳性细胞比例与染色强度总分0 ~3 分为HMBOX1 低表达,4 ~7 为HMBOX1 高表达。
1.4 HMBOX1 过表达细胞系构建
分子克隆构建plenti-GFP-HMBOX1 慢病毒表达载体,将辅助质粒pMD2.0 G 和pAXAS2 分别与plenti-GFP-HMBOX1 或plenti-GFP 空载共同转染HEK293T细胞,转染12 h 后更换新鲜DMEM 培养基,在48 和72 h 时分别收集细胞培养上清液,收集的病毒溶液按每4 ∶1 的比例加入PEG8000 进行浓缩,4℃静置12 h,8 000 r/min 离心20 min,沉淀用新鲜DMEM重悬后加入到处于对数生长期的PC-3 细胞中,感染48 h 后,嘌呤霉素(1 μg/ml)筛选1 ~3 d,显微镜下观察,当存活细胞全部表达绿色荧光时即稳定细胞系构建成功。plenti-GFP 空载和plenti-GFP-HMBOX1细胞系分别为对照组和实验组。
1.5 Western blotting 检测HMBOX1、E-cadherin及Vimentin 的表达
PC-3 HMBOX1及对照组稳定细胞系构建成功后,分别计数2×106个细胞,12 000 r/min 离心3 min,收集细胞沉淀,加入200 μl SDS 上样缓冲液,沸水浴煮10 min,SDS-PAGE 电泳,转膜,5%脱脂奶粉室温封闭1 h。1 ∶1 500 稀释的HMBOX1 和Vimentin、1 ∶500稀释的E-cadherin 兔多克隆抗体4℃孵育过夜。PBS洗涤3 次,8 min/次。1 ∶5 000 稀释的羊抗兔HRP二抗室温封闭1 h,ECL 化学发光液显影。以GAPDH作为内参。
1.6 划痕实验(Wound-Healing Assay)
将处于对数生长期的PC-3 HMBOX1 过表达及对照组细胞用胰酶消化后,DMEM 完全培养基重悬。以60%的细胞密度铺96 孔板,每组设置3 个平行复孔。37℃,5%二氧化碳CO2培养箱过夜。更换低浓度血清培养基(1% FBS),用1ml 枪头对准96 孔板下端中央部位,向上轻推形成划痕,PBS 漂洗3 次,低浓度血清培养基继续培养。在12h 时使用细胞成像设备扫版进行扫描读板,采用Image J 分析划痕的修复状况。
1.7 Transwell 检测HMBOX1 过表达对细胞侵袭能力的影响
分别收集PC-3 HMBOX1 过表达及对照组细胞,PBS 洗涤3 次,重悬于无血清DMEM 培养基中,并调整细胞浓度至5×105个/ml。取100 μl 细胞悬液接种于Transwell 小室,下室则加入含10%血清的DMEM完全培养基500μl。培养24h 后,Transwell 小室用PBS 洗2 次,甲醇溶液固定30 min。PBS 洗2 次,0.1%结晶紫染色20min。PBS 洗2 次,然后用棉签轻轻拭去上层未侵袭的细胞,光学显微镜下随机选择5 个视野并统计平均穿膜细胞数。
1.8 统计学方法
数据分析采用SPSS 22.0 统计软件,计量资料以平均数±标准差(±s)表示,比较采用t检验;计数资料以率(%)表示,比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 HMBOX1 在PC 组织中的表达变化
免疫组织化学检测及统计结果显示,HMBOX1 蛋白主要定位于细胞核和胞质中。BPH 组HMBOX1 蛋白的阳性表达率为55.71%(39/70),PC 组HMBOX1蛋白的阳性表达率下降至19.12%(13/68),两组比较,差异有统计学意义(χ2=15.023,P=0.000)。见图1。
2.2 HMBOX1 过表达对Vimentin 和E-cadherin的影响
Western blotting 结果显示,细胞中HMBOX1、E-cadherin、Vimentin 蛋白的相对表达水平,对照组分别为(0.33±0.04)、(0.41±0.06)、(2.15±0.17),实验组分别为(1.91±0.14)、(1.70±0.15)、(0.62±0.05)。HMBOX1 在对照组细胞中的表达水平较低,而在实验组细胞中的表达水平增加(t=13.026,P=0.000),表明HMBOX1 过表达稳定细胞系构建成功。与对照组细胞比较,实验组E-cadherin 的表达水平增加,Vimentin 的表达水平下降,差异有统计学意义(t=5.377和8.706,P=0.021 和0.006)。见图2。
2.3 HMBOX1 过表达对PC-3 细胞迁移的影响
与对照组细胞愈合度(87.42±9.10)比较,实验组细胞12h 后的划痕愈合度(41.33±9.10)增加,差异有统计学意义(t=4.187,P=0.007)。见图3。
2.4 HMBOX1 过表达对PC-3 侵袭的影响
对照组和实验组侵袭至Transwell 上室膜上的细胞数分别为(421.88±45.70)和(172.06±19.25)个,实验组侵袭细胞数低于对照组,差异有统计学意义(t=9.507,P=0.004)。见图4。

图1 HMBOX1 在不同组织中的表达 (×200)
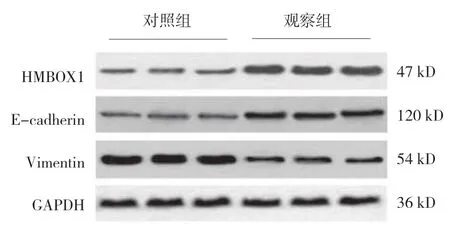
图2 HMBOX1 过表达对Vimentin 和E-cadherin 的影响

图3 HMBOX1 过表达对PC-3 细胞迁移的影响 (×200)

图4 HMBOX1 过表达对PC-3 侵袭能力的影响 (×400)
3 讨论
HMBOX1并在人类胰腺、肝脏、脑及胎盘等组织中呈高表达[5]。已有文献报道,Homeobox 家族基因在细胞增殖和凋亡、血管生成、DNA 修复以及肿瘤转移等生物学过程中起重要作用[6-7]。目前关于HMBOX1基因的研究仍处于初始阶段,主要集中在对NK 细胞的杀伤调控、参与骨髓基质细胞向血管内皮细胞分化及DNA 的修复等[8]。此外HMBOX1 在肿瘤中的表达异常也引起众多学者的关注,如HMBOX1 在肝癌、神经胶质瘤以及卵巢癌中低表达,而在肾透明细胞癌中呈高表达,广泛参与肿瘤形成及进程调控[9-10]。本研究发现HMBOX1 蛋白在前列腺癌组织中的表达水平较前列腺增生组织下降,表明HMBOX1 蛋白可能在前列腺癌的发生及进展中扮演着重要的角色。
Ⅲ型细胞上皮间质转化(epithelial-mesenchymal transition, EMT)是指原本具有上皮细胞特性的肿瘤细胞失去细胞极性,获得间质细胞的特性,细胞形态趋长梭形,具备更强的移动能力,更易从原始部位脱离,通过血液或淋巴系统定植远处器官或组织,进而导致肿瘤的远处转移[11]。大量研究显示,EMT 与肿瘤的发生、转移、免疫抑制以及耐药等密切相关[12]。EMT 的发生涉及大量转录因子的表达变化及Wnt/β-catenin、Notch、STAT3、PI3K/Akt、Pten 等多种信号通路,并伴随上皮细胞标志蛋白E-cadherin、角蛋白的下调及间质细胞标志蛋白神经钙黏蛋白(N-cadherin)、Vimentin 的上调[13-14]。已有研究表明PC 组织中EMT相关蛋白的表达水平发生变化,并与PC 的分期、组织分级、转移以及复发等存在紧密的联系[15]。
本结果显示,与对照组PC 细胞比较,过表达HMBOX1 的细胞中E-cadherin 的表达水平增加,Vimentin 的表达水平则下降,划痕创口愈合慢,迁移速度降低。Transwell 小室实验也同时证明过表达HMBOX1 的细胞较对照组细胞比较,其黏附性增强,细胞穿膜数降低。这表明过表达HMBOX1 后,PC 细胞的EMT 现象得到抑制,肿瘤细胞的侵袭迁移能力受到明显的削弱。既往研究表明,HMBOX1 可能通过多种途径参与肿瘤信号通路的调节,如HMBOX1 通过NKG2D/DAP10 信号途径来抑制NK 细胞对肿瘤细胞的杀伤功能[16]。本研究证明,HMBOX1 与前列腺癌EMT 相关信号通路的调节有密切关系。EMT 受Snail、Zeb、Twist等众多重要转录因子及Wnt、Notch、STAT3、PI3K/Akt等信号通路的复杂调控[17],本研究虽然证明,转录抑制因子HMBOX1 可能通过EMT 相关路径参与PC 的作用机制,但其也可能通过其他作用靶标发挥PC 抑制效应,并且HMBOX1 究竟通过何种信号通路调控PC EMT 现象也有待进一步研究。
综上所述,HMBOX1 在PC 组织中表达下调,HMBOX1 过表达能抑制PC 的上皮间质化现象及肿瘤的侵袭转移,有望成为PC 诊断及治疗的新靶点。

