核心素养下物质性质主题式教学的实践与反思
秦文明


【摘要】主题式教学是指以内容为教学载体,以文本的内涵为主体,通过学生的自主活动培养核心素养的一种教学活动。本文以SO2的性质为教学载体,通过主题式教学探究SO2的酸性、还原性、氧化性及漂白性,让学生的“证据推理与模型认知”、“科学探究与创新意识”等核心素养在化学课堂中落地生根。
【关键词】核心素养 教学 SO2 科學探究
—、教学背景
《普通高中化学课程标准(2017年版)》明确指出,普通高中化学课程以全面发展学生化学学科核心素养为主旨,确定课程的主题,重视以学科大概念为核心,使课程内容结构化,以主题为引领,使课程内容情境化,促进学科核心素养的落实。主题教学是指以某一主题为教学载体,以学生的自主活动为主体进行的一种教学活动。教学主题立足于学生的知识水平和生活实际,打通书本世界和生活世界的界限,让中学生核心素养在化学课堂中落地生根。主题教学打破单一的集体教学的组织形式,构建民主、平等、合作的师生关系,实现了学生的个性化发展,最终实现学生认知、品德、情感等身心发展的塑造。
本文以“SO2的性质探究”为例,通过主题教学对SO2的知识进行整合和实验探究,突出物质相互转化的特征,充分发挥学生的主体作用,让师生共同成为学习情境的组织者和探究者。通过创设有意义的问题情境,激发学生的学习兴趣和热情,通过理论分析,小组讨论、设计实验方案,实现推理、探究、质疑、归纳、总结、反思、领悟的过程,培养学生的小组合作精神、沟通交流能力以及运用化学知识解决生活实际问题的能力。
二、教学思路
SO2的性质主题内容选自人教版高中化学必修1第四章第三节。学生已经学习了“物质的分类”、“离子反应”和“氧化还原反应”等理论知识,具备了一定的理论分析应用能力;通过学习钠及其化合物、铁及其化合物、硅及其化合物、氯及其化合物,学生对元素化合物知识的学习方法有一定的了解。SO2的性质是高中化学教学的重点、难点,教学中分解为“SO2的酸性、还原性、氧化性及漂白性”四个小主题,按照“理论推导,设计实验,实验探究,得出结论”的科学探究过程,建构研究模型,化解难点,既加强学生对理论知识的理解与感悟,又帮助学生形成元素化合物的一般学习方法。
三、教学过程
1.创设情境,引入新课
教师:投影展示一瓶张裕干红葡萄酒,请学生观看干红的配料,提问:红酒中SO2的作用是什么?还体现SO2的什么性质?
学生:交流SO2的物理性质。
教师板书:
一、SO2的物理性质
学生:归纳、补充SO2的物理性质
教师:能否设计实验,有明显现象证明SO2易溶于水呢?
学生:交流讨论,设计可能的实验方案。
学生:往集满SO2的塑料瓶中加水,瓶瘪了;集满SO2的大试管倒扣于水中,液面上升;用集满SO2的烧瓶做喷泉实验,形成喷泉等。
设计意图:用投影展示生活中熟悉的干红葡萄酒,用红酒中SO2的正面作用与学生已有SO2的负面印象产生冲击,引发学生的学习兴趣,激发其探究欲望。
2.理论分析,预测性质
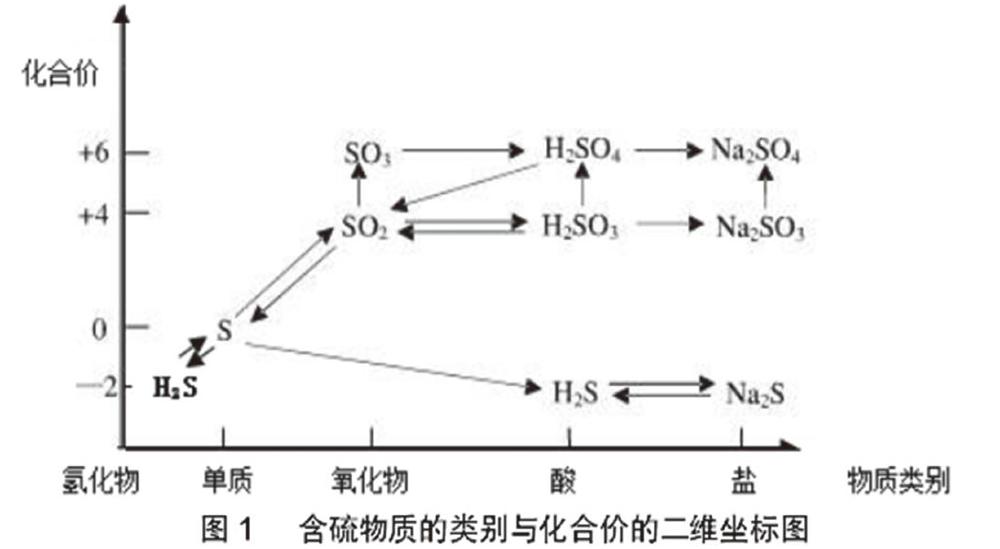
教师:请将H2S、S、SO2、SO3、H2SO3、H2SO4、Na2SO3、Na2SO4、Na2S这些物质以物质类别为横坐标,化合价为纵坐标画一个坐标图(见图1)。
教师:请根据SO2的类别和价态,推断SO2具有哪些性质?可以发生哪些类型的反应?
学生:SO2属于非金属氧化物,可能具备酸性氧化物的通性。+4价的S处于中间价态,既可升高到+6价,又可降低至0价,应该既有氧化性又有还原性,可以发生氧化还原反应。
设计意图:让学生绘制含硫物质的类别与化合价的二维坐标图,方便学生形成对元素分类及其转化的概念,从基本概念和认知方面出发复习并构建基本知识框架,再通过转化关系扩充框架,让学生基于已有的认识拓宽思维,建立逻辑思考方式,养成良好的学习方法,形成研究元素化合物的一般思路。
3.设计方案,实验探究
小组活动一:探究SO2的酸性
学生实验:往SO2水溶液中滴加石蕊试液。
教师:为什么SO2水溶液会显酸性?与什么气体相似?
学生:SO2与水反应生成了H2SO3。
学生:这说明SO2是一种酸性氧化物。
教师板书:
二、SO2的化学性质
1.酸性氧化物
教师:分析该反应特征,说明H2SO3的不稳定性,介绍可逆反应。
教师:酸性氧化物SO2还可以发生哪些反应,写出化学方程式。
学生板书:
SO2+2NaOH==Na2SO3+H2O
SO2+CaO== CaSO3
教师:根据酸性氧化物通性,SO2应该也能和某些盐反应,那SO2能不能和BaCl2溶液反应呢?
学生:思考、交流、讨论
教师:多数同学认为可以,请写出反应方程式,说明发生反应的原理。
教师:有同学认为不可以,请说明理由,设计实验验证。
设计意图:通过SO2使石蕊变红的实验,让学生基于证据进行分析推理,验证SO2的酸性。根据SO2是一种酸性氧化物,预测SO2变化的可能结果,巩固从物质的类别认识物质的思路,能依据物质及其变化的信息建构模型,培养学生问题解决的能力。
小组活动二:探究SO2的还原性
学生实验:往SO2水溶液中滴加BaCl2溶液,产生少量白色沉淀。
教师:请同学们分析产生沉淀的成分,如何证明?
教师:从元素化合价的角度分析,SO2发生了什么反应?体现了SO2的什么性质?请设计实验证明?
学生实验:往KMnO4溶液中滴加SO2水溶液。
教师:继续滴加H2O2溶液至SO2水溶液与BaCl2的混合液中,观察现象?
教师:SO2在上述实验中均体现还原性
教师板书:
2.还原性
2SO2+O2==2SO3 SO2+H2O2== H2SO4
教师:请同学们根据以上所学,思考硫酸型酸雨形成的可能途径,写出方程式。
学生:阅读课本、根据资料、交流讨论,得出结论。
板书:硫酸型酸雨形成的可能途径
途径一:
SO2+H2O H2SO3 2H2SO3+O2=2H2SO4
途径二:
2SO2+O2 SO3 SO3+H2O=H2SO4
设计意图:SO2的还原性是本节课的难点。往SO2水溶液中滴加BaCl2溶液,产生少量白色沉淀,引发学生质疑,设计双氧水与SO2溶液反应,通过观察溶液中生成白色沉淀验证SO2的还原性,巩固从物质的化合价认识物质的思路,通过书写反应的化学反应方程式,可以进一步加深学生对知识的理解,发展学生的高阶思维能力。
本主题的设计是让学生能发现和提出有探究价值的化学问题,能依据探究目的设计并优化实验方案,确定形成科学结论所需要的证据和寻找证据的途径。完成实验操作,能对观察记录的实验信息进行加工并获得结论;能尊重事实和证据,养成独立思考、敢于质疑和勇于创新的精神。
小组活动三:探究SO2的氧化性
教师:已知硫是一种淡黄色晶体,不溶于水,从硫元素化合价的角度分析,SO2可与什么物质反应生成硫?体现了SO2的氧化性。请设计实验证明?
学生实验:取少量SO2水溶液于小试管中,再向试管中加入少量H2S饱和溶液,振荡,产生黄色沉淀。
教师:写出发生反应的化学方程式,并用双线桥标出电子转移方向和数目。
教师板书:
3.氧化性
学生:
设计意图:从硫元素化合价的角度分析,继续培养学生从化合价入手分析物质性质的习惯和意识,强化学生认识物质的角度,让学生认识到通过氧化还原反应可以实现含有不同价态同种元素的物质的相互转化,掌握转化方法,构建完整的物质转化思维模型。
小组活动四:探究SO2的漂白性
教师:用实验探究SO2漂白性:向试管中加入2mLSO2水溶液,滴入2滴品红溶液,振荡,观察颜色变化;再在试管口套一个小气球,然后加热试管,观察颜色变化,小心闻一下气球中的气体。
学生实验:品红褪色,加热,品红溶液又恢复红色,气球中的气体有刺激性气味。
教师板书:
4.漂白性
教师:根据结论分析二氧化硫的漂白原理:SO2与某些有色物质生成不稳定的无色物质,
请与次氯酸、活性炭对比漂白原理与效果。
教师:投影日常生活中的实例,归纳总结二氧化硫的用途。
教师板书:
三、SO2的用途
学生:课堂小结
设计意图:实验中SO2使品红褪色,加热,品红溶液又恢复红色,引发学生质疑,通过分析、比较可以拓宽学生的知识视野,认识物质的变化是有条件的,能从不同视角对纷繁复杂的化学变化进行分类研究,逐步揭示各类变化的特征和规律。通过投影日常生活中二氧化硫的用途,让学生感受化学物质及其转化在生产和生活中的应用,了解化学的价值。同时,让学生学会辩证地看待问题,参与社会性问题的讨论,培养其科学精神和创新意识,提高综合素养。
小组活动五:综合应用SO2的性质
教师:①往一支试管中加入2mL溴水,再滴入二氧化硫水溶液,震荡。
②往一支试管中加入1mL稀的NaOH溶液,加入2滴酚酞,再滴入二氧化硫水溶液,震荡。
教师:两支试管中均褪色,请分析原因,并设计实验证明。
学生:交流讨论,汇报结果。
归纳总结:
1.SO2使物质褪色,不一定体现SO2漂白性;
2.SO2的漂白只能针对某些有机色素;
3.探究实验时的一般步骤为:提出问题、作出假设、设计方案、讨论和完善方案、实验探究、得出结论。
教师:根据SO2的性质,我们应如何看待SO2对生产、生活的作用与影响?
课后作业:查阅资料了解①大气中SO2的来源;②我省酸雨的污染状况;③防治酸雨的办法,写一篇关于酸雨的论文。
設计意图:本题通过SO2使一些溶液褪色现象的思考,巩固了SO2的酸性、还原性、漂白性等知识,在解决实际问题时,除了要引导学生考虑化学问题外,还需综合分析多方面因素,注意培养学生思维的完整性和严谨性,建立解决实际问题的思路和方法。
四、教学反思
本课是以“SO2的性质探究”为主题的教学,为学生创设探究学习的情景,激发学生的探究热情,提升学生参与探究的欲望,增强学生对知识的理解,提高学生的探究能力。学生通过设计并展开四个小组活动,探究SO2四个方面的性质,掌握探究实验的步骤:提出问题、作出假设、制订方案、讨论和完善方案、实验探究、得出结论,形成元素化合物的一般学习方法。SO2的性质探究主题活动使学生积极参与学习,充分发挥学生的主体作用,在小组活动中实现推理、探究、质疑、归纳、总结、反思的过程,满足学生的个性化发展,培养学生勤于实践,善于合作,敢于质疑,勇于创新的精神,真正落实化学学科“证据推理与模型认知”、“科学探究与创新意识”等核心素养。
【参考文献】
[1]中华人民共和国教育部.普通高中化学课程标准(2017年版)[S].北京:人民教育出版社,2018:7.
[2]王军翔.追求饱含学科意义的中学化学教学[M].西安:陕西师范大学出版总社,2016(9)1-2.

