脂质体方法用于modRNA 转染各种类型细胞的初步研究
颜冰倩 王会景 艾雪峰 宫艺其 谭瑶 徐徐 王伟 付炜
化学合成修饰信使核糖核酸(Chemically Synthetic Modified Message RNA,modRNA)是一种新兴的基因表达载体。因mRNA 在传递遗传信息、翻译目的蛋白过程中的独特作用,该技术通过对体外合成的mRNA 进行碱基修饰替换和结构优化,进而逃避固有免疫应答,提高体内外的稳定性,并能够在各种化学载体或物理方法的帮助下转入细胞,最终实现在体内外高效、快速地表达所需蛋白的目的。与未修饰的mRNA 相比,modRNA 能够抑制膜受体Toll样受体(Toll-like Receptors,TLR)及胞内受体视黄酸诱导基因蛋白I(Retinoic Acid-Inducible Gene I,RIG I)的激活,避免机体固有免疫应答引起的细胞毒性及炎症损伤等;同时,modRNA 能够通过改变化学结构、抑制核酸酶的剪切等,提高mRNA 在体内外的稳定性,加强其翻译表达蛋白的能力,解决了mRNA 临床转化中高免疫原性、低稳定性等瓶颈问题[1-2],具有极大的应用前景。
与病毒、质粒、蛋白等表达载体相比,modRNA能实现快速、脉冲式地表达所需的目的蛋白,通常在24 h 左右达到高峰期,持续大约1~2 周,但不会引起基因组的改变,避免了不良的免疫应答,是一种安全、高效的基因表达载体[3-4]。研究发现,往小鼠心脏内直接注射成血管因子VEGF modRNA 能够缩小梗死的范围,优化心梗后的血供情况,提高心肌细胞的存活率,改善不良预后,在心梗治疗中具有一定的作用[5]。此外,modRNA 在疾病中的疗效也在大动物模型中得到了进一步的验证[6]。然而,单纯的modRNA裸注射,用量大、费用昂贵、效果欠佳,而且大量的modRNA 裸注射也容易导致细胞凋亡、炎症反应等,限制了在临床治疗中的应用。因此,将modRNA 结合细胞进行治疗,不但能大大减少modRNA 的用量,节约成本,避免不良的副反应,还能充分利用细胞这一载体的优势,高效、安全、局部、短期地将mRNA 翻译表达产生所需的蛋白递送到目的组织中,以充分发挥其生物学疗效[7]。因此,modRNA 结合细胞或许是一种理想的蛋白表达载体,能够在临床转化中表现出更大的优势。
随着生物材料的不断发展,mRNA 的转染方式层出不穷,包括脂质体、高分子纳米颗粒、鱼精蛋白-mRNA 复合物、金纳米颗粒、电穿孔等[8]。目前,脂质体转染法因其高效、稳定、便于广泛应用等优点,仍然是最常见的mRNA 转染方法。本研究旨在筛选更优的modRNA 脂质体转染试剂,探讨将更优的脂质体转染试剂用于modRNA 转染各种类型细胞,并表达所需目的蛋白的可行性。
1 材料与方法
1.1 实验试剂及仪器
RNAiMAX、MessageMax、Opti-MEM、0.25% EDTA/胰酶(Life Technologies,美国),高糖DMEM、PBS、双抗(Hyclone,美国),FBS(Bioind,以色列),DMSO(Sigma,美国),DH5a 感受态细胞(天根生化科技有限公司),Xhol 酶、质粒小抽试剂盒、PCR 纯化试剂盒、体外转录试剂盒、转录物纯化试剂盒(Thermo,美国),TBX5 一抗(Proteintech,美国),驴抗兔IgG 二抗(Abcam,英国),DAPI(上海翊圣生物科技有限公司)。pUC57-GFP/pUC57-mCherry/pUC57-nGFP/pUC57-mTBX5 质粒及PCR 引物均订购于上海桑尼生物科技有限公司。
流式细胞分析仪(FACSCantoTMFlow Cytometer,BD,美国),激光扫描共聚焦显微镜(TSC SP8,Leica,德国),倒置荧光显微镜(DMI3000B,Leica,德国),凝胶成像仪(Tanon-3500,上海天能科技有限公司),NanoDrop 2000(Thermo,美国)。
1.2 实验动物
12.5d 的ICR 孕鼠1 只(上海南方模式生物科技股份有限公司),本实验遵守实验动物伦理原则。
1.3 实验方法
1.3.1 质粒转化、扩增、提取
取1 μg 质粒与20 μL DH5a 感受态细胞混匀后置于冰上,42 ℃热激90 sec 后冰浴数分钟,加入1 mL 无抗性LB 于37 ℃摇床上活化1 h,随后取少许菌液涂于氨苄青霉素(Amp)抗性的LB 板上37 ℃倒置培养过夜。次日挑取白色单菌落加入Amp 抗性LB 培养液中,37 ℃摇床扩增过夜。参照质粒小抽试剂盒说明书提取纯化质粒,凝胶电泳鉴定及nanodrop 鉴定。
1.3.2 modRNA 制备
用 Xhol 酶 对 pUC57 -GFP/pUC57 -mCherry/pUC57-nGFP/pUC57-mTBX5 质粒进行单酶切,参照PCR 纯化试剂盒说明书对酶切产物进行纯化,PCR扩增GFP/mCherry/nGFP/ mTBX5 的CDS 序列,再次纯化后进行凝胶电泳及nanodrop 鉴定。以Anti Reverse Cap Analog、3'-O-Me-m7G(5')ppp(5')G RNA Cap、N1-甲基假尿嘧啶(N1-methylpseudouridine,m1Ψ)、ATP、CTP、GTP 为原料进行体外转录,参照转录物纯化试剂盒说明书对转录产物进行纯化,随后进行磷酸化处理并再次纯化,nanodrop 鉴定,将modRNA 稀释成1 μg/μL 于-80 ℃储存。详细步骤见参考文献[6,9]。
GFP/mCherry/nGFP 的CDS 序列见参考文献[5,10],mTBX5 的CDS 序列见NM_011537.3。
1.3.3 MEF 细胞分离、提取
将12.5 d 的ICR 孕鼠处死,取出胚胎置于10 mm培养皿中,去除头部、内脏、四肢,将剩余组织剪碎后加入3 mL 0.25%EDTA/胰酶,置于37 ℃培养箱中消化20 min,再加入3 mL 0.25% EDTA/胰酶,继续消化20 min,用6 mL 高糖DMEM 培养液(含10%胎牛血清、1%双抗)中止消化,充分混匀后静置数分钟,取上清离心5 min 后按合适密度种到10 mm 培养皿,次日PBS 清洗后换液,一般使用第2~4 代的MEF 细胞。
1.3.4 细胞培养、冻存
MEF 细胞、3T3 细胞、Hela 细胞、MCF-7 细胞均采用高糖DMEM 培养液(含10%胎牛血清、1%双抗)培养,培养条件为37 ℃、5%CO2,每2~3 天换液,融合80%左右传代。细胞冻存则均采用60%高糖DMEM 培养液+30%胎牛血清+10%DMSO 配制冻存液,冻存于液氮中。
1.3.5 转染方法
将各类细胞以合适的细胞量接种至6 孔板中,70%~80%融合时进行转染。EP 管A:将2 μg mod-RNA 混 于98 μL optimem 中;EP 管B:将5 μL RNAiMax 或MessageMax 混于95 μL optimem 中。室温静置5 min,A 管+B 管混匀,再室温静置15 min。同时,吸去6 孔板中的培养液,PBS 清洗后加入2 mL optimem,再将加入上述转染混合液,摇匀。培养箱内孵育4~6 h,吸去optimem,换回培养液。24 孔板的转染体系为6 孔板的1/4。
1.3.6 转染效率及平均荧光强度(MFI)测定
转染modGFP 后取合适时间点对细胞进行荧光显微镜观察,PBS 清洗后消化细胞,使用流式细胞分析仪检测GFP 阳性细胞比例和MFI。
1.3.7 免疫荧光
对于核内蛋白,MEF 细胞接种在24 孔细胞爬片上培养24 h 后进行modRNA 转染,转染24 h 后进行免疫荧光实验。吸去培养液,PBS 清洗细胞3次,4%多聚甲醛固定20 min,0.5% Triton-100 破膜通透20 min,10%山羊血清室温封闭2 h,一抗4 ℃孵育过夜,PBS 漂洗3 次,二抗室温避光孵育2 h,PBS 漂洗3 次,DAPI 染5~10 min 后PBS 漂洗一次,封片后避光保存,激光共聚焦显微镜下观察。
1.4 统计学分析
采用GraphPad Prism 8.0.2 软件(美国)进行统计分析,数据以()表示,组间比较采用非配对t检验,P<0.05 表示差异具有统计学意义。
2 结果
2.1 modRNA 制备与鉴定
将pUC57-GFP/pUC57-mCherry/pUC57-nGFP/pUC57-mTBX5 质粒经限制性内切酶Xhol 单酶切后使得环形质粒线性化,采用特异性引物对GFP/mCherry/nGFP/mTBX5 CDS 序列进行PCR 扩增,随后体外转录生成GFP/mCherry/nGFP/mTBX5 modRNA,对上述步骤的产物进行凝胶电泳鉴定(图1)。
2.2 modGFP 转染MEF,筛选更优的转染试剂
当MEF 细胞融合达70%~80%,采用Message-Max 转染modGFP 24 h 后,荧光显微镜下可以观察到大部分MEF 细胞能够翻译表达绿色荧光蛋白(GFP),并对其进行流式细胞分析,发现MEF 细胞的转染效率达(83.33%±3.23%)。而RNAiMax 24 h时modGFP 的转染效率为(78.77%±6.12%),略低于MessageMax,但两者没有统计学差异。分别采用荧光显微镜和流式细胞分析仪记录两种转染试剂转染modGFP 后1 周MEF 细胞的蛋白表达情况,发现MessageMax 的平均荧光强度明显高于RNAiMax,表明其翻译表达GFP 的效率更高(图2)。
2.3 modGFP 在不同其他种类细胞中的表达情况
为了验证MessageMax 是否同样适用于其他细胞系modRNA 的转染实验,采用MessageMax 将modGFP 分别转染入3T3 细胞、Hela 细胞及MCF-7细胞,可以发现上述细胞均能快速、高效地翻译和表达GFP,24 h 时的转染效率分别为(76.67%±0.15%)、(93.33%±1.42%)、(77.30%±4.57%)。说明Message-Max 不但能够实现原代细胞的高效转染,如MEF 细胞,还能够介导肿瘤细胞系及成纤维细胞系的mRNA转染,应用范围广(图3)。
2.4 两种不同modRNA 共转在细胞中的表达情况
为了验证MessageMax 能否介导两个甚至多个不同的modRNA 同时高效转染,采用MessageMax将modGFP 和modmCherry 同时转染入MEF 细胞中,24 h 后荧光显微镜观察,可以发现大部分MEF细胞能够同时翻译表达GFP 和mCherry,共转效率高。说明MessageMax 能够实现同一细胞内多个因子的共同转染,为基础研究或临床治疗中多个modRNA的联合应用奠定了基础(图4)。
2.5 核内因子的转染及鉴定
为验证MessageMax 能否顺利实现核内蛋白的翻译表达及精准定位,采用MessageMax 将modnGFP转染入MEF 细胞24 h 后,发现添加核定位序列的GFP 能够与DAPI 实现共染,很好地定位到了细胞核中。将转录因子mTBX5 modRNA 通过Message-Max 转染到MEF 细胞中24 h 后,能够发现转录因子在细胞核内的定位表达。说明MessageMax 作为一种良好的modRNA 转染试剂,不但能应用于胞内蛋白的研究中,还能够介导转录因子等多种核内蛋白的高效翻译和表达,适用范围广(图5)。
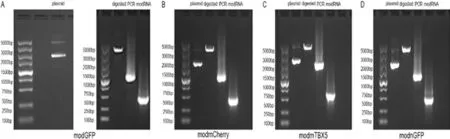
图1 modRNA 制备过程中质粒、酶切、PCR、体外转录的鉴定结果Fig.1 Identification of plasmid,digested product,PCR product and IVT product during the preparation of modRNA
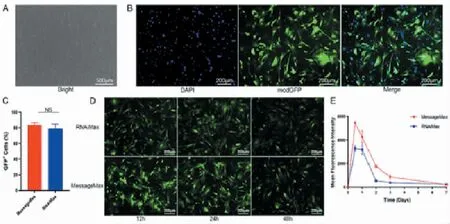
图2 两种modRNA 转染试剂的转染效率及蛋白表达强度Fig.2 Transfection efficiency and protein expression effects of two modRNA transfection reagents
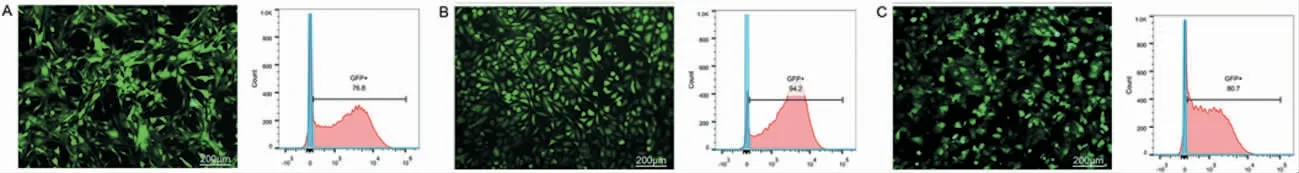
图3 modGFP 转染3T3 细胞、Hela 细胞及MCF-7 细胞的荧光图及流式分析Fig.3 Fluorescence image and flow cytometric analysis of 3T3 cells,Hela cells and MCF-7 cells after modGFP transfection
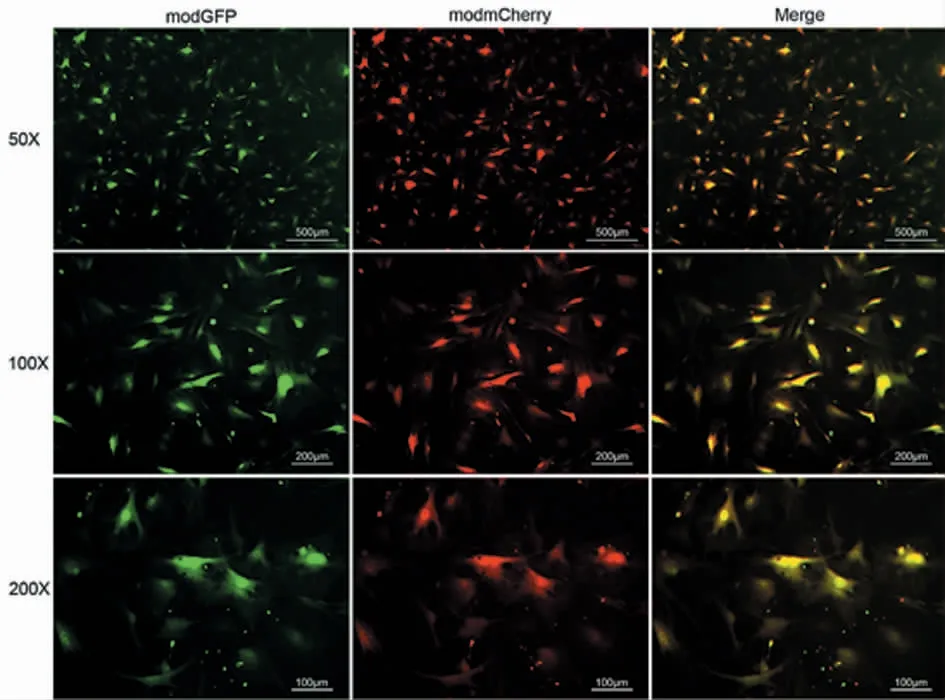
图4 MEF 细胞共转modGFP 和modmCherry 的荧光图Fig.4 Co-transfection of modGFP and modmCherry into MEF cells
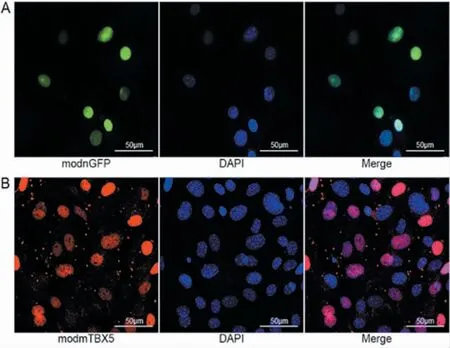
图5 MEF 细胞转染核内因子nGFP modRNA 和mTBX5 modRNA 的荧光鉴定Fig.5 Fluorescent analysis of nGFP modRNA and mTBX5 modRNA into MEF cells
3 讨论
随着对人类遗传学的深入探索和对精准医疗的迫切需要,不论是疾病发生发展过程中机制方面的探究,还是基因缺陷性疾病的替代性治疗,抑或是通过高表达某种蛋白来发挥旁分泌作用、调控细胞功能等,基因载体都扮演着一个越来越重要的角色,是基础研究及临床治疗中不可或缺的一种手段。目前,主要的基因载体包括病毒、质粒、mRNA、蛋白等。传统的病毒载体主要涉及安全性问题,不论是基因整合的风险还是病毒自身,在真正临床应用中都不可避免受到各种质疑。质粒DNA 因转染效率低和蛋白表达量少在应用中也受到一定的限制,而直接注射蛋白则存在着高免疫原性、半衰期短、价格昂贵等缺点。因此,modRNA 通过体外合成碱基修饰的信使核糖核酸,不仅改善了mRNA 应用过程中高免疫原性的不良反应,还提高了体内外的稳定性及翻译表达效率,能够实现所有目的蛋白在体内外高效、快速、脉冲式地表达,具有良好的临床转化价值[2-4,11]。
然而,modRNA 应用也面临着瓶颈问题,比如:单纯的modRNA 裸注射用量大,转染效率不够高,蛋白表达不够强,费用昂贵,且modRNA 载体通常具有一定的毒性,大剂量转染容易引起细胞凋亡或炎症反应等,从而在某种程度上限制了该技术的进一步推广及应用[7]。
因此,将modRNA 技术与细胞治疗相结合,或许能够取长补短,是一个极具应用价值的研究方向。一方面,细胞通过提供蛋白合成过程中的一系列化学物质和能量,使得modRNA 能够快速、高效、脉冲式地翻译表达目的蛋白,从而充分发挥基因载体的功能[12-14]。我们的方法是先体外利用modRNA 转染细胞后,再利用细胞这个媒介进行基因研究或疾病治疗,从而更高效地发挥modRNA 的功能。因此,筛选高效的modRNA 转染试剂,并证实该转染试剂能够介导多种细胞、多种modRNA 的转染表达多种蛋白,可为将来modRNA 的进一步应用奠定基础。另一方面,modRNA 转染细胞也能对细胞的生物学功能起到一定的调控作用,modRNA 不仅能够利用细胞作为蛋白加工厂,生产目标蛋白,还能够促进干细胞分化[5,15]、介导细胞转分化、诱导细胞重编程等[16-17]。因此,筛选出高效的modRNA 转染试剂十分重要,而该转染试剂能够介导多种modRNA 共转表达多种蛋白或者介导核内蛋白modRNA 的转染都是modRNA 充分发挥上述生物学功能的前提。
尽管针对mRNA 转染的各种新型转染方式和转染试剂层出不穷,但阳离子脂质体仍是目前最主要的转染载体。因此,本研究通过筛选更优的modRNA 的阳离子脂质体转染试剂,探讨是否能够将其应用于多种类型细胞的转染中,是否能够实现包括转录因子在内所有的目的蛋白的翻译表达,是否能够实现多个因子的共同转染和表达。
本研究通过转染modGFP 比较了RNAiMax 及MessageMax 这两种mRNA 转染试剂的转染效率和蛋白表达强度,经流式细胞仪、荧光显微镜分析,发现modGFP 转染MEF 细胞后能够快速、高效、脉冲式地表达绿色荧光蛋白,在12~24 h 达到峰值,并持续1 周以上;同时,与RNAiMax 相比,MessageMax虽然在转染效率上没有显著提高,但是平均蛋白表达水平明显增加,峰值上升,呈现更典型的“脉冲式”表达的曲线模式,是一种更优的modRNA 转染试剂;并且,modRNA 能够高效转染多种类型细胞,包括原代细胞、多种肿瘤细胞系、成纤维细胞系等,具有广阔的应用平台,有望在多种类型细胞的基础研究及临床治疗中发挥价值。此外,modRNA 不仅能够实现多种蛋白在同一细胞内的表达,还能够翻译表达产生有功能的核内转录因子,为多基因替代性治疗、重编程、转分化等研究提供一定的前期基础。
综上所述,MessageMax 作为一种理想的modRNA转染的阳离子脂质体,能够高效、快速地将modRNA导入目的细胞中产生所需的蛋白,进而实现其治疗价值,也使得modRNA 成为一种高效而安全的基因载体,在基础研究和临床转化中均具有广阔的前景。
——一道江苏高考题的奥秘解读和拓展

