基于鸡蛋清制备的多孔支架用于组织工程软骨构建的实验研究
贾子豪 李豪 徐勇 周广东 谭晓燕 张伟
软骨缺损临床极为常见,但治疗方法有限。近年来,组织工程技术为软骨缺损的修复提供了新的途径。在组织工程软骨中,支架材料具有关键作用,选择一个合适的支架材料十分重要。
目前,组织工程软骨支架材料包括天然高分子材料、人工合成材料和复合支架材料[1-3]。虽然材料来源众多,但每种材料都存在某些不足。天然材料具有良好的生物相容性,来源广泛,价格低廉,是近年来研究的热点。以蛋白质为主的天然生物材料已被广泛应用于生物医学领域。
鸡蛋蛋白具有天然无毒、生物相容性好、无明显炎症反应、人体易于降解等特点,且来源丰富、成本低廉。蛋清的主要成分包括:卵清蛋白、卵铁传递蛋白、卵类黏蛋白和溶菌酶。其中,卵铁传递蛋白和溶菌酶具有很强的抗菌性。研究表明,卵清蛋白和卵类黏蛋白具有刺激肌母细胞增殖,以及促进肌管生长的作用[4-5]。以上特性表明,蛋清可用于制备生物材料。
本研究拟将鸡蛋清与去离子水混合后通过冷冻干燥制备成多孔支架,探索其孔隙率及力学性能;将兔耳软骨细胞接种于该种支架后进行体外培养,以探究该支架用于制备组织工程软骨的可行性。
1 材料与方法
1.1 实验试剂及仪器
胰蛋白酶、高糖DMEM 培养基、胎牛血清、青霉素-链霉素-两性霉素B、磷酸盐缓冲液(Hyclone 公司,美国)。
扫描电镜(SU8010,日立公司,日本),生物力学分析仪(Instron 公司,美国),CCK-8 检测试剂盒(上海晶抗生物工程有限公司)。
1.2 蛋清材料的制备
取适量生鸡蛋,分离蛋清后搅匀。将蛋清与去离子水以1:0、1:1 和1:2 的体积比分别制备蛋清材料,冷冻干燥后备用。
1.3 蛋清材料的SEM 表征
将不同体积比的蛋清材料,用2.5%戊二醛4 ℃下固定24 h,然后用pH 7.4 的PBS 缓冲液冲洗后,1%锇酸4 ℃条件下固定4 h,再用梯度乙醇脱水,CO2干燥器干燥、喷金、黏托,电镜观察蛋清材料的微观结构,并通过电镜图片计算其孔隙率。
1.4 生物力学检测
将蛋清样本剪成0.5 cm×1 cm 的长方形小块,置于压缩测试仪上,沿垂直样本方向以1 mm/min的速度压缩,直到样本组织变形,计算杨氏模量。
1.5 种子细胞的获取与扩增
取兔耳软骨,洗净,切成1 mm×1 mm×1 mm 大小,加入5 倍体积的0.25%胶原酶摇床消化过夜;100 μm 孔径滤网过滤,1 500 r/min 离心5 min,PBS漂洗2 遍,以含10%FBS 的高糖DMEM 配成细胞悬液,按2×106个/皿(直径10 cm 培养皿)接种细胞,置入5%CO2、37 ℃培养箱培养。细胞达90%融合时传代。取第2 代软骨细胞用于后续实验。
1.6 活死细胞染色
将经环氧乙烷消毒的三种不同体积比的材料,制成直径5 mm 圆形膜片放入24 孔板中,加入浓度为100×106cells/mL 的软骨细胞悬液6 μL,置于5%CO2、37 ℃培养箱培养,4 h 后加入含10%FBS 的高糖DMEM 培养液至覆盖复合物后继续培养。分别于第1、4、7 天进行活死细胞染色。活死细胞染色试剂盒使用步骤:先根据说明书配置活死细胞染色检测工作液;吸去样品中培养基后加入200 μL 的Live/Dead 检测工作液,室温避光孵育15 min;吸去染液后用无菌PBS 清洗3 遍,加入1 mL 的PBS 溶液,荧光显微镜下观察拍照。
1.7 细胞增殖率检测
将经环氧乙烷消毒的直径5 mm 的圆形蛋清材料放入24 孔板中,加入浓度为100×106cells/mL 的软骨细胞悬液6 μL,置于5%CO2、37 ℃培养箱培养,4 h 后加入含10%FBS 的高糖DMEM 培养液至覆盖复合物后继续培养。分别于第1、4、7 天,向每孔加入10 μL 的CCK-8 溶液,继续孵育。4 h 后将24孔板里的溶液轻轻吸除,移到96 孔板中,多功能酶标仪检测450 nm 处的吸光度。
1.8 组织学检测
取兔耳软骨细胞,接种于不同体积比的蛋清支架材料,体外培养3 周后取出,脱水、石蜡包埋,切片(厚度5 μm),HE 染色,观察组织结构及细胞外基质分泌情况。
1.9 统计学分析
数据统计采用GraphPad Prism 软件(Version 5.00,GraphPad Software,美国),数据以()表示,组间比较采用非配对t 检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 不同体积比蛋清材料形态观察及其孔径对比
三种不同体积比支架大体观无明显区别,材料均质,外形规则,成形较好。扫描电镜显示,随着去离子水比例增加,蛋清材料孔径逐渐增加。定量分析显示,体积比为1:0、1:1 和1:2 的蛋清材料孔径大小分别为(79.2±10.9)μm、(177.6±17.5)μm 和(282.8±19.7)μm(图1)。
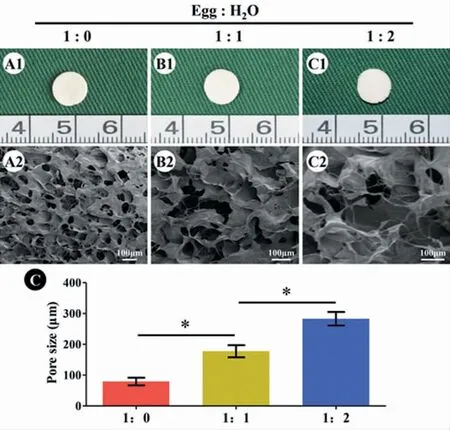
图1 蛋清支架大体及电镜观察Fig.1 Gross and SEM Observation of egg white scaffolds
2.2 力学性能检测
杨氏模量检测显示,去离子水比例的增加,使支架材料的力学强度逐渐下降。体积比为1:0、1:1 和1:2的材料杨氏模量分别为(66.6±7.2)KPa、(46.2±8.3)KPa和(28.4±4.6)KPa(图2)。
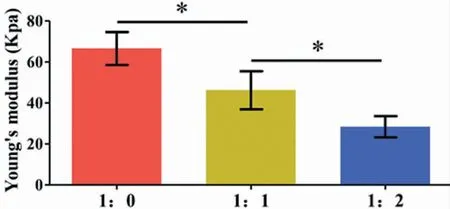
图2 三种不同体积比蛋清支架杨氏模量对比(*:P<0.05)Fig.2 Young's modulus comparison of scaffolds with three different volume ratios (*:P<0.05)
2.3 活死细胞染色与细胞增殖率检测
结果显示,在接种软骨细胞后的第1~7 天,软骨细胞在三种蛋清支架中均增殖良好。随着去离子水比例的增加,软骨细胞黏附在蛋清支架上的细胞量明显增加。CCK-8 检测细胞增殖结果亦与此相符(图3)。
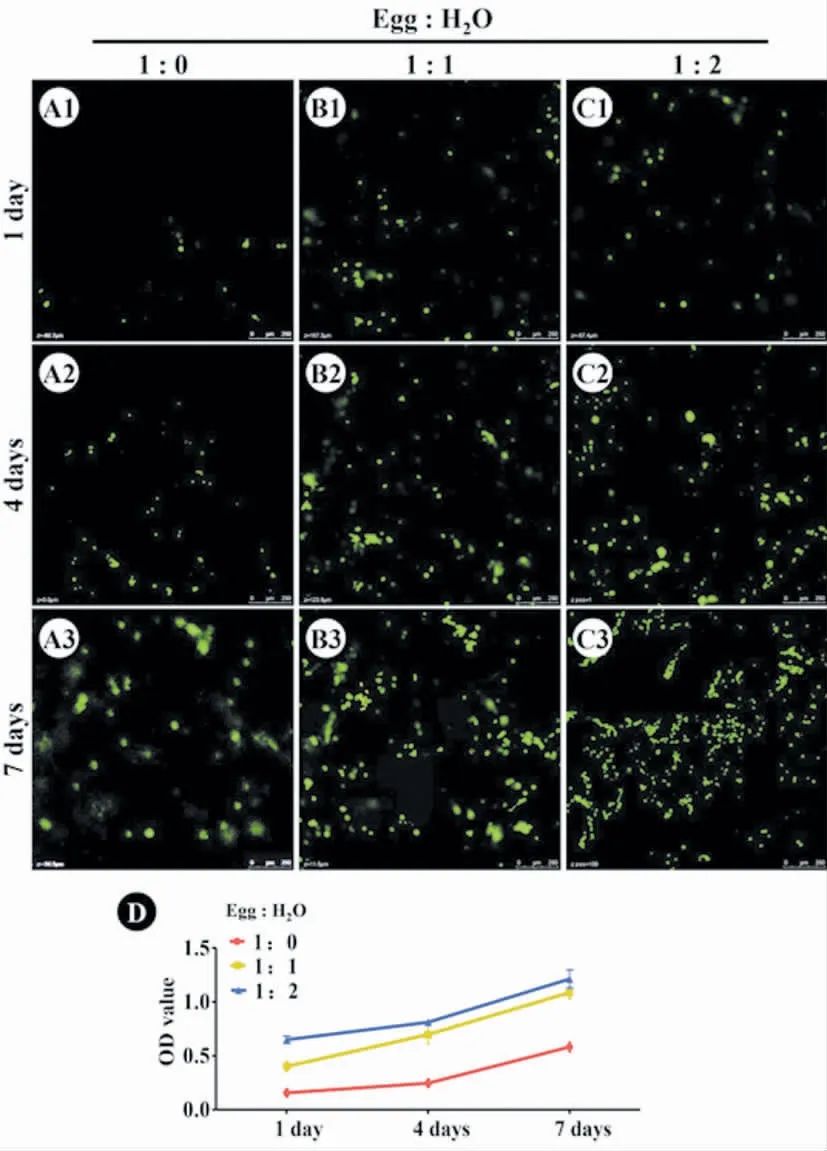
图3 活死细胞染色与细胞增殖率检测Fig.3 Living &dead cell staining and cell proliferation assay
2.4 体外软骨构建
三种不同体积比蛋清支架接种软骨细胞后,经体外培养3 周,HE 染色显示软骨细胞外基质结构基本形成。随着去离子水含量的增加,残余的材料量越来越少,而新生的软骨基质成分越来越多(图4)。
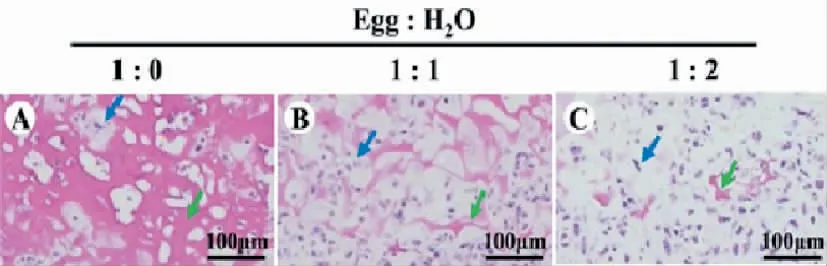
图4 体外软骨再生Fig.4 In vitro cartilage regeneration
3 讨论
近年来,软骨损伤发病率呈增高趋势,而软骨本身无血管、淋巴管分布,一旦损伤很难自行修复。现有的软骨损伤修复方法,如自体或者异体组织(骨膜、软骨膜)移植等,存在来源有限、供区损伤、二次手术、容易引起免疫反应等诸多不足之处。
组织工程技术的快速发展为解决这一难题提供了新的思路。制备组织工程软骨,支架材料具有关键作用,也是目前限制组织工程软骨临床转化的关键难点[6-8]。软骨组织工程支架材料主要包括天然生物材料、人工合成高分子材料和复合材料等三大类。理想的支架材料应具有以下特点:来源广泛,易于获取,成本低廉,良好的生物相容性,适宜的孔隙率,一定的力学强度,利于种子细胞黏附和生长等。常用的合成材料主要包括聚乳酸、聚羟基乙酸等。但是这些合成材料生物相容性差,且降解产物为酸性,易引起免疫排斥反应,无法真正用于临床。天然生物材料具有良好的生物相容性,免疫原性低且降解产物不会引起排斥反应,与正常组织细胞外基质结构成分相似,并且来源广泛,具有非常良好的应用前景。
以蛋白质为主的生物支架材料具有无细胞毒性、生物相容性好、易于降解等特点,被广泛应用于组织工程领域。蛋清中含有多种类型的蛋白质。蛋清支架与传统支架相比其优势在于[9-10]:①生物相容性好,不会引起强烈的免疫排斥反应;②易吸收降解;③蛋清中含有卵铁传递蛋白和溶菌酶,有很强的抗菌性,可抑制细菌生长,且卵清蛋白和卵类黏蛋白具有刺激肌母细胞增殖和促进肌管生长的作用[11-13];④来源广,价格低,制备工艺简单易行。因此,本研究将鸡蛋清这种价格低廉、来源广泛、生物相容性良好、易于人体降解的材料制备成组织工程软骨支架。
良好的支架材料需满足以下要求[14-15]:①有良好的生物相容性,无细胞毒性,无致畸性;②有多孔的三维立体结构,且孔径大小须符合细胞生长要求,为细胞黏附、生长、营养成分的渗入以及代谢产物的排出提供有利条件;③生物可降解性,且降解形成的产物也不具备细胞毒性;④具有可塑性和一定的机械强度。为了满足以上要求,我们通过探索蛋清与去离子水的比例来调整支架的孔径大小与力学强度,使其符合软骨的生长条件。研究发现,组织工程软骨构建的适宜孔径大小应该在50~300 μm[16]。随着去离子水比例的增加,孔径随之增加。定量分析显示,体积比为1:0、1:1 和1:2 的蛋清材料孔径大小分别为(79.2±10.9)μm、(177.6±17.5)μm 和(282.8±19.7)μm。因此,基于蛋清制备的支架材料孔径完全符合软骨组织工程的要求。另外,随着去离子水比例的增加,蛋清支架的力学强度随之下降。今后需要根据不同软骨构建模型摸索出适宜的蛋清与去离子水的混合比例,以平衡孔径大小与力学强度的需求。
理想的软骨组织工程支架材料需要满足的另一个条件是具有良好的细胞相容性。蛋清是一种天然材料,重要成分为蛋白质,已被证实适合多种细胞的黏附及生长[17-18]。我们在制备蛋清支架材料的过程中,仅加入了去离子水,对其细胞相容性没有任何影响。通过体外培养后,活死细胞染色与细胞增殖实验结果也证实,软骨细胞均能在三种比例的蛋清材料上黏附、增殖和生长。随着去离子水比例的增加,蛋清材料的孔径也在增加,所接种的软骨细胞数量也有所增加。
本研究中最核心的问题在于以蛋清材料为支架,是否能真正构建新的组织工程软骨。我们将软骨细胞与蛋清支架复合物体外培养时间延长到3 周,HE 染色显示,三种蛋清支架均有稚嫩的新生软骨基质成分形成。我们还发现,随着去离子水比例的增加,残余的材料量越来越少,而新生的软骨基质成分越来越多。可以猜测,随着培养时间的延长,新生的软骨基质成分会进一步成熟至出现典型的软骨陷窝成分,并且残余材料也会随着降解而越来越少。
综上所述,通过调节鸡蛋清与去离子水的混合比,可以制备出具有适宜孔隙大小及一定力学强度的多孔支架。蛋清支架具有良好的细胞相容性,延长体外培养时间可以构建出新生的软骨组织。鸡蛋清有潜力成为一种理想的组织工程软骨支架材料。今后,我们将进行蛋清支架的体内软骨构建,进一步观察蛋清支架的体内长期转化情况,为软骨组织工程提供一种新型的支架材料。

