鱼胶原构建组织工程软骨的可行性研究
赵少华 王一公 徐勇 段亮
由于体内软骨再生能力有限,创伤、肿瘤等引起的各种软骨缺损治疗(如耳、气管、关节软骨等)在临床上仍是一大挑战,组织工程技术的发展为软骨缺损修复带来了希望。支架材料作为组织工程的重要组成部分,应具有细胞毒性小、生物相容性好、来源广泛等特点。软骨细胞外基质来源支架的基质成分和比例与天然软骨更为接近,但人源性软骨细胞外基质来源有限,且其致密的结构导致脱细胞和种细胞难度较大,因此限制了其研究与发展。
胶原是生物机体中最主要的结构蛋白之一。天然胶原作为细胞外基质的主要成分,为细胞的附着、迁移和增殖提供了必需的生物环境。同时,胶原蛋白又具有低抗原性和创伤修复的优点,有利于机体的恢复。胶原蛋白还具有良好的生物相容性和组织亲和性,几乎不会引起机体的炎症或排斥反应。近年来,天然胶原在生物医学材料和组织工程材料领域中的应用日趋广泛,如胶原海绵在烧(烫)伤创面覆盖、手术空腔填充和快速止血中的应用;重组胶原纤维材料在人造跟腱/肌腱中的应用;胶原凝胶在面部皮肤美容中的应用等[1-4]。但是,由于受人畜共患疾病的影响,传统的牛、羊来源的天然胶原的生物安全性受到质疑,提取相对容易、生物安全性更好的鱼源胶原正受到关注,围绕鱼源胶原蛋白的提取、性能分析等研究已得到广泛开展,为鱼源胶原在生物医学材料领域的应用提供了良好基础[5-7]。
本研究采用冻干法制备多孔海绵状鱼胶原支架材料,并且复合软骨细胞于体外培养2 周、4 周,以观察鱼胶原支架的细胞相容性及体外软骨构建情况。随后将该软骨细胞-鱼胶原复合物植入裸鼠皮下培养6 周,以探索鱼胶原支架构建组织工程软骨的可行性。
1 材料与方法
1.1 实验试剂及仪器
胰蛋白酶、低糖DMEM 培养基、高糖DMEM 培养基、胎牛血清、青霉素-链霉素-两性霉素B、磷酸盐缓冲液(Hyclone 公司,美国),DNA 含量检测试剂盒(天根生化科技有限公司),GAG 阿尔新蓝法检测试剂盒(生工生物工程股份有限公司);总胶原蛋白检测试剂盒(北京博蕾德生物科技有限公司)。生物力学分析仪(Instron 公司,美国)。
1.2 鱼胶原蛋白的制备
将海鲈鱼加工副产物(鱼头、鱼皮和鱼骨)洗净,绞肉机绞碎后混匀,以其质量20 倍的0.1 mol/L 的氢氧化钠溶液浸泡24 h,以去除杂蛋白;用蒸馏水洗至中性,再用其质量20 倍的0.6 mol/L 的盐酸浸泡24 h 脱钙;用蒸馏水洗至中性,最后用其质量2倍的10%的乙醚浸泡24 h,反复2 次,共脱脂48 h;脱脂后,蒸馏水反复洗涤,沥干,用等量的0.5 mol/L的乙酸溶液浸泡3 d;4 400 r/min 离心20 min 后取上清,冻干即可得到胶原蛋白粗品,-20 ℃保存备用。
1.3 鱼胶原多孔支架材料的制备
将上述制备好的鱼胶原蛋白溶于0.5 M 醋酸中,制备成50 mg/mL 的胶原溶液,注入模具中,厚度为400 μm,冻干成多孔胶原海绵。胶原海绵用EDC/NHS 于4 ℃交联12 h,0.1 M Na2HPO4充分清洗,以除去残留交联剂。
1.4 鱼胶原支架的表面超微结构观察
将鱼胶原材料用2.5%戊二醛4 ℃固定24 h,PBS 缓冲液冲洗后,1%锇酸4 ℃条件下固定4 h,再用梯度乙醇脱水,CO2干燥器干燥、喷金、粘托,电镜观察鱼胶原材料的微观结构。
1.5 鱼胶原支架的组织学观察
鱼胶原支架4%多聚甲醛固定,OCT 包埋,冰冻切片机切成7~10 μm 的切片,贴在明胶包被的载玻片上,37 ℃烘干12 h。全自动染色机HE 染色后,光镜观察并拍照。
1.6 原代软骨细胞的分离培养及扩增
无菌条件下取2 月龄新西兰兔的耳软骨,用眼科剪将软骨块剪至极小块之后加入Ⅱ型胶原酶,吸管充分吹打混匀后,置于37 ℃、5%CO2、饱和湿度培养箱中消化8 h;加入8 mL 的H-DMEM 培养液(含10% FBS,下同)终止消化,充分吹打混匀后收集至15 mL 的离心管中,1 800 r/min 离心5 min,弃上清,加入7 mL 培养液,充分吹打混匀,取混悬液分至培养瓶中,培养箱培养。24 h 后首次换液,此后隔日换液。显微镜下观察细胞生长情况,当细胞生长面积达到70%~80%后,用胰蛋白酶消化细胞,传代。取第2代细胞备用。
1.7 活死细胞染色
将经环氧乙烷消毒的鱼胶原支架放入24 孔板中,加入6 μL 浓度1.0×106cells/mL 的软骨细胞悬液,置于5%CO2、37 ℃培养箱,4 h 后小心加入含10%FBS 的高糖DMEM 培养液至覆盖复合物后继续培养。分别于第1、4、7 天,进行活死细胞染色。相同的软骨细胞悬液接种于培养皿,在同样的培养环境中作为对照组。活死细胞染色试剂盒使用步骤:先根据说明书配置活死细胞染色检测工作液;吸去样品中培养基后加入200 μL 的Live/Dead 检测工作液,室温避光孵育15 min;吸去染液后用无菌PBS清洗3 遍,加入1 mL 的PBS 溶液,荧光显微镜下观察拍照。
1.8 细胞增殖率检测
将上述复合物分别于第1、4、7 天,向每孔中加入10 μL 的CCK-8 溶液,继续孵育。4 h 后将24 孔板里的溶液轻轻吸除,移到96 孔板中,多功能酶标仪检测450 nm 处的吸光度。
1.9 软骨细胞-鱼胶原复合物体外软骨构建
将软骨细胞制备成100×106cells/mL 的细胞混悬液,均匀接种于鱼胶原支架上,于37 ℃、5%CO2、饱和湿度下放置4 h 后缓缓加入含10%FBS 的高糖DMEM 培养液至覆盖复合物后继续培养。分别于2周和4 周后进行大体观察和组织学检测。
1.10 软骨细胞-鱼胶原复合物体内软骨构建
将上述体外培养1 周后的软骨细胞-鱼胶原复合物植入5 只裸鼠背部腔隙中,缝合后分笼饲养,自由活动。于术后6 周取材行大体观察和组织学检测。
1.11 组织学检测
体外培养2 周、4 周和体内培养6 周后的标本,大体观察后将标本以4%多聚甲醛固定24 h,脱水、石蜡包埋,切片(厚度为5 μm),HE 及Safranin-O 染色,观察组织结构及细胞外基质分泌情况。免疫组化检测Ⅱ型胶原的表达情况[8]。
1.12 生物力学与生物化学检测
1.12.1 生物力学检测
取体内构建的样本修剪成直径0.8 cm 的圆形小块置于生物力学测试仪上,以1 mm/min 的速度垂直压缩,直到样本组织变形,记录杨氏模量。
1.12.2 生物化学检测
将样品置于木瓜蛋白酶溶液中65 ℃消化12 h。根据试剂盒方法,用阿尔新蓝法检测GAG 含量[9]。在乙醇提取和吸附柱吸附后,于洗脱缓冲液中回收基因组DNA。用核酸蛋白质定量检测器(Nanodrop2000)检测DNA 含量。用羟脯氨酸测定法检测总胶原含量。通过碱水解制备样品,按上述方法测定游离羟脯氨酸水解产物[10]。所有样品重复3 次。
1.13 统计学分析
以GraphPad Prism(Version 5.00,GraphPad Software,美国)行统计分析,数据以()表示,组间比较采用非配对t 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 鱼胶原支架的大体、扫描电镜及组织学观察
鱼胶原冻干后呈白色多孔状结构,扫描电镜超微结构进一步证明胶原纤维交替排列形成较为均匀的多孔状结构,孔隙直径在100~200 μm。HE 染色显示,经EDC/NHS 交联后的胶原蛋白纤维交错成网,胶原支架呈多孔网状结构。胶原支架内部孔隙较多且孔隙较为均匀(图1)。

图1 鱼胶原支架大体、扫描电镜及组织学观察Fig.1 Gross morphology,SEM and histological observation of fish collagen
2.2 活死细胞染色与细胞增殖率检测
活死细胞染色结果显示,接种软骨细胞后1~7 d,软骨细胞在鱼胶原支架中能很好地增殖。CCK-8 检测结果也进一步证实了以上结论,并且和对照组(纯培养液)无显著差别,进一步说明鱼胶原具有良好的细胞相容性(图2)。
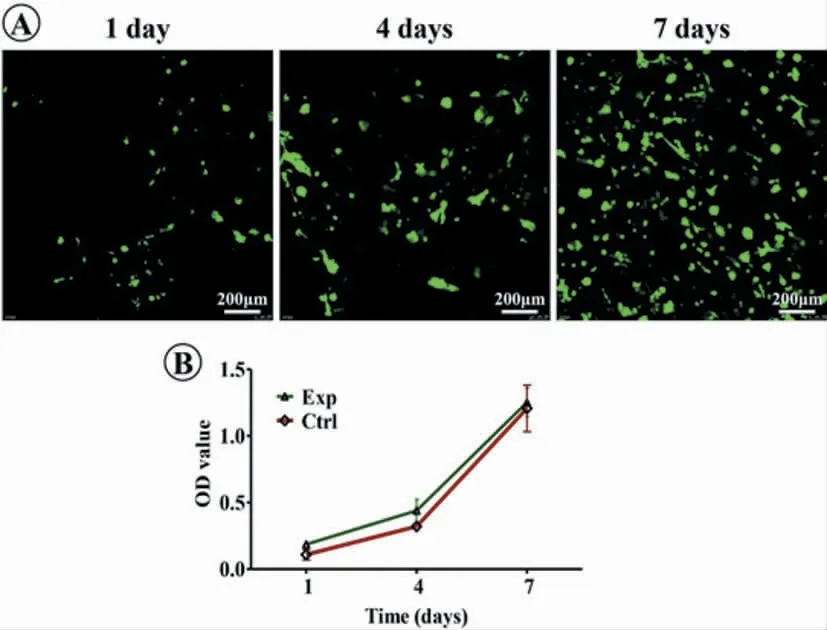
图2 活死细胞染色与细胞增殖率检测Fig.2 Living&dead cell staining and cell proliferation assay
2.3 软骨细胞-鱼胶原支架复合物体外培养
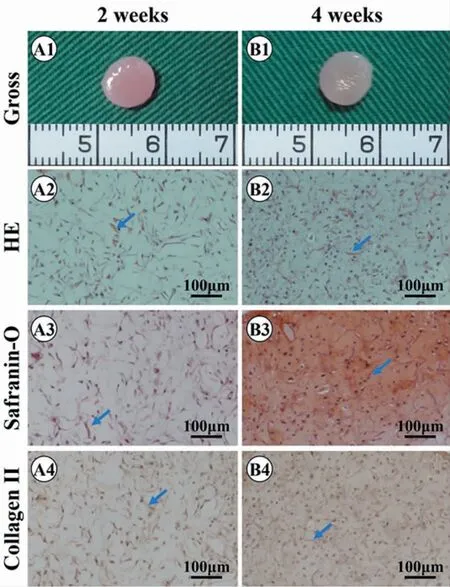
图3 体外培养2 周、4 周的软骨构建情况Fig.3 Cartilage regeneration in vitro for 2 and 4 weeks
如图3 所示,软骨细胞-鱼胶原复合物体外培养2 周、4 周,支架表面形成明显的软骨组织特征。相比于2 周,4 周时复合物大体观变得更白,表明软骨变得更加成熟。组织学观察显示,体外培养2 周,已有较多的软骨细胞外基质形成,Ⅱ型胶原免疫组化进一步证明了所构建的组织为均匀的软骨组织;体外培养4 周,软骨基质进一步成熟,特征性软骨陷窝已初步形成,体外再生软骨质量进一步提高。4 周时,鱼胶原支架材料尚未降解完全。
2.4 软骨细胞-鱼胶原支架复合物体内培养
裸鼠皮下培养6 周后,软骨细胞-鱼胶原复合物形成瓷白色软骨样结构,微孔结构基本上被新生软骨组织填充,鱼胶原支架材料基本降解,且构建的软骨样组织具有较好的弹性和韧性。组织学显示,大量软骨细胞外基质和软骨陷窝形成,Ⅱ型胶原免疫组化证实新生组织为均匀的软骨组织(图4)。
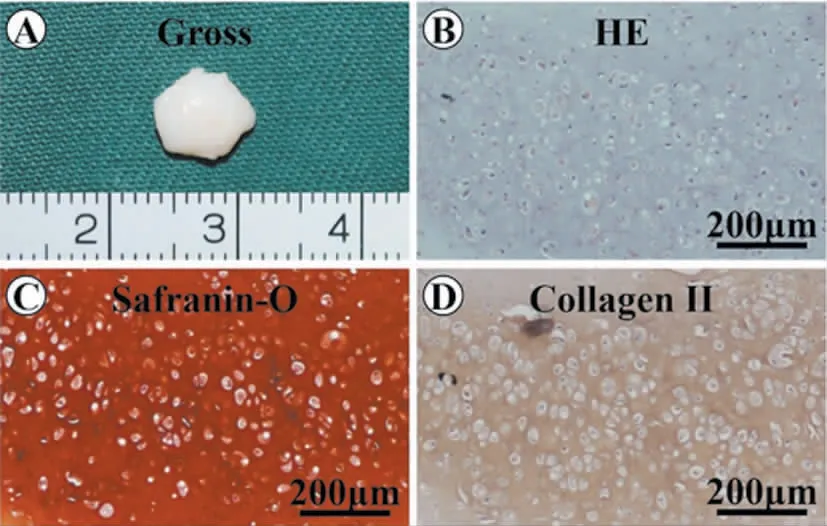
图4 体内培养6 周的新生软骨大体及组织学观察Fig.4 Gross view and histological observation of neocartilage after 6 weeks' culture in vivo
新生软骨力学强度近似天然软骨。其DNA 含量、GAG 含量和总胶原含量等亦均接近天然软骨(P<0.05)(图5)。
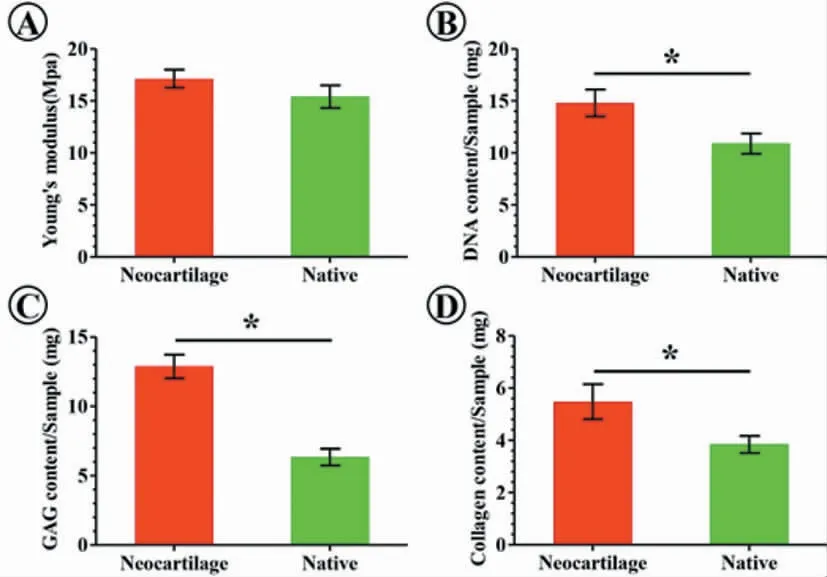
图5 新生软骨生物力学和生物化学检测(*:P<0.05)Fig.5 Biomechanical and biochemistry analyses of neocartilage (*:P<0.05)
3 讨论
软骨组织工程为临床治疗软骨缺损提供了新的思路[11-12]。支架材料是组织工程的三要素之一,是种子细胞代谢活动的场所和连接细胞与组织的桥梁,在软骨组织工程中具有重要的作用。理想的软骨组织工程支架需满足以下要求:①生物相容性好、免疫原性低;②合适的孔径大小和孔隙率;③一定的力学强度,可维持细胞的三维生长;④降解速率适中,适配软骨再生的速率;⑤可模拟软骨微环境,促进体内、外构建软骨。
海洋生物是提供新的具有生物活性的胶原蛋白及其水解物的潜在来源。近年来,海洋胶原蛋白越来越受到关注,广泛应用于功能性食品、化妆品、生物医学等领域[13]。在鱼类产品生产中自然产生的副产品——鱼皮、鱼鳞、鱼骨等,约占总产量的30%~50%,大部分被废弃,仅小部分作为原料加工成饲料。我国水产品加工尤其是淡水产品加工在取得快速发展的同时,产生了大量的废弃物,这些废弃物一方面造成了环境的污染,另一方面造成了资源的浪费。因此,将鱼胶原加工成支架材料,充分利用其剩余价值,意义重大。水解鱼胶原可促进MC3T3-E1细胞胶原合成和矿化等生物活性[14],与几丁糖复合的纳米纤维膜可促进人皮肤成纤维细胞的增殖[15],证明了鱼胶原具有作为组织工程支架材料的潜能。
本研究通过冻干技术成功制备出了具有三维多孔结构的海绵状鱼胶原支架,初步具备构建组织工程软骨的可行性。软骨细胞-鱼胶原支架复合物体外培养2 周、4 周,活死细胞染色及细胞毒性试验均证明鱼胶原具有良好的细胞相容性,且能在体外环境诱导软骨基质分泌。将软骨细胞-鱼胶原支架复合物植入裸鼠皮下,6 周后形成了瓷白色的典型软骨样组织。组织学显示该组织具有典型的软骨陷窝样结构,免疫组织染色证明其为Ⅱ胶原软骨基质成分。同时,软骨特异性基质定量及生物力学检测结果均显示,裸鼠皮下再生软骨组织接近天然软骨。这可能得益于:①冻干后形成的微孔结构,既有利于营养的渗入、代谢废物的排出、氧气的交换,又促进了软骨细胞在整个支架内的分布,促进了相对均质的软骨再生;②皮下环境丰富的毛细血管系统可为植入组织提供物质交换的动力;③鱼胶原中所含的天然胶原成分,为软骨再生提供了理想的微环境。
综上所述,鱼胶原制备成多孔海绵状支架材料后具有良好的细胞相容性,且能在体外促进软骨基质的分泌,也能在体内环境稳定再生软骨。下一步我们将基于该鱼胶原支架对膝关节软骨缺损进行修复,以期实现其功能性修复。

