体外三维血管生成模型的建立及肿瘤细胞分泌的MCP-1/VEGF对该模型的影响*
胡 敏, 韩要武, 李 璐, 马克龙, 吕 磊, 张道芹, 杨建澳, 汪思应
(1安徽中医药大学, 安徽 合肥 230012; 2安徽医科大学, 安徽 合肥 230032)
恶性肿瘤已成为严重危害人类生命健康第1位的疾病。最新统计数据显示,2018 年全球新增肿瘤病例1 800多万,肿瘤死亡病例900多万,其中全球 48.4%的发病病例和57.3% 的死亡病例来自亚洲[1]。恶性肿瘤的侵袭与转移是肿瘤患者的主要致死因素。因此针对恶性肿瘤浸润、转移及其机制的探索具有重要意义。肿瘤的生长、浸润和转移依赖于新生血管的形成。
自1971年Folkman[2]提出如果没有支持肿瘤生长的血管生成,实体瘤不能超过1~2 mm3的假设至今,已有40多年的研究结果证实,肿瘤血管生成在大多数实体肿瘤的生长和恶性进展中起重要作用[3-4],是肿瘤生长和转移的核心[2],因此抑制血管生成被认为是阻止肿瘤生长和转移的策略之一[5]。而建立简单、稳定、可靠的血管生成模型为研究肿瘤的发生发展及血管生成提供了基础。本项工作首先利用人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)及小鼠内皮细胞SVEC4-10EE2在体外建立三维血管生成模型,在此基础上加入肿瘤细胞(MDA-MB-231和E0771)与之共培养,观察肿瘤细胞对血管生成的影响,并探究其可能的机制。
材 料 和 方 法
1 主要试剂
Cytodex3磁珠购自Amersham Pharmacia;乙醇、纤维蛋白原、抑肽酶、凝血酶和SU5416购自Sigma;DMEM培养液、胰酶和小牛血清购自Gibco;链霉素、青霉素和两性霉素B购自HyClone;EGM-2培养液购自Lonza;单核细胞趋化蛋白1(monocyte chemoattractant protein-1, MCP-1)及MCP-1受体C-C趋化因子受体2(C-C chemokine receptor 2,CCR2)拮抗剂购自Calbiochem;血管内皮生长因子(vascular endothelial growth factor,VEGF)和MCP-1酶联免疫检测试剂盒购于北京华迈科生物技术有限公司。
2 主要方法
2.1细胞培养 HUVECs购自美国模式培养物集存库(American type culture collection,ATCC),从新鲜人胎盘中分离,并在EGM-2培养液中生长培养,使用第4代细胞用于实验;小鼠血管内皮细胞SVEC4-10EE2和人乳腺癌细胞MDA-MB-231在含有10%胎牛血清(fetal bovine serum,FBS)、1×105U/L青霉素和100 mg/L链霉素的DMEM培养液中常规培养; 小鼠乳腺癌细胞E0771细胞在含有10%FBS、青霉素(1×105U/L)/链霉素(100 mg/L)和两性霉素B(0.25 g/L)的DMEM培养液中进行培养。
2.2体外三维血管生成模型的建立 按照参考文献进行模型的建立[6]。分别将正常培养生长的内皮细胞HUVECs和SVEC4-10EE2用胰蛋白酶消化后,取1×106个细胞与4 mL含有cytodex3磁珠(3×103)的培养液后在50 mL离心管中混合。将混合液在5%CO2、37 ℃条件下温育培养,每20 min轻轻摇动1次。培养4 h后再加入4 mL相应培养液,使细胞具有足够的营养,并继续培养4 h。然后将含有细胞和cytodex3磁珠的混合液转移至25 mL细胞培养瓶中孵育过夜。第2天,将培养瓶中的混合液转移至50 mL离心管中,并用20 mL不含Ca2+和Mg2+的PBS轻轻洗涤3遍,然后将包被有内皮细胞HUVECs或SVEC4-10EE2的cytodex3磁珠重悬于pH 7.4、含有2.5 g/L纤维蛋白原和150 U/L抗胰蛋白酶的培养液中。接下来把包被有内皮细胞的cytodex3磁珠和纤维蛋白原混合溶液加入预先用0.625 U新鲜凝血酶包被的24孔板中,每孔0.5 mL,使纤维蛋白原/磁珠溶液在室温下凝结5 min,然后在37 ℃和5%CO2环境中凝结20 min。向每个孔中加入1 mL含有150 U/L抗胰蛋白酶的培养液,在37 ℃培养箱中平衡30 min。用移液器将24孔板内上层培养液轻轻吸掉,用含有150 U/L抗胰蛋白酶的1 mL新鲜培养液替换。
2.3体外内皮细胞-肿瘤细胞三维共培养系统 为了观察肿瘤细胞对血管生成的影响,在体外三维血管生成模型基础上,将人乳腺癌细胞MDA-MB-231和小鼠乳腺癌细胞E0771在体外与之共培养。方法同2.2,只是最后一步,在加入抗胰蛋白酶平衡的30 min等待时间内,准备肿瘤细胞,消化、计数、调整细胞浓度。移液器将24孔板内上层培养液轻轻吸掉后,用1 mL含有MDA-MB-231和E0771细胞(分别为4×104和2×104个)的培养液取代EGM-2和DMEM培养液,于5% CO2、37 ℃培养箱中培养。
2.4血管生成结果判断 细胞培养48 h后,用4%多聚甲醛固定, DAPI染色,在倒置显微镜下观察血管生成情况。每个培养孔随机选取3个视野进行观察,计算生成血管的磁珠占总数的百分比。实验重复3次。
2.5酶联免疫法(ELISA)检测细胞培养上清液中细胞因子含量 在内皮细胞及内皮细胞-肿瘤细胞共培养体系培养48 h后,收集细胞培养的上清,严格按照酶联免疫检测试剂盒说明书操作,检测 VEFG和MCP-1 的表达水平。
2.6VFGF及MCP-1对血管生成的影响 在内皮细胞-肿瘤细胞共培养体系中分别加入MCP-1(10 ng)、MCP-1受体CCR2的拮抗剂(20 nmol/L)以及VEGF受体的抑制剂SU5416(2 μmol/L)作用48 h,观察VEGF及MCP-1在肿瘤细胞刺激血管生成中的作用。
3 统计学处理
所有数据均使用SPSS 19.0软件进行分析处理。数据以均数±标准差(mean±SD)表示,两组数据间比较用独立t检验,多组数据比较使用单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 血管内皮细胞体外三维血管生成模型
正常培养生长的人血管内皮细胞HUVECs经cytodex3磁珠混合培养4 h后,内皮细胞可黏附于磁珠表面生长,培养过夜后内皮细胞与磁珠的附着更加紧密。将附着有内皮细胞的cytodex3磁珠悬浮于纤维蛋白凝胶中培养,48 h后可以观察到内皮细胞能够形成短而窄的3-D脉管样网络结构,见图1A,提示血管的生成。接下来用4%多聚甲醛固定并用DAPI染色,在荧光显微镜下采集图像,可以看到血管芽和毛细血管网由多细胞形成,见图1B。结果证实建立了细胞体外三维血管生成模型。在小鼠内皮细胞上也可以见到同样的改变。
2 肿瘤细胞体外促进血管生成
在加入人乳腺癌细胞MDA-MB-231与HUVECs共培养后,显著增加了血管芽的长度和数量,而且加入MDA-MB-231细胞共培养后生成血管的磁珠所占比例为68.7%,比HUVECs单独培养时的48.3%显著提高(P<0.05),见图2A。在小鼠乳腺癌细胞E0771加入SVEC4-10EE2细胞后也能观察到同样的结果(P<0.05),见图2B。
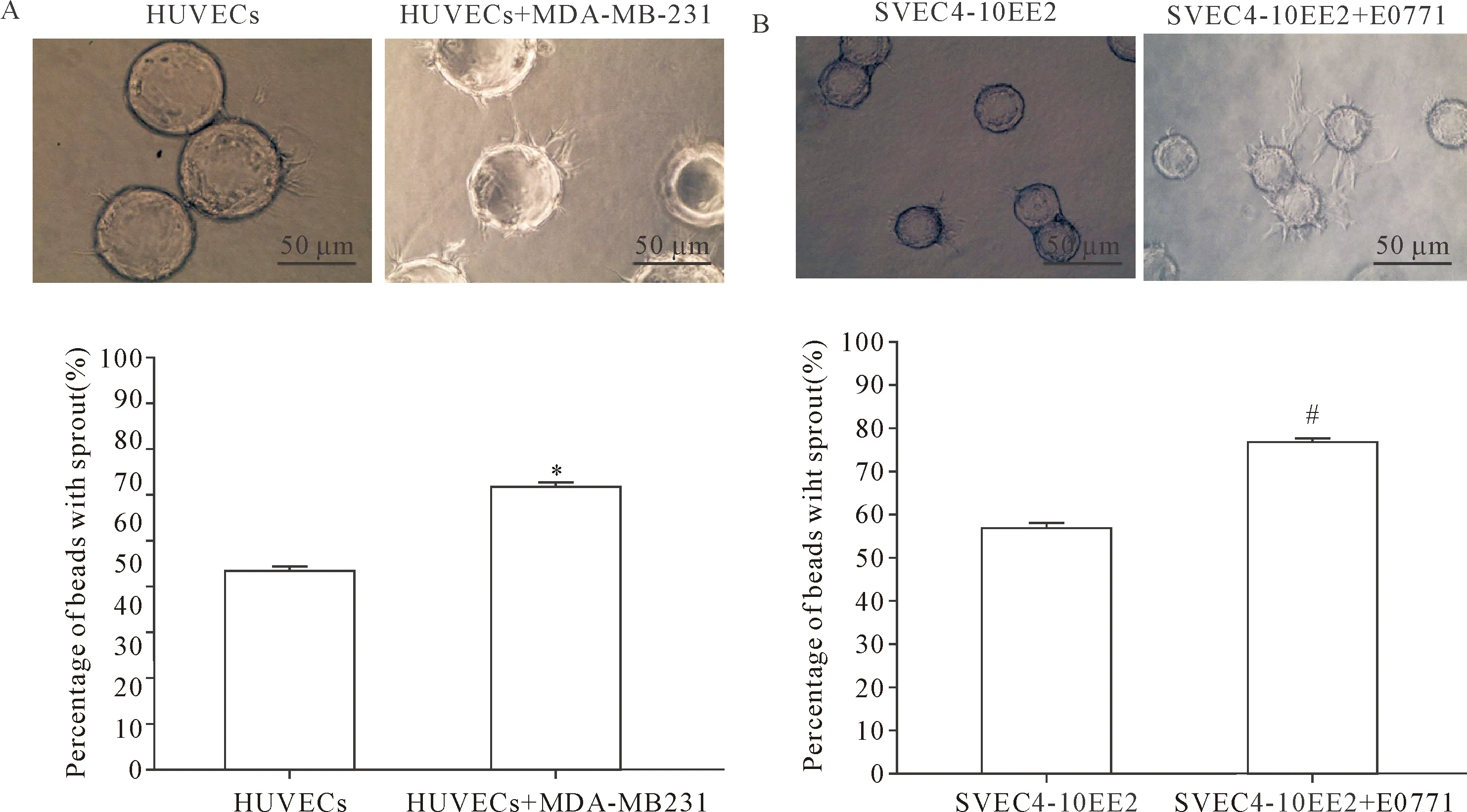
Figure 2.Tumor cells induce angiogenesis in vitro. A: The images of HUVECs with sprouts were captured at 48 h after culture. The percentage of beads with sprouts was determined (bottom panel); B: The images of SVEC4-10EE2 with sprouts were captured at 48 h after culture. The percentage of beads with sprouts was determined (bottom panel). Mean±SD. n=3. *P<0.05 vs HUVECs group; #P<0.05 vs SVEC4-10EE2 group.
3 肿瘤细胞体外促进MCP-1和VEGF分泌
在培养48 h后,分别收集有或无肿瘤细胞刺激的培养上清液,用ELISA法检测上清液中VEFG和MCP-1 的水平。结果显示,与内皮细胞单独培养相比,加入肿瘤细胞刺激之后,上清液内VEFG和MCP-1 水平显著增高(P<0.05),见图3。
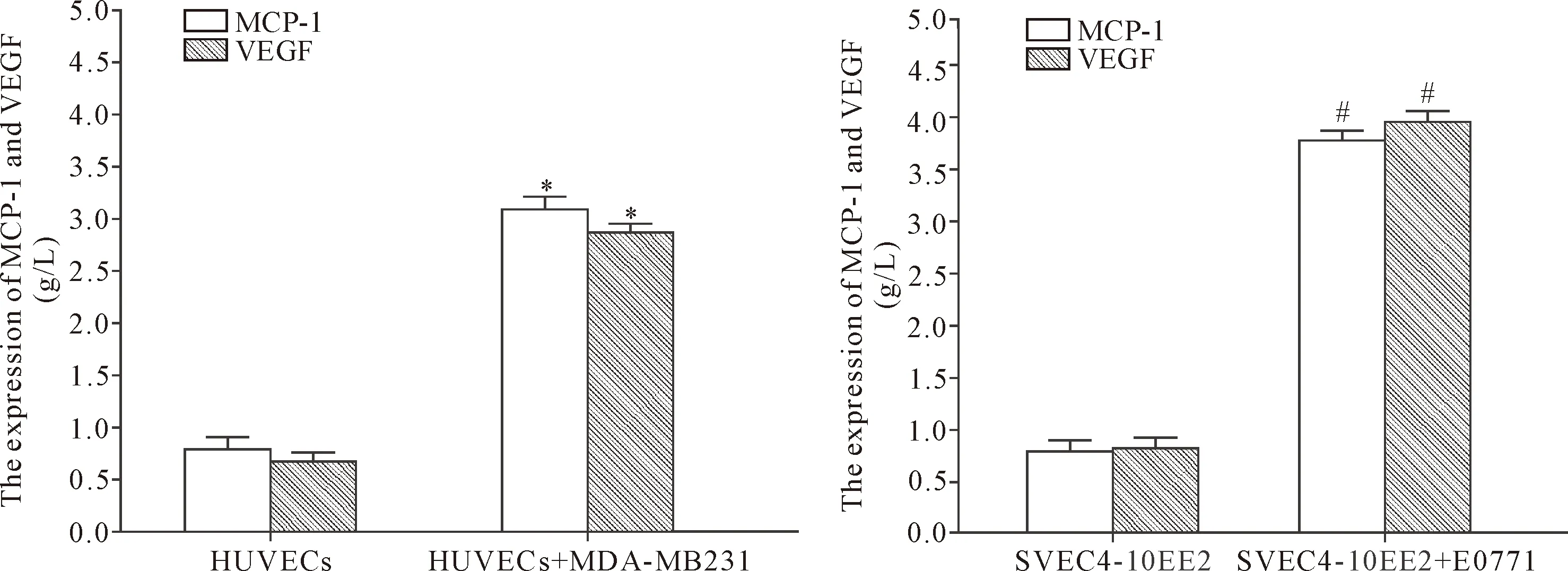
Figure 3.Tumor cells increased the expression of MCP-1 and VEGF in vitro. Mean±SD. n=3. *P<0.05 vs HUVECs group;#P<0.05 vs SVEC4-10EE2 group.
4 条件培养基(conditioned media, CM)对体外血管生成的影响
收集肿瘤细胞与内皮细胞共培养的上清液作为条件培养基(HUVEGs中加入的CM为HUVEGs与MDA-MB-231共培养的上清;SVEC4-10EE2中加入的CM为SVEC4-10EE2与E0771共培养的上清),加入到 HUVECs或SVEC4-10EE2单独培养的血管生成系统,在有或无MCP-1受体CCR2的拮抗剂以及VEGF受体抑制剂SU5416条件下观察血管生成的情况。结果显示,肿瘤细胞刺激后的条件培养上清可以促进内皮细胞血管生成,而这一作用可以被CCR2的拮抗剂以及 SU5416 所阻断(P<0.05),见图4。
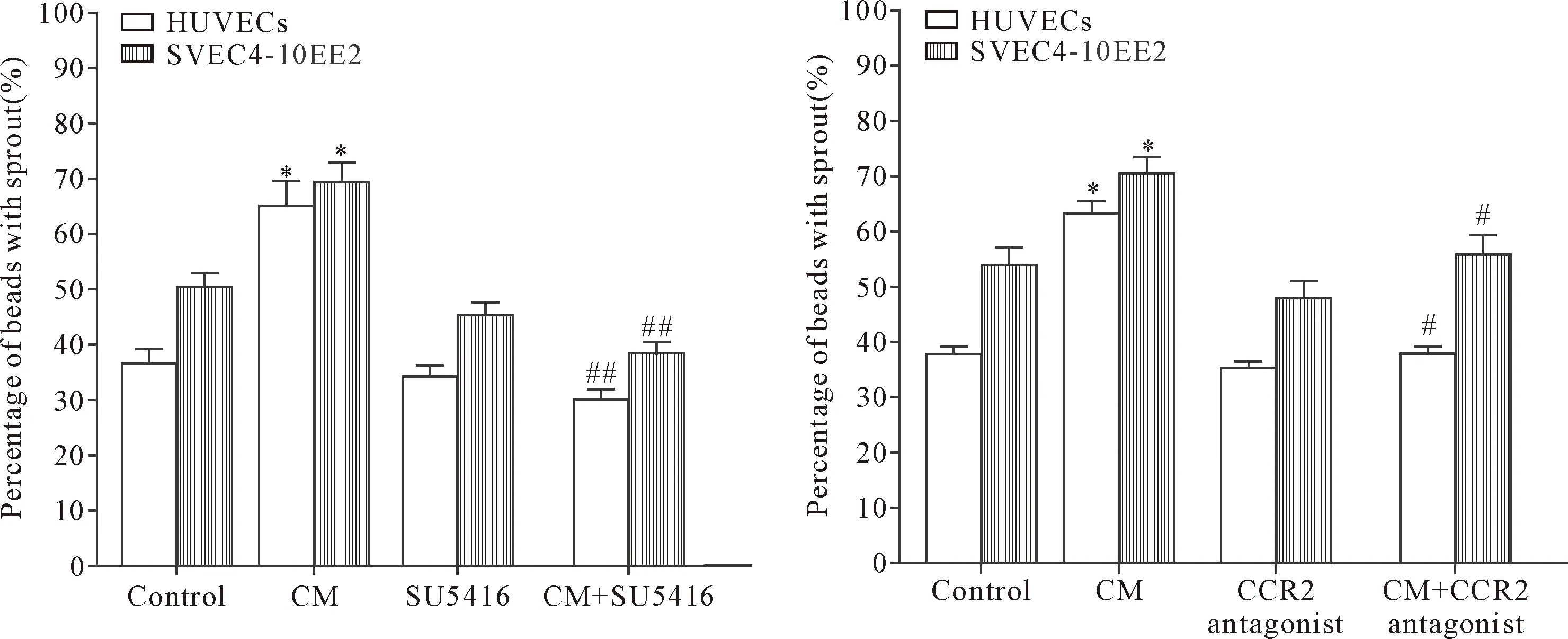
Figure 4.The effect of the conditioned medium on angiogenesis. Mean±SD. n=3. *P<0.05 vs control group; ##P<0.05 vs CM group.
5 VEGF参与肿瘤细胞体外诱导的血管生成
结果显示,加入VEGF受体抑制剂SU5416(2 μmol/L)后,肿瘤细胞MDA-MB-231及E0771诱导的血管生成受到了显著的抑制(P<0.05),见图5。

Figure 5.VEGF promoted the angiogenesis induced by cancer cells in vitro. Mean±SD. n=3. *P<0.05 vs control group; #P<0.05 vs co-culture group.
6 MCP-1参与肿瘤细胞促进的体外血管生成
外源性MCP-1可明显促进内皮细胞血管生成,而CCR2拮抗剂(20 nmol/L)可显著抑制两种肿瘤细胞(MDA-MB231或E0771)诱导的血管生成(P<0.05),见图6。

Figure 6.MCP-1 promoted the angiogenesis of HUVECs and SVEC4-100E2 cells in vitro. Mean±SD. n=3. *P<0.05 vs control group; #P<0.05 vs MCP-1 group.
讨 论
血管生成是肿瘤生长与转移的重要条件, 也是血道转移的根本保证[7]。大多数实体瘤分泌促血管生成因子,诱导血管生长,为生长中的肿瘤提供氧气和营养,支持其进展并为肿瘤转移提供通道[2,8]。在过去的几十年中,血管生成受到了非常多的关注,靶向血管生成的治疗成为控制肿瘤生长和转移的一个重要策略。建立血管生成模型可以为研究肿瘤发生及复发转移提供基础。肿瘤血管生成主要通过出芽的方式发生[9]。相对于二维血管生成模型,三维培养产生的细胞更接近于体内细胞形态学表型和基因表达谱的特征[10-11]。因此,本研究中我们根据Chen等[6]的研究报道,建立一个稳定、可重复、易操作的体外三维血管生成模型。实验中所用的Cytodex3磁珠可以有效地附着和扩散细胞,并且可以容易地对附着的细胞进行显微镜检查。纤维蛋白凝胶由亲水性交联原纤维组成,适用于3D细胞培养[12]。首先我们利用人或鼠的血管内皮细胞(HUVEC或SVEC4-10EE2)包被于Cytodex3磁珠表面,并置于纤维蛋白凝胶系统中。内皮细胞在不加入任何生长因子的条件下,在培养体系内以“出芽”的方式形成短而窄的脉管样结构。实验结果显示,我们成功建立了一个体外血管生成模型。
接下来,我们想观察肿瘤细胞对血管生成是否具有促进作用。利用成功建立的体外血管生成模型,在培养液上层纤维蛋白凝集物内分别加入乳腺癌肿瘤细胞MDA-MB-231和E0771,使之与对应的正常内皮细胞共培养,建立一个3-D内皮细胞-肿瘤细胞共培养系统,即HUVECs/MDA-MB-231和SVEC4-10EE2/E0771共培养系统。培养48 h后在倒置显微镜下观察肿瘤细胞对血管生成的作用。结果显示,加入肿瘤细胞共培养后,无论是HUVECs/MDA-MB-231还是SVEC4/E0771,形成血管芽的长度和数量显著增加,出芽率显著增高,提示肿瘤细胞在体外可以显著促进血管生成。
由于内皮细胞-肿瘤细胞共培养的3-D系统中,肿瘤细胞和内皮细胞之间并没有直接接触,加入肿瘤细胞后可以促进血管生成,我们考虑这一作用必定由来自肿瘤细胞的分泌分子介导。报道指出[13],肿瘤细胞和间质细胞分泌产生各种促血管生长因子,如VEGF、转化生长因子 β(transforming growth factor-β,TGF-β)、MCP-1、血管生成素(angiopoietin,Ang)和缺氧诱导因子(hypoxia-inducible factor,HIF)等,它们通过与相应的受体结合激活下游信号通路,调节肿瘤新生血管生成。VEGF是一种分泌蛋白,是生理和病理性的血管形成中最重要的因子之一,已经证实它在肿瘤的发生、发展和转移中均起到重要作用[14]。在肿瘤微环境中,VEGF有多种来源,包括肿瘤细胞、炎症介质、血小板和血管细胞[15], 通过内皮细胞上两种高亲和力受体酪氨酸激酶VEGFR1(Flt-1)和VEGFR2 / KDR(Flk-1)对肿瘤血管生成的多个方面进行调节。MCP-1是促使单核细胞和巨噬细胞到达炎症区的化学引诱物,参与多种炎症性疾病发生发展[16],是肿瘤的生长、进展和转移过程中的关键调节因子[17];同时MCP-1也是一种有效的血管生成趋化因子。为了探讨肿瘤细胞刺激血管生成的机制,在本研究中,我们分别收集了有或无肿瘤细胞刺激的培养上清,用ELISA法检测上清液中VEFG和MCP-1的水平,结果在加入肿瘤细胞共培养后,VEGF和MCP-1的水平与内皮细胞单独培养相比显著增加,即肿瘤细胞刺激后上清液内MCP-1以及VEGF水平增高。收集肿瘤细胞刺激后的上清液作为条件培养基, 加入到 HUVECs或SVEC4-10EE2 单独培养的血管生成系统,结果显示CM可以促进内皮细胞生成血管,而这一作用可以被CCR2的拮抗剂以及 SU5416 所阻断。随后在3-D共培养体系下层培养内皮细胞的纤维蛋白凝胶中加入MCP-1、VEGF受体抑制剂SU5416及MCP-1受体CCR2抑制剂。结果显示,加入外源性MCP-1后,可显著促进共轭体系中血管生成;而在加入SU5416及CCR2抑制剂后,HUVECs/MDA-MB-231和SVEC4-10EE2/E0771诱导的血管生成受到了显著的抑制,证据支持VEGF和MCP-1参与了体外肿瘤细胞诱导的新生血管生成的过程。
本研究首先建立了一个体外3-D血管生成系统,可以直观的观察肿瘤血管生成的情况,为靶向血管治疗提供了一个良好的基础。在此基础上,肿瘤细胞可以刺激血管生成,初步证实这一现象与肿瘤分泌物MCP-1及VEGF相关。

