新生儿心脏术后早期喂养达标对住院期间预后的影响
陈秀玲,张崇健,吴 岚
(广东省人民医院 广东省医学科学院,广东 广州 510080)
先天性心脏病是导致新生儿和婴幼儿死亡的主要原因。新生儿先天性心脏病的病情特点是病情危重、解剖复杂,常需紧急手术抢救。随着小儿心脏外科手术及围手术期治疗水平的提高,新生儿先天性心脏病外科治疗病死率总体呈下降趋势,但其手术后容易出现各种严重并发症,如医院感染、急性肾功能不全、肺高压危象、低心排血量综合征等[1]。先天性心脏病患儿术前营养不良发生率高,尤其是合并心功能衰竭和肺动脉高压的患儿,影响其临床预后及生长发育[2]。体外循环术后胃肠道缺血再灌注损伤、血流动力学波动、术后的高分解代谢及术后早期严格的液体管理导致了术后营养支持困难。随着重症医学领域早期肠内营养支持理念的不断深入[3-4],本院开展了新生儿心脏术后早期肠内营养支持,制订了规范化营养支持方案。本研究分析新生儿行体外循环双心室矫治术后的喂养情况及早期喂养达标对住院期间预后的影响。现报道如下。
1 对象与方法
1.1 对象 采用回顾性分析法,选择2010年1月—2012年4月收治于广东省人民医院心脏外科行先天性心脏手术的患儿42例。纳入标准:行体外循环手术;手术日龄≤28 d;根治性手术。排除标准:术前禁食,患有影响经口喂养的先天性消化道畸形或遗传代谢疾病;单心室方向的姑息手术;术后延迟关胸;术中行体外膜肺氧合。
1.2 方法 研究人员收集如患儿身高、体质量、性别、出生孕周、手术日龄等人口学资料,及术前术后的血液检验资料、手术时间、体外循环时间、主动脉阻断时间、术中输血量、术后的血管活性药物、液体出入量、术后开始喂养的时间、每日喂养量、术后感染的病原学、术后的呼吸机辅助时间、重症监护时间、住院时间等、血管活性药物评分 (得分=多巴胺×1+多巴酚丁胺×1+米力农×10+肾上腺素×100+异丙肾上腺素×100)。
1.3 喂养达标的定义 中国新生儿营养支持临床应用指南推荐, 新生儿每日能量供给在 440~545 kJ/(kg·d);美国肠外肠内营养学会指南推荐,入住儿童监护室第1周后实现三分之二的处方能量供给[5-6]。根据上述指南计算得出,新生儿每日喂养达标量应该在105~130 mL/kg,根据既往研究的达标喂养量,设定本研究患儿的达标喂养量为 120 mL/kg/d[7]。
1.4 术后喂养流程 科室制订的新生儿心脏术后喂养流程,见图1。判断患儿循环稳定、无喂养禁忌后启动喂养;对新生儿吞咽反射、胃液和肠鸣音等情况进行评估后制订喂养计划;首次喂养按2 mL/kg,每3小时喂养1次,每次加奶量1 mL/kg,观察记录大便次数和性状、进奶量、胃潴留量;根据患儿胃潴留量及其他情况及时调整喂养量,或予以减量喂养、暂停喂养、禁食等处理。
1.5 术后喂养护理 鼻饲配方奶粉必须新鲜配制,温度在38℃左右(滳于手背感觉温度适宜),采用10 mL注射器缓慢注入,注入前先用注射器轻轻回抽胃内容物,观察每次回抽胃内容物的性质及量,再决定喂养量。每次注入食物后要再注入5 mL温水,避免胃管堵塞或食物残留在胃管内。若发现腹部膨胀、腹肌紧张,则说明有肠胀气或消化不良的情况,给予肛管排气、按摩腹部或延迟喂养。如患儿腹胀明显或鼻饲后1 h进行吸痰等刺激性操作时应开放胃管,制作胃肠减压引流袋行胃肠减压。开启喂养后,密切观察患儿的消化情况及大便次数、性质,患儿出现腹泻应及时报告医师,遵医嘱减量或暂停喂养。
1.6 统计学方法 采用SPSS 21.0软件进行统计分析。呈正态分布的计量资料数据以均数±标准差描述;计量资料数据不服从正态分布时,数据以中位数(四分位数间距)表示。计量资料组间比较应用 t检验和χ2检验。两组数值变量资料的比较采用非参数检验(Kruskal-Wallis检验)。应用Kaplan-Meier方法绘制生存曲线,组间比较采用 Log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 42例患儿中,男33例、女9例,手术日龄中位数21 d,平均体质量3.36 kg,平均身高51.03 cm,急诊手术4例,简单先心手术3例、复杂先心手术39例,手术时间中位数2.5 h,体外循环时间中位数78 min,主动脉阻断时间中位数46.5 min,术后启动喂养的时机距离手术结束中位数61.83 h,撤呼吸机前启动喂养21例。以术后7 d内每日最大喂养量超过120 mL/kg定义为喂养达标,将42例新生儿分为喂养达标组31例(≥120 mL/kg)和喂养不达标组11例(<120 mL/kg)。患儿手术类型,见表1。
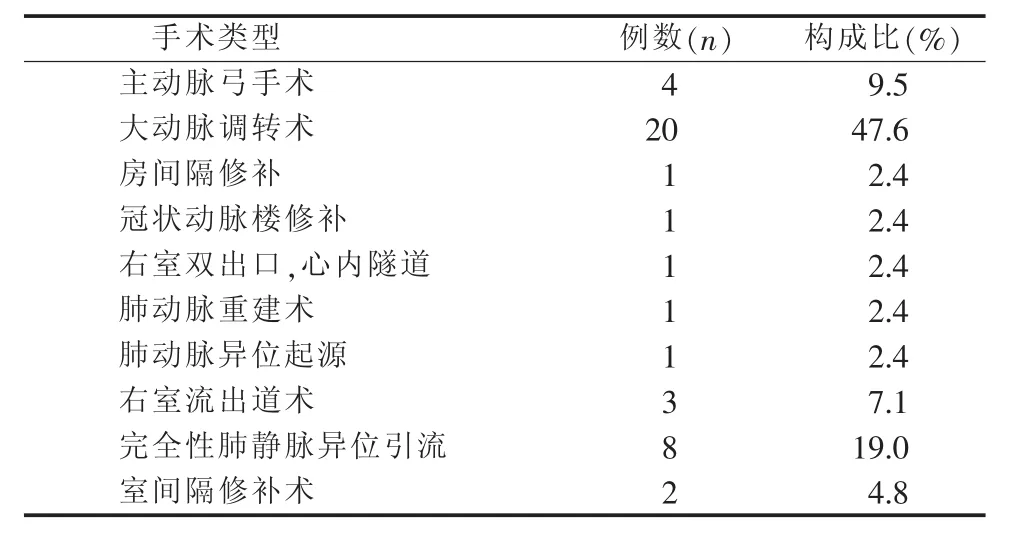
表1 患儿手术类型
2.2 患儿手术当天及术后喂养量 见表2。
2.3 患儿喂养启动时机 见表3。
2.4 患儿临床因素比较 见表4。
2.5 患儿预后及生存分析 不达标组患儿发生医院感染7例 (63.6%),达标组患儿发生医院感染8例(25.8%),其中,不达标组发生术后血源性感染2例,而达标组未发生。术后肺炎、术后切口感染的发生率,不达标组的绝对数值却更高。术后呼吸机辅助时间不达标组较达标组更长(118 h VS 71 h)。Kaplan-Meier生存分析显示:术后滞留ICU的时间不达标组(322.33 h)较达标组(225.68 h)更长(Log Rank=10.124,P=0.001),见图2。术后住院时间不达标组(19.64 d)较达标组更长(15.03 d)更长(Log Rank=6.027,P=0.014),见图 3。
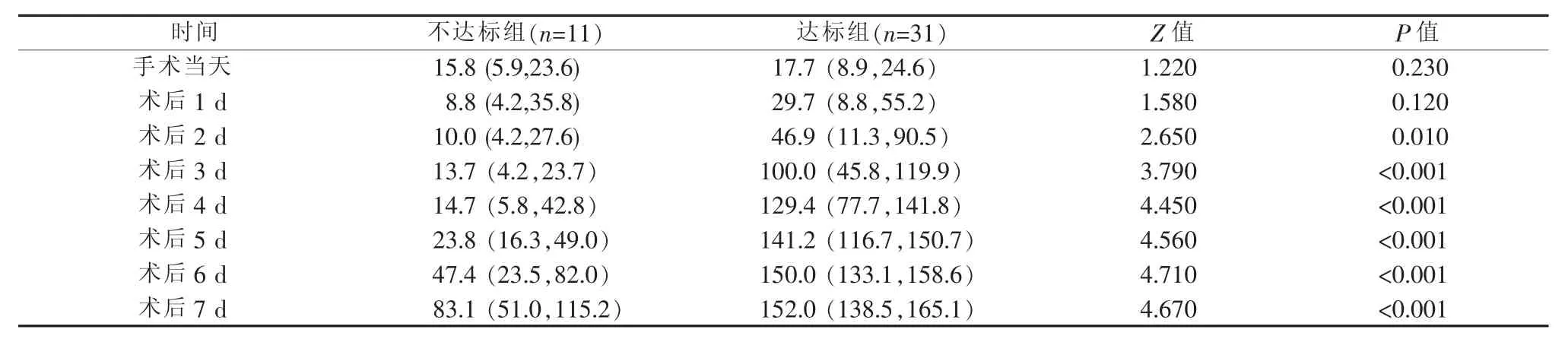
表2 患儿手术当天及术后喂养量 [mL/kg,M(P25,P75)]

表3 患儿喂养启动时机 [n(%)]

表4 患儿临床因素比较 [n(%)]
3 讨论
3.1 达标喂养能改善心脏术后患儿的短期预后 本研究结果显示,经过体外循环根治术后的新生儿,术后1周内每日最大喂养量达到120 mL/kg,可以明显降低术后医院感染(P<0.05),尤其是菌血症的发生率,还可减少术后呼吸机辅助时间、重症监护时间和住院时间(P<0.05)。
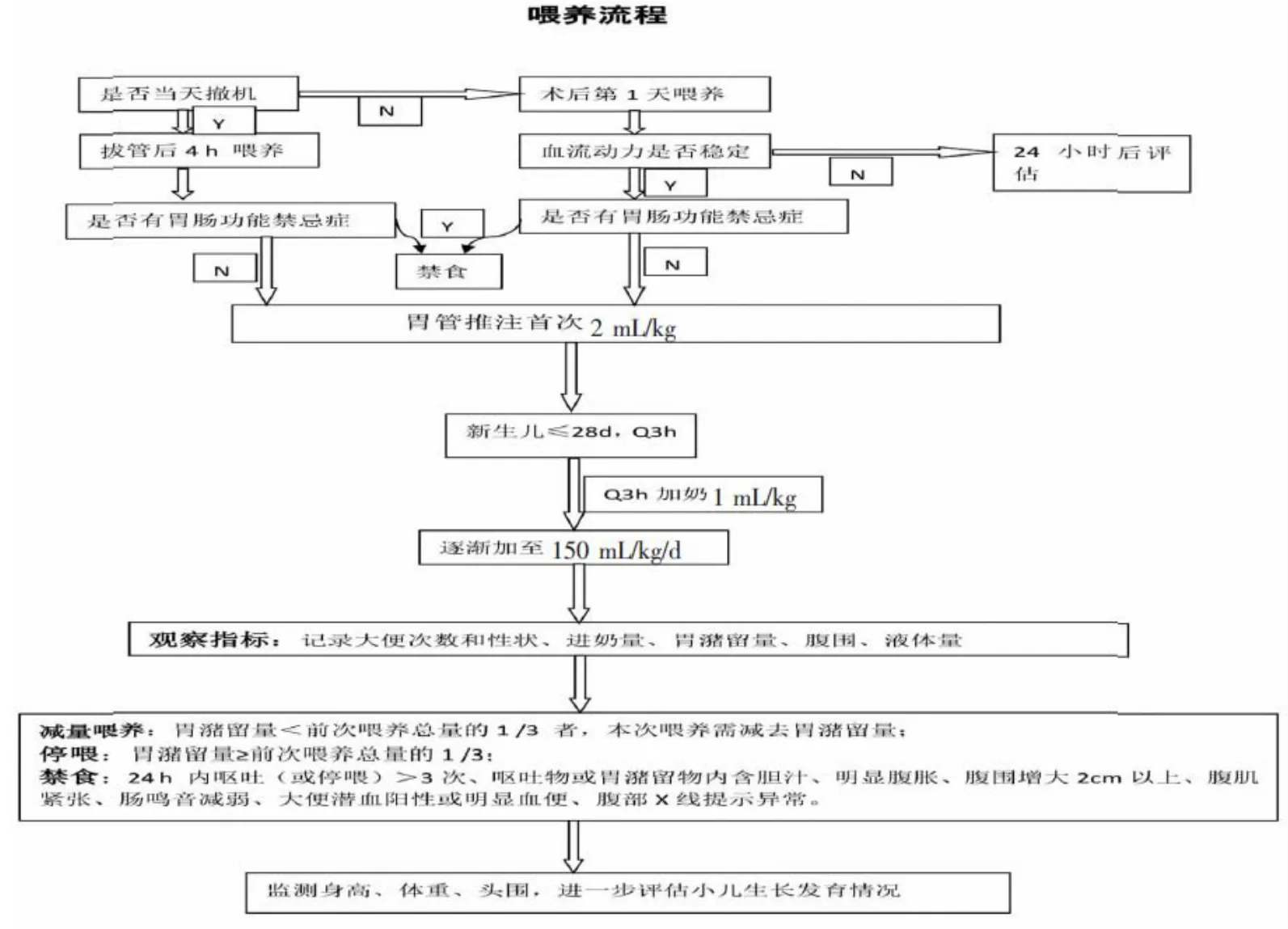
图1 新生儿心脏术后喂养流程

图2 生存曲线-术后住ICU时间
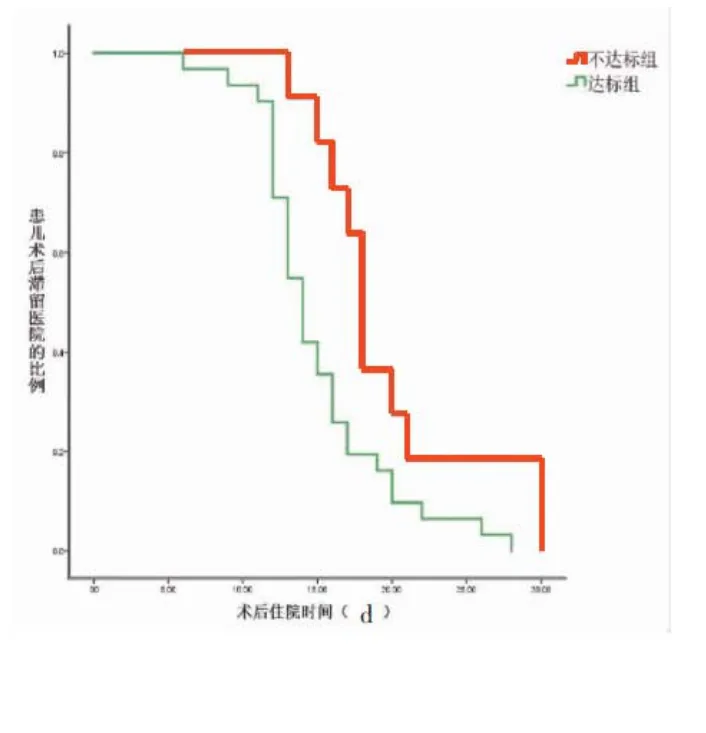
图3 生存曲线-术后住院时间
3.2 液体平衡与达标喂养 新生儿心脏术后营养不良发生率高,普遍存在能量供给不足的状况[8-9]。围术期营养支持在心脏术后临床管理中占有重要地位[10]。良好的营养支持能够提供充足的能量,维持患儿在疾病急性期高消耗下的代谢平衡,保证婴幼儿的特定生长发育[11]。两组患儿在术后7 d内喂养量整体趋势都是逐渐增高的。儿童心脏术后充足的营养支持在具体实施中挑战较大,严格的液体管理、各种原因导致的肠内营养中断、喂养不耐受等是患儿喂养困难的主要原因[12]。体外循环术后急性肾损伤的发生率高,部分患儿甚至会出现严重的肾功能损伤,需要进行腹膜透析治疗[13]。通常临床医师倾向于在术后早期阶段采取限制液体输入、加强利尿避免液体过负荷的治疗策略。本研究发现,在24 h、48 h、72 h内总的液体正平衡量上,虽然无统计学差异(P>0.05),但在48 h和72 h内的累计液体正平衡上,喂养达标组的液体正平衡量绝对数值大于未达标组,提示液体正平衡的患儿更容易在术后1周内达到达标喂养量。
3.3 血管活性药物指数与达标喂养 儿童心脏术后低心排发生率较高,需要血管活性药物支持,较大剂量的儿茶酚胺类药物会收缩内脏血管,加重肠道缺血缺氧,这会增加患儿喂养不耐受的概率[14]。对于血流动力学稳定的重症患儿,早期启动喂养是可行的,本研究的患儿术后24 h内启动喂养的6例,48 h内启动喂养的19例,72 h内启动喂养的27例。对于血流动力学不稳定的患者,是否启动喂养目前仍存在争议。本研究中的患儿整体血流动力学稳定,但血管活性药物使用量仍然较大,术后2 d内的最大血管活性药物指数中位数基本在8~10,两组中位数虽无统计学差异,但在中位数的绝对数值(第1天10 VS 9,第2天 10 VS 8)方面,喂养达标组较未达标组更低一点,显示血管活性药物指数低的患儿较容易达到达标喂养量。
3.4 研究局限性 第一,本研究纳入分析的新生儿是术后病情相对稳定且易于开展早期喂养的患儿,对于术前已经存在消化系统疾病,例如坏死性小肠炎的患儿,以及单心室方向姑息手术、术后延迟关胸、甚至需要体外膜肺氧合辅助的患儿,其喂养难度更大,在喂养启动时机及喂养量增加速度等方面存在更多未知之处,今后研究可进一步予以探讨[15-16]。第二,这是一项回顾性研究,对于喂养过程的中断、喂养不耐受的具体原因,本研究没有涉及。第三,患儿喂养的配方奶粉由患儿父母提供、非统一品种,喂养不耐受可能与配方奶粉的选择有关。第四,纳入分析的新生儿未在术后1周内启动肠外营养支持,本研究只是分析了肠内营养的喂养量,并未计算肠内营养联合静脉补充葡萄糖的总能量供给。
4 小结
对于血流动力学稳定的体外循环复杂先心手术的新生儿,早期启动肠内喂养是可行的,术后1周内日最大喂养量达到120 mL/kg的患儿比未达标的患儿有较低的菌血症及医院感染事件发生率,较短的术后呼吸机辅助时间、重症监护时间和住院时间;且达标组患儿的手术预后较未达标组佳,即使达标组有较长的体外循环时间、手术时间及术前机械通气时间,但两者其间的因果关系及喂养达标与否的影响因素,尚待前瞻性研究后续探讨。

