西南高温高湿地区青贮中天然乳酸菌群落结构特征及优质乳酸菌的筛选
关 皓,曾泰儒,帅 杨,闫艳红,张新全
(四川农业大学动物科技学院,四川 成都 611130)
青贮是保持饲料营养价值最有效的技术之一[1],其品质取决于青贮自然发酵过程,即青贮后立即由同型发酵乳酸菌进行发酵,从而导致饲料酸化,抑制有害微生物生长[2]。然而,在热带和亚热带地区难以生产出高品质的青贮饲料[3-4]。这些地区在夏季大规模青贮生产过程中经常遭受高温和大量降水等不利天气条件,严重影响青贮发酵和有氧稳定性[5]。青贮原料附生乳酸菌在生产优质青贮饲料中发挥着重要作用。然而,乳酸菌并不是植物上唯一的微生物,梭状芽孢杆菌、肠杆菌、酵母和霉菌也常生长于植物上,并与乳酸菌竞争水溶性碳水化合物(water soluble carbohydrate, WSC)。此外,植物上附着的天然乳酸菌种群因植物而异,数量从(1 × 102)~(1 × 109) cfu·g-1鲜样(fresh matter,FM)不等[6]。环境条件也会影响植物上附着的乳酸菌数量。而乳酸菌数量和活性是抑制不良微生物生长和减少发酵损失的一个重要因素,自然发酵品质取决于青贮材料上初始乳酸菌数量和底物的含量。Pahlow 等[6]报道,在温暖地区生长的青贮原料上附着的乳酸菌数量和种类比在寒冷地区的更多、更丰富。因此,了解湿热地区青贮原料上附着的天然乳酸菌组成是调制优质青贮饲料的前提。
当青贮发酵受环境影响时,乳酸菌常被作为青贮饲料添加剂,用于提高青贮发酵品质[7]。然而,并非所有的乳酸菌接种剂都能在大多条件下获得良好的发酵效果,尤其是在高温高湿的环境中。在青贮初期,当空气仍然存在于植物间隙时,由于植物呼吸和好氧微生物的持续活动,温度可能会上升到40 ℃以上[3]。青贮饲料在夏季可能会长时间受高温的影响,特别是在热带和亚热带地区。Chen 等[8]报道了一种商业乳酸菌接种剂LP(Lactobacillus plantarum和Pediococcus acidilactici混合)不能适应较高温度下(45 ℃)的青贮环境。此外,研究表明,商业乳酸菌接种剂(L. plantarumMTD-1)对高温青贮(50 ℃)没有任何帮助,而分离的两株菌株(P. acidilacticiGG13 和L. rhamnosusGG26)通过降低pH、丁酸、铵态氮(NH3-N)和乳酸含量提高了象草(Pennisetum purpureum)高温青贮质量[9]。这些研究表明,由于商业乳酸菌的筛选与使用多在温带地区,高温会在一定程度上影响其使用效果,在当地条件下筛选的乳酸菌菌株则有更佳的适应性。
综上,了解湿热地区的青贮原料上乳酸菌种群是提高该地区青贮的前提,筛选适宜当地条件的优质乳酸菌是提高该地区青贮饲料发酵质量的关键。因此,本研究的目的是调查高温高湿地区乳酸菌组成,筛选适宜的当地乳酸菌菌株,探明耐高温乳酸菌的生物学特性及发酵特性,为后续的乳酸菌添加剂的研究提供理论支撑。
1 材料和方法
1.1 样品采集和菌株分离
样品为3 个品种的玉米(Zea mays) (雅玉8 号、中单808 号和多玉3 号)和桂牧一号杂交象草[(P.purpureum‘Mott’) × (P. americanum×P. purureum)]‘Guimu No. 1’及其分别制成的青贮饲料,均来自中国西南高温高湿地区(表1),玉米原料为乳熟期的全株玉米,杂交象草在高度大于1.5 m 时收获。全株玉米青贮样品在大窖中发酵两个月后取样,杂交象草青贮样品则在裹包青贮3 个月后取样。
原料和青贮样品均称取20 g 于180 mL 无菌蒸馏水中在4 ℃下震荡1 h,再在无菌蒸馏水中连续稀释1 × 10-1至1 × 10-10。在MRS 培养基(陆桥科技有限公司,北京,中国)中37 ℃培养48 h 后对乳酸菌进行分离,为了确保真实地反映原料和青贮中乳酸菌群落结构,从每种样品MRS 培养基中随机抽取20~40 株菌株,共收集251 株菌[10]。通过革兰氏染色和过氧化氢酶试验确定其中227 株为乳酸菌[11]。将227 株乳酸菌放入加有甘油的保藏管中-20 ℃保存。
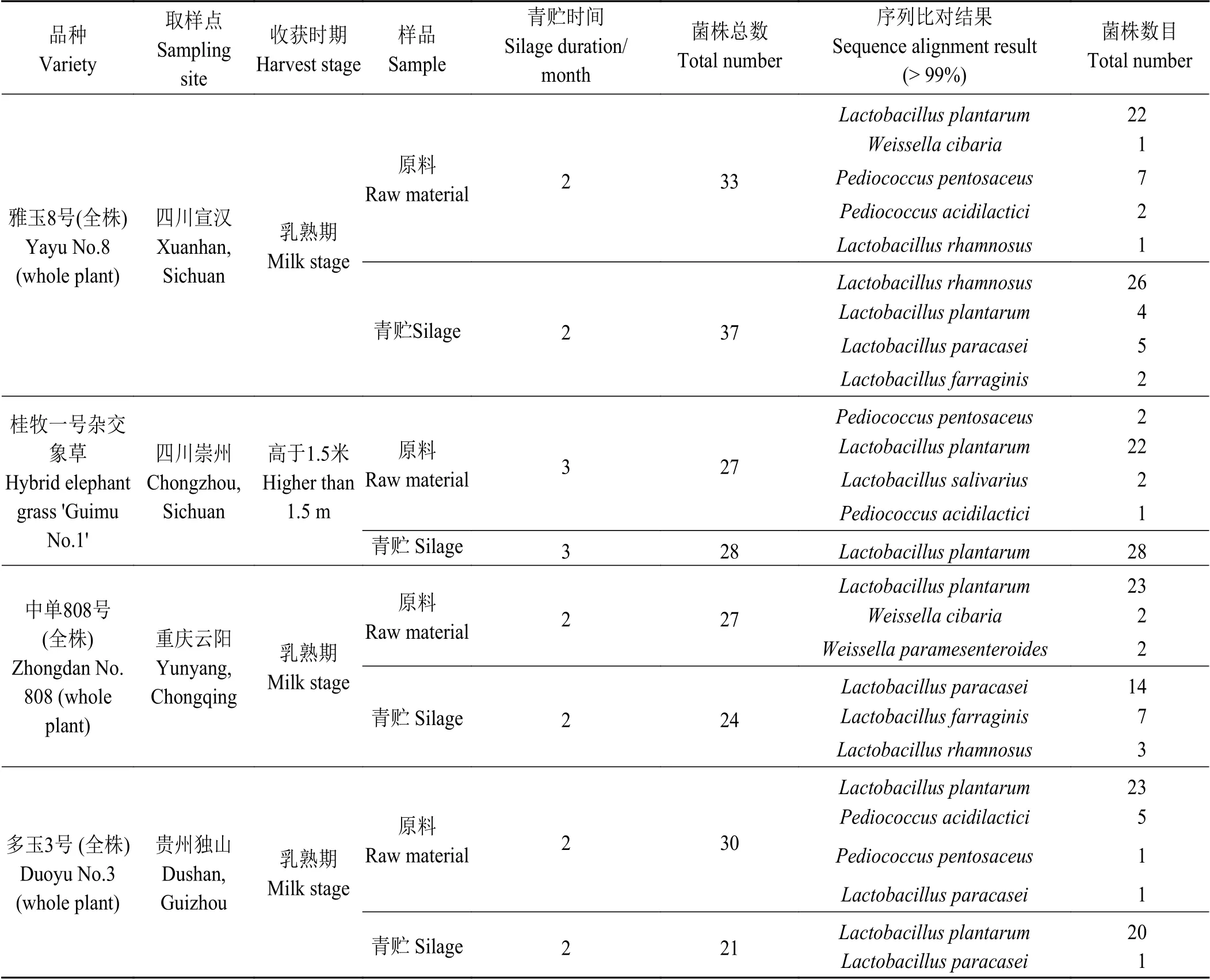
表 1 青贮前后样品信息及227 株乳酸菌鉴定结果、分布详情Table 1 Sample information before and after ensiling and identification and distribution of 227 strains of lactic acid bacteria
1.2 227 株乳酸菌基因组的提取
将227 株乳酸菌置于37 ℃中过夜培养,10 000 r·min-1离心5 min,用TE 缓冲液在15 mL 离心管中洗涤两次后再离心。DNA 提取采用TIANamp细菌DNA 试剂盒(DP302-02,天根科技有限公司,北京,中国)[12]。DNA 使用前保存在 -20 ℃。
1.3 227 株乳酸菌16S rRNA 基因序列鉴定
对227 株乳酸菌16S rRNA 序列进行PCR 扩增。1 μL DNA 作为模板,PCR 引物为27f (5′-AGAGTTTGATC CTGGCTCAG-3′)和1492r (5′-TACGGCTACCTTG TTACGACT-3′)[11],反应体系为20 μL 体系。PCR 程序:95 ℃下处理5 min;94 ℃变性30 s,在55 ℃下退火1 min,循环30 次;72 ℃延伸15 min,最后72 ℃保温10 min。用1.5%琼脂糖凝胶电泳在1 ×TBE 缓冲液中检测PCR 产物质量,合格的PCR 产物送上海生工公司进行序列分析[11]。利用BLAST分析方法,将测得的16S rDNA序列与GenBank 的16S rRNA 序列进行比对,相似度高于99%的序列被认为是同一株菌[11]。
1.4 乳酸菌的筛选及生理生化特性测定
分离到的227 株乳酸菌首先放置于MRS 液体培养基中37 ℃培养,在12 和24 h 时测其OD600nm及pH,筛选出生长效率最高、产酸能力最强的30 株菌。再将初筛出的30 株菌放置于MRS 培养基中45 ℃培养,在12 和24 h 测其OD 及pH,筛选出生长效率最高、产酸能力最强的4 株乳酸菌(LP149、 LS358、 LR753 和LPA761)[13]。 根 据Cai等[12]描述的乳酸菌鉴定方法,对这4 株菌进行革兰氏染色、菌落形态、过氧化氢酶活性和葡萄糖产气试验。糖发酵试验采用试剂盒方法(陆桥科技有限公司,北京,中国)。
1.5 筛选到的4 株乳酸菌系统发育树的构建
利用BLAST 分析方法,将16S rDNA 序列与GenBank 的16S rRNA 序列进行比对,通过邻接法构建系统发育树[14]。使用CLUSTALW 软件对1 000 个随机重采样的序列数据进行bootstrap 分析,评估系统发育树的拓扑结构[15]。以枯草芽孢杆菌NCDO1769为外围菌株[11]。本研究中4 株乳酸菌16S rRNA 基因序列已被GenBank 收录,序列号:MH337263 为LP149,MH333261 为LS358,MH333262 为LR753,MH333263 为LPA761。
1.6 筛选到的4 株乳酸菌耐温、耐酸及耐盐测定
耐温试验:将筛出的4 株菌(LP,ATCC 14917;LS,ATCC 11741;LR,ATCC 7469;LPA,ATCC 334)、标准菌及商业乳酸菌(LPC,四川高福记生物科技公司)接入MRS 液体培养基中,分别置于4、10、20、30、40、45、50 ℃培养箱中,培养3 d 后测定各组发酵液的OD600nm,每个处理重复3 次[11]。
耐酸试验:用经过无菌处理的HCl 溶液和NaOH 溶液调整MRS 液体培养基pH,将上述菌株接入pH 为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5 的MRS 液体培养基中[11],分为两组,分别在37 和45 ℃的培养箱中培养3 d,测定培养基OD600nm。
耐盐试验:将上述活化的乳酸菌接入NaCl溶液体积分数为3.0%和6.5%的MRS 液体培养基中[11],分为两组,分别在37 和45 ℃的培养箱中培养3 d,于600 nm 处 测 定 培 养 基OD 值。OD 值 <0.05 代表不生长(-),OD 值在0.05~0.1 表示微弱生长(W),OD 值在0.1~0.5 表示生长(+),OD 值 >0.5 代表生长良好(++)。
1.7 筛选到的4 株乳酸菌在不同温度条件下生长曲线测定
将活化好的菌和所对应的标准菌株(LP,ATCC 14917;LS,ATCC 11741;LR,ATCC 7469;LPA,ATCC 334)及一株商业植物乳杆菌(LPC,四川高福记生物科技公司)接种到MRS 液体培养基中,每组设置3 个重复,分别置于37 与45 ℃培养箱中恒温培养。每隔2 h 取一次液体发酵液样品,连续测定48 h,以空白的MRS 培养基为对照,在600 nm下测定样品的OD 值,以培养时间为横坐标,相对应的吸光值为纵坐标,绘制乳酸菌生长曲线。
1.8 筛选到的4 株乳酸菌在不同温度条件下的产酸曲线
将活化好的上述乳酸菌接种入MRS 液体培养基中,培养方法同上,每组设置3 个重复,分别置于37 和45 ℃培养箱中恒温培养,每隔2 h 采用pH计测定各菌株发酵液pH,连续测定48 h,以空白的MRS 培养基为对照,以培养时间为横坐标,pH为纵坐标,绘制乳酸菌产酸速率曲线[13]。
1.9 数据分析
采用SPSS 统计软件包的单因素方差分析法(ANOVA),对生长曲线和产酸曲线进行分析。采用Turkey 显著性差异(HSD)检验对不同的样本均值进行检验,P<0.05 为显著。
2 结果
2.1 西南湿热地区自然乳酸菌群落结构
通过16S rRNA 测序和序列分析比较(表1),227 株乳酸菌菌株分属乳酸杆菌属、片球菌属(Pediococcus)和魏斯氏菌属(Weissella) (图1),其中包含了8 个种的乳酸菌:植物乳杆菌(L. plantarum)142 株,鼠李糖乳杆菌(L. rhamnosus)30 株,副干酪乳杆菌(L. paracasei) 21 株,分别占乳酸菌总数的62.55%,13.21%,9.25%;戊糖片球菌(P. pentosaceus)10 株,占4.40%;乳酸菌片球菌(P. acidilactici)8 株,占3.52%;L. farraginis9 株,占3.96%;食窦魏斯氏菌(Weissella cibaria) 3 株,占1.32%;唾液乳杆菌(L. salivarius)和W. paramesenteroides各2 株,均占0.88%。
2.2 分离的乳酸菌菌株生理生化特性及鉴定
测定了筛选到的4 株乳酸菌和4 株标准菌及1 株商用植物乳杆菌LPC 的生理生化特性(表2)。分离菌株均为革兰氏阳性和过氧化氢酶阴性,均呈杆状。LP149 和LPC 均无法消耗葡萄糖产生气体,可以产生DL-乳酸,表明它们是同型发酵乳酸菌,其余3 株菌为异型发酵乳酸菌。
与标准菌株相比,LP149 不能利用菊粉、山梨醇、D-甘露醇、水杨苷和半固体琼脂,对苦杏仁苷的利用较弱,能较好利用鼠李糖、木糖以及马尿酸(表3);而LS358 对菊粉、阿拉伯糖、马尿酸的利用能力较强,对水杨苷的利用较弱,不能利用山梨醇、D-甘露醇、鼠李糖、七叶苷和半固体琼脂;LR753 对蜜二糖和木糖的利用能力良好,但相对于标准菌株,对菊粉的利用能力下降,对鼠李糖的利用能力有所提;LPA761 不能利用菊粉和苦杏仁苷,对鼠李糖利用能力较强,对棉子糖和乳糖的利用能力减弱。系统发育树结果表明,LP149、LS358、LR753 及LPA761 与L. plantarum、L. salivarius、L. rhamnosus和L. paracasei标 准 菌 序列相似度均为100% (图2)。
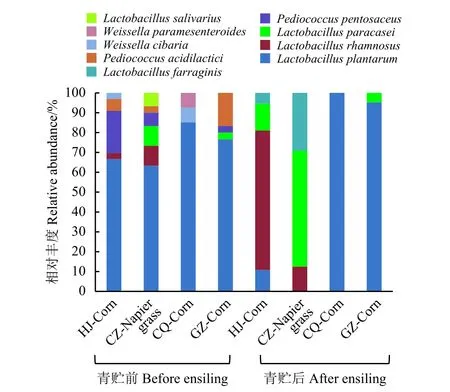
图 1 西南高温高湿地区玉米和狼尾草青贮前后乳酸菌种群结构Figure 1 Community of lactic acid bacteria in corn and Pennisetum before and after ensiling in hot and humid areas of Southwest China
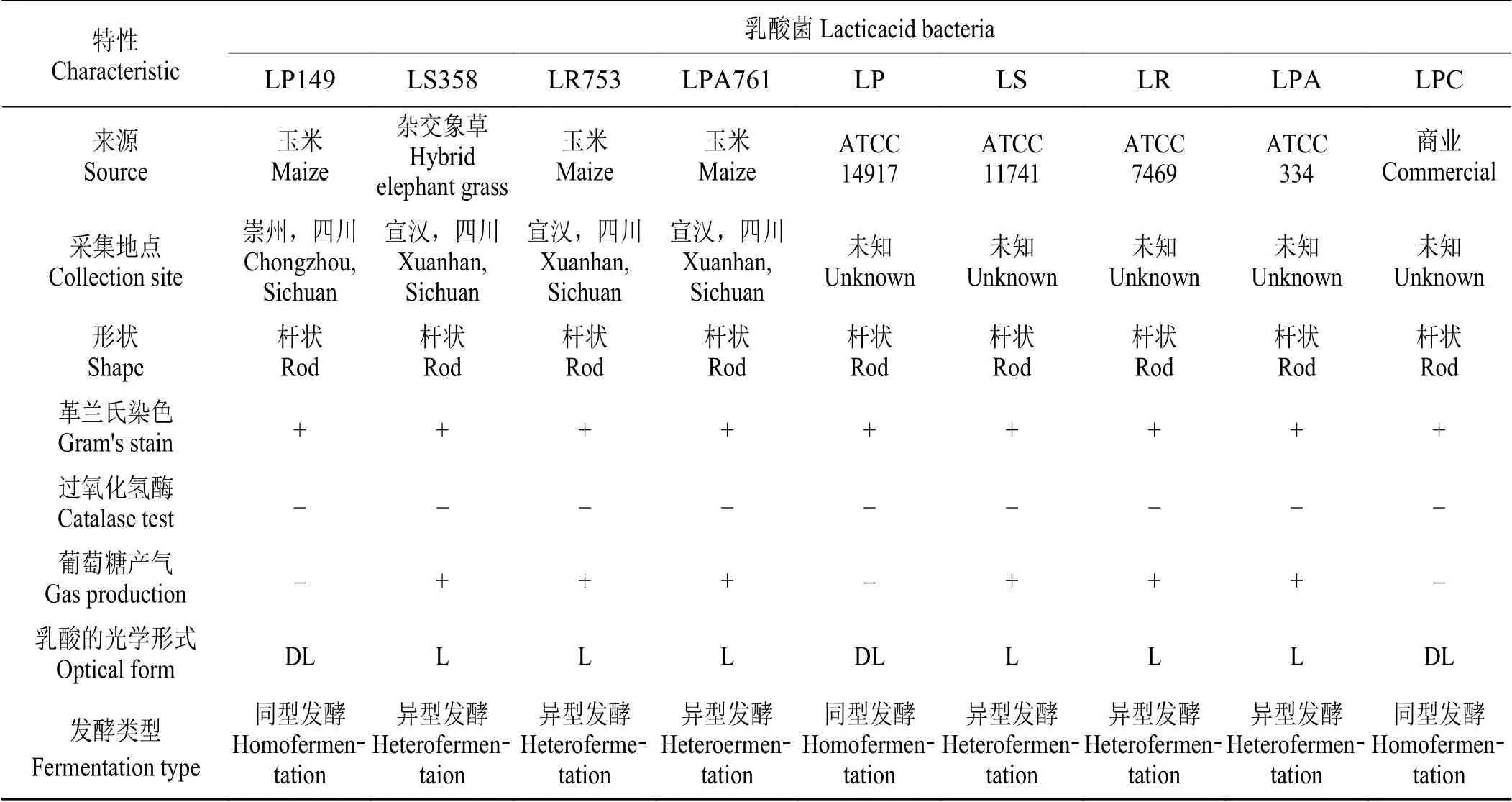
表 2 乳酸菌的生理生化特性Table 2 Physiological and biochemical characteristics of lactic acid bacteria
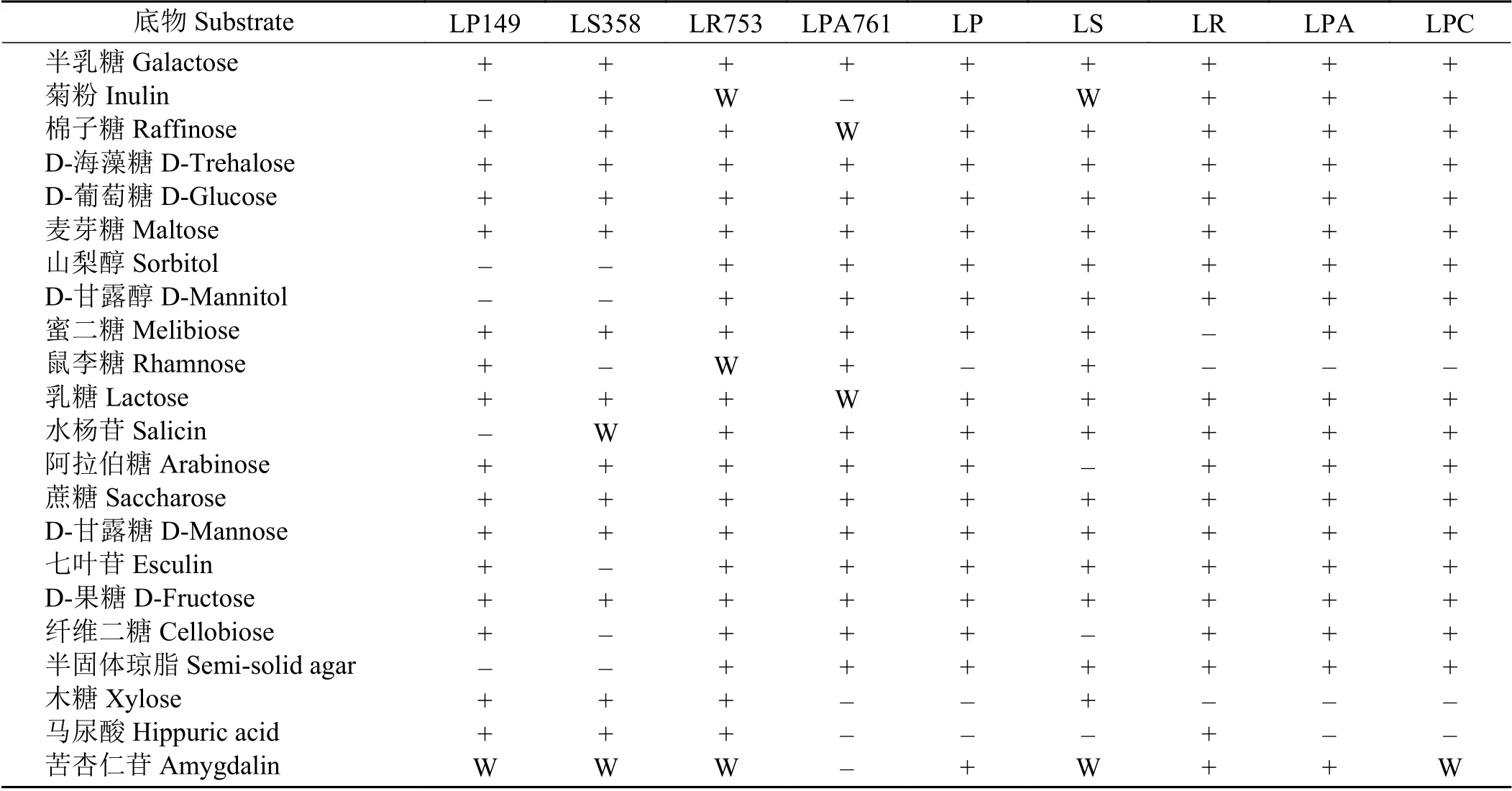
表 3 乳酸菌糖发酵特性Table 3 Characteristics of sugar fermentation of lactic acid bacteria
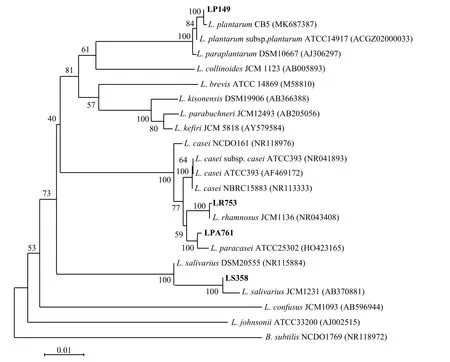
图 2 筛选出的乳酸菌系统发育树Figure 2 Phylogenetic tree of lactic acid bacteria
2.3 乳酸菌耐温、耐酸及耐盐特性测定
与标准菌株相比,LS358、LR753 和LPA761在45 °C 培养条件下生长良好(表4),表明其耐高温性较好。与37 °C 相比,45 °C 培养下的乳酸菌表现出不同的耐性特征(表5、表6)。在45 °C 条件下,筛选出的4 株乳酸菌均能在pH 4.5~7 的液体培养基良好生长。在NaCl 浓度为3%的液体培养基中,LPA761 生长较弱,LP149、LS358 和LR753生长状况良好,在pH7.5 的液体培养基中LP149 和LR753 生长能力较差,LS358 和LPA761 生长能力强。4 株乳酸菌均不能在NaCl 浓度为6.5%和pH 3~4 的液体培养基中生长。
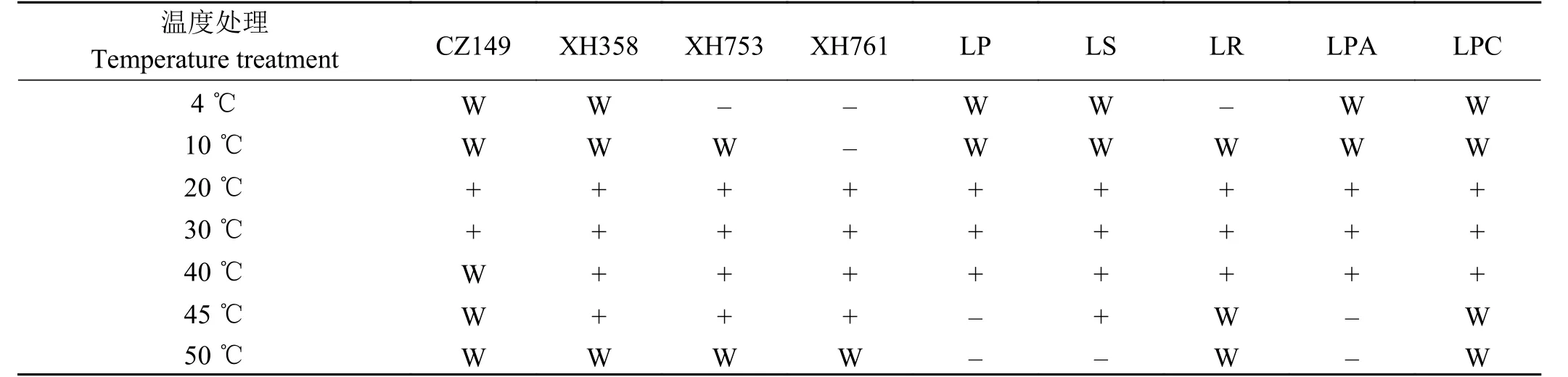
表 4 乳酸菌耐温性特征Table 4 Temperature tolerance of lactic acid bacteria
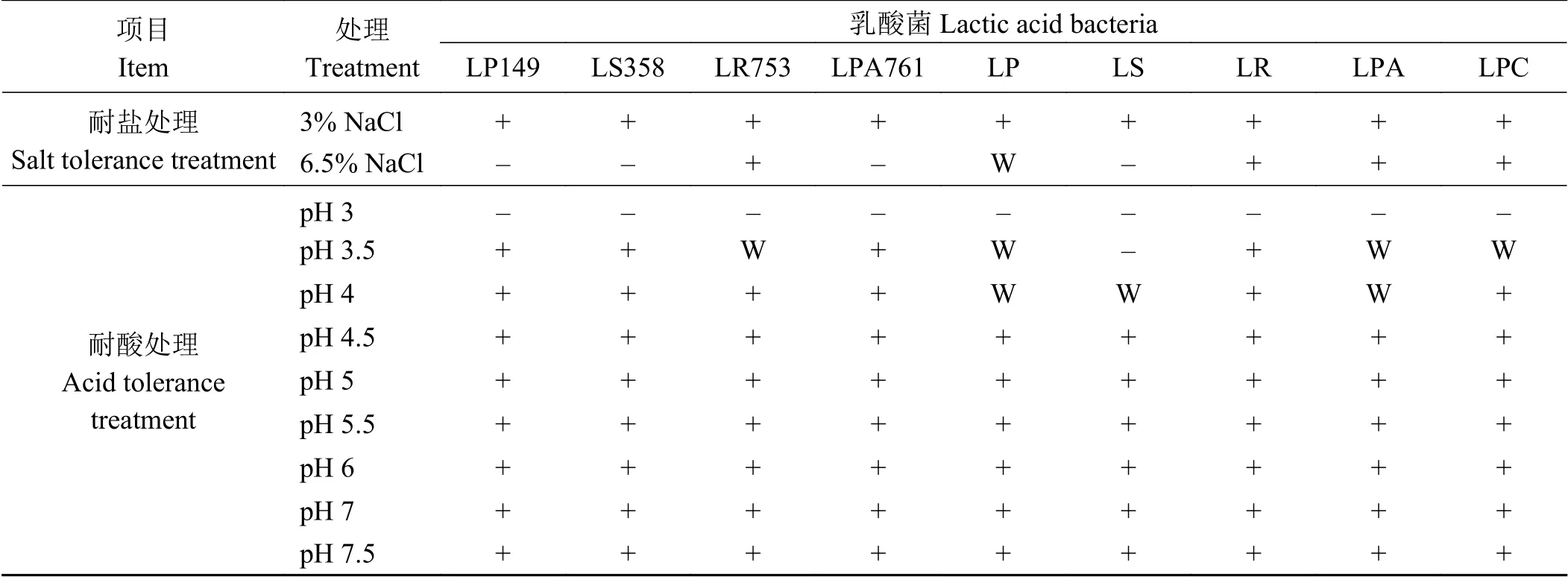
表 5 37 ℃下乳酸菌耐盐性和耐酸性特征Table 5 Salt and acid tolerance of lactic acid bacteria at 37 ℃
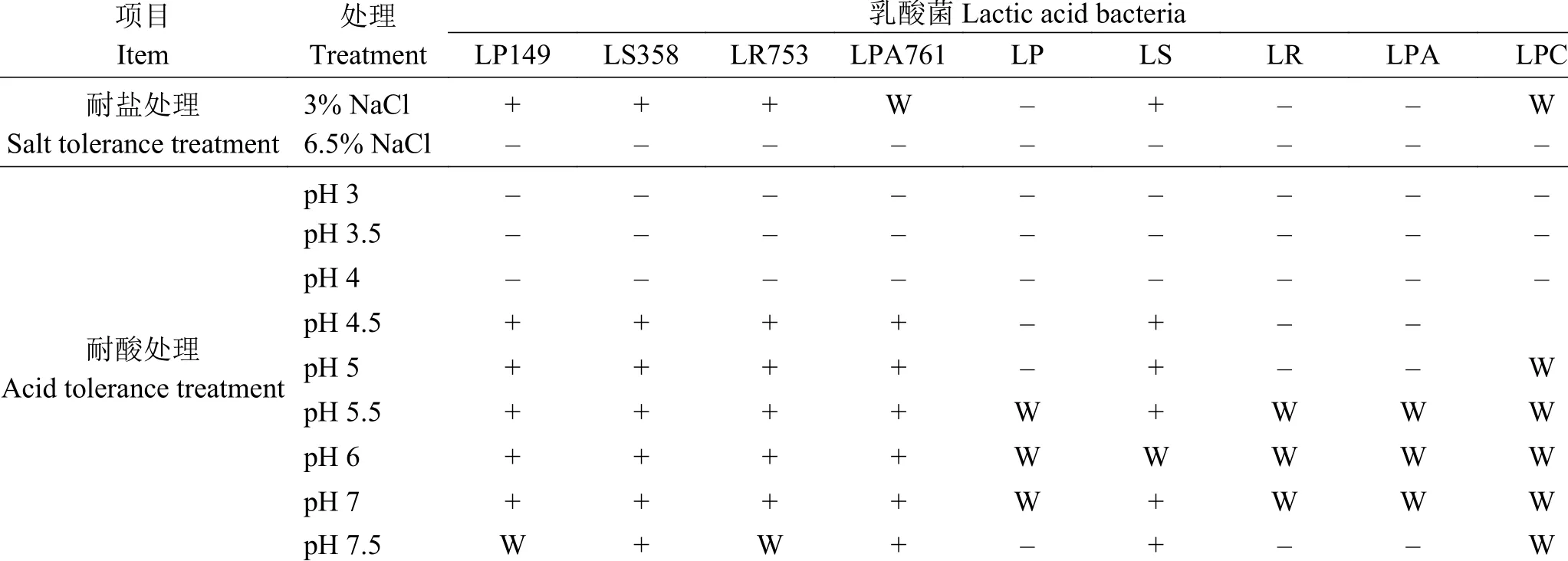
表 6 在45 ℃下乳酸菌耐盐性和耐酸性特征Table 6 Salt and acid tolerance of lactic acid bacteria at 45 ℃
2.4 乳酸菌菌株生长曲线测定
与标准菌株相比较,4 株乳酸菌菌株的生长曲线在37 和45 ℃有着不同的表现(图3)。在37 ℃时,除LP149 外,3 株自选乳酸菌从培养10 h 开始生长速度达到最大,大概20 h 后生长进入稳定期,菌株LP149 未表现出明显的对数期和稳定期,在14 h 时生长速率最快,在22 h 到28 h 时OD 值急剧下降。菌株LP149、LS358、LR753 和LPA761 发酵20 h 的OD 值分别为1.798、0.904、1.438 和1.373 。综上,24 h 内LR753 的生长速度最快且较稳定,LPA761 生长速度较快,LS358 的生长速度最慢。
在45 ℃时,与标准菌株相比(图3),4 株自选菌株的生长情况均更加良好。LP149 在12 h 时OD 值达到最大,从16 h 开始进入稳定时期;LS358在8 h 时生长速率最大,从10 h 开始OD 值较稳定上升;LR753 在12 h 时生长最快,从16 h 开始进入较稳定的时期;LPA761 在8 h 时生长速率达到最大,从10 h 开始进入稳定期。
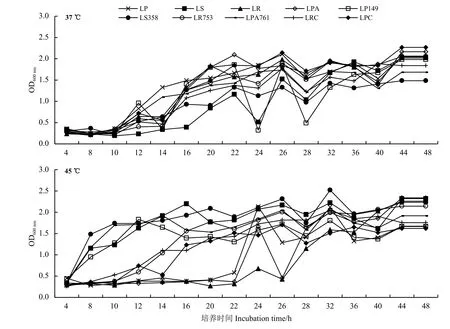
图 3 乳酸菌生长曲线Figure 3 Growth curves of lactic acid bacteria
2.5 乳酸菌菌株产酸能力对比
在37 和45 ℃下,所有菌株的pH 均从5.5 开始总体呈下降的趋势,在4.3 左右达到稳定(图4)。37 ℃时,LP149 的pH 波动较大;LS358 和LR753在14 h 时产酸速率最大,在20 h 左右进入稳定期;LPA761 在10 h 时pH 下降最快,在20 h 时进入稳定时期。
45 ℃时(图4),LP149、LS358、LR753 和LPA761在8 h 左右产酸速率达到最大,10 h 左右进入稳定时期。而标准菌株和商业菌株则花费了更多的时间才使得pH 下降,且在48 h 时pH 高于自选菌株。
3 讨论
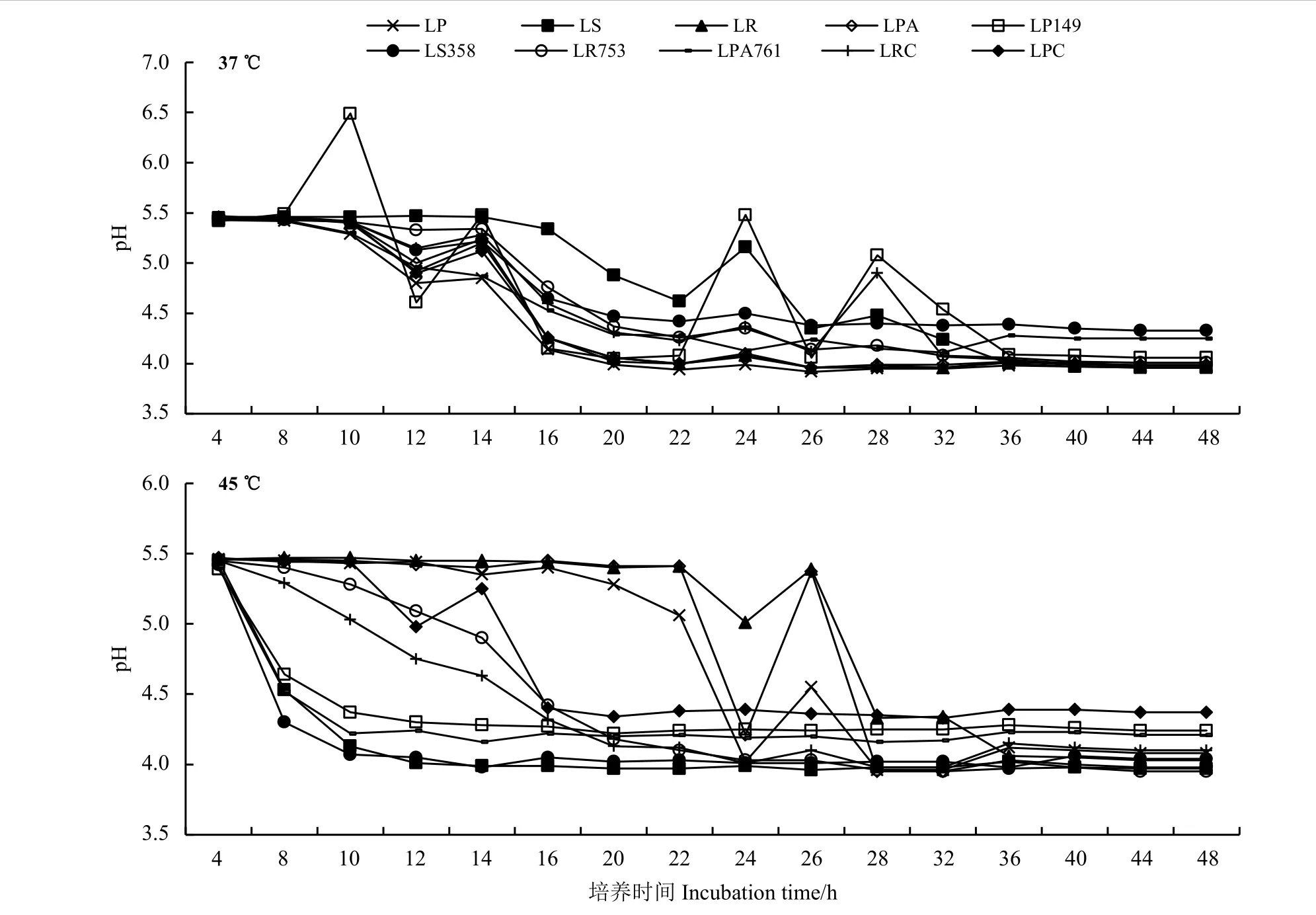
图 4 乳酸菌产酸曲线Figure 4 Acid production curves of lactic acid bacteria
根据先前使用高通量测序技术[12]对与本研究同一样品的微生物群落结构的研究发现,高温高湿地区青贮原料附生细菌群落主要是魏斯氏菌属、假单胞菌属(Pseudomonas)、乳酸杆菌属和明串珠菌属(Leuconostoc)。然而,用这种方法无法获得乳酸菌种水平上的重要信息。传统的形态学、生理生化特征鉴定和单株菌16S rRNA 基因序列分析是弥补高通量测序精度不足的有效手段。本研究发现,植物乳杆菌、戊糖片球菌和乳酸片球菌为青贮原料上附着乳酸菌优势种。同型发酵的片球菌属细菌是青贮中启动菌,在发酵初期便能快速产酸,为乳酸杆菌的生长创造一个适宜的厌氧环境[2]。此外,Li 和Nishino[16]报道了在玉米青贮饲料中使用梯度凝胶电泳(DGGE)检测到W.paramesenteroides存在。之前的研究表明[12],青贮后乳酸杆菌是主要的微生物属,相对丰度超过50%,其次是醋酸菌和魏氏菌。但具体是哪些种类的乳酸杆菌还不得而知。本研究通过对227 株分离到的乳酸菌进行鉴定发现,鼠李糖乳杆菌是四川宣汉地区玉米青贮的优势种,副干酪乳杆菌和植物乳杆菌是四川崇州地区、重庆云阳地区和贵州黔西南地区全株玉米青贮中最丰富的种。通常,植物乳杆菌和副干酪乳杆菌是世界范围内不同地区不同青贮类型中常见乳酸菌[7]。尽管鼠李糖乳杆菌被报道作为青贮饲料接种剂[15-18],但在自然发酵青贮饲料中并未广泛发现。
乳酸菌的特性和储存温度对发酵质量有很大影响[19]。在发酵的初始阶段,当青贮窖中仍存在空气时,青贮饲料的温度可能会超过40 ℃,这是由于持续的植物呼吸和有氧微生物的活动,尤其是在热带和亚热带地区[3]。由于在高温条件下,普通菌株不能很好地生长[8-9],因此建议使用耐热乳酸菌加强高温地区的青贮饲料发酵[20]。在本研究中,筛选出的菌株LP149、LS358、LR753 和LPA761 在45 ℃和最低初始pH 3.5 下都能生长。然而,LPC 仅在初始pH 为3.5 时轻微生长,在45 ℃时不能生长。因此,从高温高湿地区采集的青贮中筛选的菌株LP149、LS358、LR753 和LPA761 有更好的高温适应性。
产酸速率和生长速率是评定乳酸菌活性与是否优良的重要指标,不同菌株间具有一定程度的差异[19]。微生物的生长曲线一般分为4 个阶段:迟缓期、对数期、稳定期和衰亡期[21]。在本研究中,高温对乳酸菌生长曲线和产酸曲线有较大影响。与在37 ℃培养下的菌株相比,在45 ℃培养下的LP149、LS358、LR753 和LPA761 都无明显的迟缓期,比标准菌株和商业菌株更早地进入对数期和稳定期,展示出了优良的耐高温性和产酸效率,值得进一步在高温青贮中进行验证。
4 结论
天然植物乳杆菌是高温高湿地区玉米和杂交象草原料和青贮料中最常见的乳酸菌菌株,其次是鼠李糖乳杆菌和副干酪乳杆菌。根据生理、生化特征和16S rRNA 测序分析,筛选出的4 株乳酸菌LP149、LS358、LR753 和LPA761 分别被鉴定为植物乳杆菌、唾液乳杆菌、鼠李糖乳杆菌和副干酪乳杆菌。筛选出的4 株乳酸菌有良好的高温适应性,不仅生长速度快,产酸能力强,耐盐性较好,对糖源利用范围广,而且对酸性环境有较好的适应性,特别是唾液乳杆菌和鼠李糖乳杆菌,作为较少被报道的异型发酵乳酸菌,可以作为后续进行高温青贮回填试验的新型菌株。

