miR-449b多态性位点rs10061133差异调控LHCGR表达
潘虹,陈蓓丽,李腾龑,马旭*
(1.北京协和医学院研究生院,北京 100730;2.国家卫生健康委科学技术研究所,北京 100081;3.安徽医科大学第一附属医院生殖医学中心,合肥 230022)
卵巢功能不全(premature ovarian insufficiency,POI)又称为卵巢早衰(premature ovarian failure,POF),是一种严重影响女性生殖健康的疾病,临床表现为40岁以前停经并伴随血浆促性腺激素水平增加[1]。其可能的病理机制包括原始卵泡池的初始减少或原始卵泡未能成熟[2]。多种因素可导致POI的发生,然而,大多数POI病例被认为是特发性的,可能与遗传因素相关。目前,经过大量工作已经鉴定若干非综合征型POI相关基因,如FSHR、LHCGR、NR5A1、NOBOX、FOXL2、FIGLA、BMP15、NANOS3、STAG3、ADAMTS19和BMPR2,极大促进了我们对POI发病机制的了解[3]。
微小RNA(miRNA)参与卵母细胞成熟和卵泡发生的过程,其表达改变可能影响POI的发生[4-5]。MIR449B(miR-449b)是miR-449簇的成员,具有强烈的组织表达特异性,在睾丸和卵巢中具有较高水平[6]。目前,已经鉴定了许多miR-449b靶基因,例如SIRT1、CCNE2、MET、GMNN、HDAC1、CDK4、CDC25A和CDK6,在多种生物学过程中发挥重要作用[7]。Rs10061133 A>G是miR-449b成熟区(hsa-miR-449b-5p)一个高度保守的多态性位点,为研究该多态性位点与POI发病的相关性,我们之前通过质谱的方法对miR-449b rs10061133多态位点进行基因分型,关联分析结果显示rs10061133 AA基因型携带者患POI的风险高[8]。但目前尚不清楚miR-449b参与POI的具体机制,本研究拟通过预测鉴定其与POI相关下游靶基因,了解其参与POI的可能作用方式。
资料与方法
一、预测miR-449b的潜在靶基因
miRWalk(http:∥mirwalk.umm.uni-heidelberg.de/)在线预测miR-449b的潜在靶基因[9]。TargetScanHuman 7.2(http:∥www.targetscan.org/vert_72/)用于预测miR-449b的结合位点。文献检索这些潜在靶基因与POI发生发展的相关性,找到可能与POI相关的miR-449b潜在靶基因。
二、质粒构建和定点突变
对照载体、miR-449b(rs10061133 AA基因型)、miRNA抑制剂对照和miR-449b抑制剂购自GeneCopoeia(Rockville,Maryland,美国)。以miR-449b(AA基因型)表达质粒为模板,使用适当的引物通过定点突变获得miR-449b的rs10061133(GG基因型)表达质粒。黄体生成素/绒毛膜促性腺激素受体(luteinizing hormone/choriogonadotropin receptor,LHCGR)的野生型3’UTR片段通过以人细胞系HEK 293TcDNA为模板进行PCR扩增获得。将包括预测结合位点的413-bp扩增产物(LHCGR-luc)克隆到pGL3-Control载体(Promega,Madison,美国)luc+基因下游的XbaI位点。用适当的引物通过定点突变获得miR-449b结合位点区域缺失(AGTGTAGTCTATGACCACTGCCA/-)的突变型LHCGR 3’UTR片段(LHCGR-luc-del)。通过Sanger测序验证所有构建质粒。所有引物信息见表1,质粒构建和定点突变示意图如图1所示。

表1 用于定点突变和质粒构建的引物

图1 质粒构建和定点突变示意图
三、细胞培养,瞬时转染和双荧光素酶检测
HEK293T细胞(本室保存)培养在含有10%胎牛血清的DMEM高糖培养基中,取对数生长期细胞,接种细胞到96孔培养板,待汇合度达到约50%~60%转染。海肾荧光素酶(pRL-TK)作为内对照,消除每个孔转染效率不同的影响。使用Lipofectamine 2000(Invitrogen,Carlsbad,CA,美国)进行转染。转染后48 h,洗涤并裂解细胞,利用双荧光素酶报告检测系统(Promega,Madison,WI,美国)在Promega发光检测仪上测量荧光素酶活性。操作按照产品说明书进行。
四、统计分析
双荧光素酶测定值代表3次独立重复的平均值。所有分析均使用GraphPad Prism 5进行。使用独立样本t检验计算,以P<0.05为差异有统计学意义。
结 果
一、与POI相关的miR-449b潜在靶基因LHCGR
为了探究miR-449b与POI相关的可能机制,我们使用miRWalk预测其潜在靶基因。我们还搜索了所有已发表的相关文献,以确定可能的POI相关基因。在软件预测的miR-449b的所有潜在靶基因中,我们选择可能与POI相关的基因LHCGR作为miR-449b的潜在靶基因。使用TargetScanHuman 7.2,我们预测LHCGR的3’UTR(人LHCGR NM_000233 3’UTR长度:923 bp)161-168序列作为miR-449b的潜在结合靶点。
二、miR-449b靶向LHCGR的3’UTR
为了确定LHCGR是否是miR-449b的靶基因,在双荧光素酶测定中使用野生型和突变型LHCGR3’UTR(LHCGR-luc和LHCGR-luc-del)作为报告基因。我们的结果显示,与对照载体相比,miR-449b显著减弱野生型3’UTR的荧光素酶活性(图2A)。相反,突变型3’UTR对miR-449b几乎没有应答(图2B),表明LHCGR可能是miR-449b的直接靶基因。
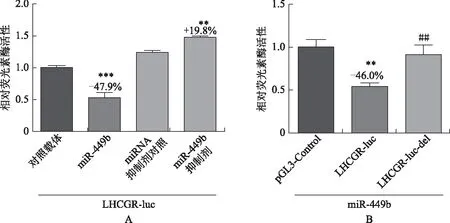
A:对照载体、miR-449b、miRNA抑制剂对照或miR-449b抑制剂分别与LHCGR 3’UTR野生型(LHCGR-luc)共转染HEK 293T细胞:与miRNA抑制剂对照比较,**P<0.01;与对照载体比较,***P<0.001。B:LHCGR 3’UTR野生型(LHCGR-luc)或突变型(预测靶位点缺失,LHCGR-luc-del)分别与miR-449b共转染HEK 293T细胞:与pGL3-control比较,**P<0.01;与LHCGR-luc比较,##P<0.01图2 HEK 293T细胞中双荧光素酶报告实验显示LHCGR是miR-449b的直接靶基因(pRL-TK共转染作为内参)
三、不同基因型对LHCGR 3’UTR表达的影响
为了确定miR-449b rs10061133不同基因型对LHCGR3’UTR的影响,进行了进一步的双荧光素酶测定。我们的结果显示,miR-449b AA基因型的LHCGR-luc表达显著低于GG基因型(P<0.05)(图3)。表明miR-449b的rs10061133 AA基因型比GG基因型更明显地抑制靶基因LHCGR表达。
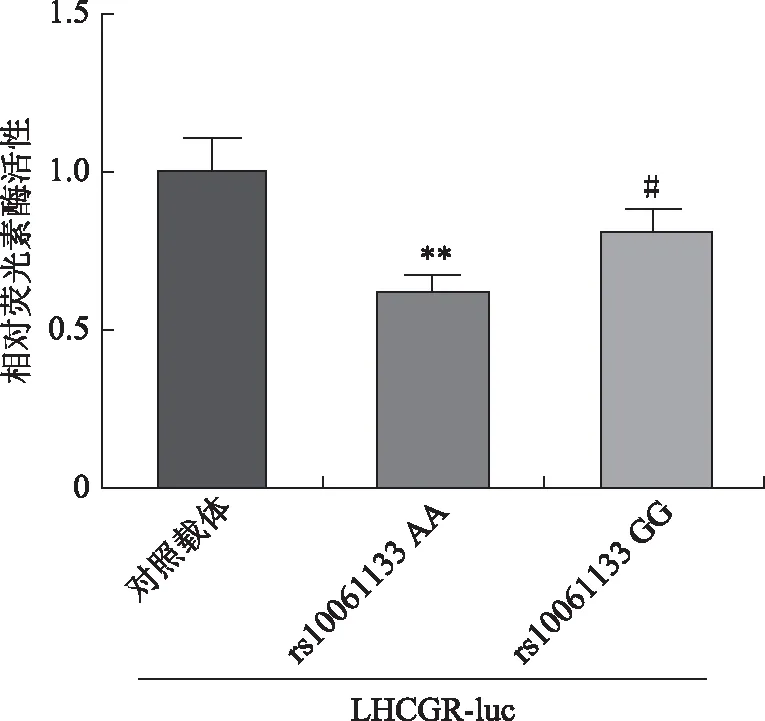
rs10061133 AA或GG基因型分别与LHCGR 3’UTR野生型(LHCGR-Luc)共转染HEK 293T细胞。pRL-TK共转染作为内对照。与对照载体比较,**P<0.01;与rs10061133 AA比较,#P<0.05图3 miR-449b不同基因型对LHCGR-luc表达的影响
讨 论
LHCGR基因编码黄体生成素/绒毛膜促性腺激素受体,主要在睾丸和卵巢中表达[6]。LHCGR在卵泡发育过程中起关键作用,通过人卵巢组织的免疫组织化学染色和蛋白质印迹实验发现该蛋白开始出现在早期窦卵泡的颗粒细胞和卵泡膜细胞中,并且在卵丘细胞中亦有表达[10]。动物模型实验显示小鼠Lhcgr基因靶向敲除可以导致小鼠不育,雄性和雌性小鼠的内外生殖器发育均严重不足,其中雌性小鼠窦前卵泡生长停滞[11]。LH通过LHCGR在卵泡生长和卵母细胞成熟中起重要作用。在颗粒细胞分化期间诱导LHCGR允许排卵前卵泡对中期LH峰作出应答并且LH是排卵所必需的[12]。LHCGR的异常表达将导致部分卵巢功能衰竭,携带LHCGR基因失活突变的女性具有LH增加、卵巢增大、月经稀发和不育的临床特征[13-14]。Fonseca等[3]通过二代测序在2名POI患者中发现2个LHCGR基因突变位点(c.296A/G和c.526C/T)。因此,LHCGR可能是POI的候选致病基因。总之,较低的LHCGR表达或LHCGR突变可能与POI发生相关。miRNA成熟序列中的多态性位点(SNP)可影响靶基因结合或miRNA成熟过程[15-17]。我们的前期研究结果表明,miR-449b rs10061133 AA基因型可能是POI的风险因素[8]。为了进一步探索miR-449b多态性与POI的相关性,使用生物信息学预测和荧光素酶双报告基因检测寻找与POI相关的miR-449b靶基因,软件预测和实验结果均表明LHCGR为miR-449b的靶基因并且miR-449b rs10061133不同基因型(AA和GG)对LHCGR抑制作用程度不同。miR-449b与LHCGR3’UTR的结合在AA基因型下可以比GG基因型更稳定和有效,并因此导致更少的LHCGR表达,miR-449b多肽位点rs10061133 A>G与POI的相关性可能通过差异调控其靶基因LHCGR的表达来实现。
综上所述,我们的结果证实miR-449b可能通过靶向POI相关基因LHCGR参与POI的发生,并且AA基因型可能对其靶基因LHCGR具有比GG基因型更强的抑制作用。更大规模的样本研究和进一步的功能实验,将有助于了解miR-449b rs10061133 A>G和POI的相关性。

