受精液平衡方式对新建胚胎实验室鼠胚实验的影响
吴山强,李小冬,陈培芳,叶岳,吴建兰,谢予扬
(广西医科大学第七附属医院生殖中心,梧州 543000)
近年来随着我国不孕不育人群的不断增多,越来越多的人需要接受辅助生殖技术(ART)助孕,获取更多的优质胚胎是不孕不育人群成功妊娠的基础[1]。保证卵母细胞受精质量,优化体外培养条件成为胚胎培养成功的重要因素,尤其是新建的人类ART胚胎实验室,需要经过严格的质量控制才能将其运用于人类配子及胚胎的处理[2]。目前鼠胚实验(mouse embryo assay,MEA)是最常用的ART胚胎实验室质量控制实验,通过鼠胚实验检测实验室的培养体系是否达到相应的质控要求[3]。我院生殖中心新建胚胎实验室建成于2015年3月,经过前期充分的通风和层流换气、升温并去除挥发性有机化合物(VOC)等[4]处理后,于2018年1~10月利用昆明小白鼠进行体外受精胚胎培养实验,观察当日配皿与前日配皿两组实验的受精率、卵裂率和2C囊胚形成率,对不同受精液平衡方式处理的小鼠卵母细胞体外受精及胚胎发育过程进行评价,从而为后期开展人类辅助生殖技术中卵子的体外受精及胚胎培养寻求最佳培养液平衡方案的选择提供实验基础,现将结果报道如下。
资料与方法
一、研究对象
SPF级昆明小白鼠购自于广东省医学实验动物中心,雌鼠4~10周龄,共204只;雄鼠6~12周龄,共100只。SPF级小鼠繁殖饲料适应性饲养1~2周,昼夜光照为每日8∶00开灯,20∶00关灯,温度18~26℃,相对湿度40%~70%。对同一批次雌鼠统一超促排卵后按照随机原则分为当日配皿组与前日配皿组进行鼠胚实验。
二、主要试剂及仪器
孕马血清促性腺激素(PMSG)和绒毛膜促性腺激素(HCG)购自杭州第二激素制药厂;培养体系选择Quinn’s系列培养液(购自美国SAGE公司);石蜡盘,灭菌动物解剖工具;Falcon培养皿、移液管、离心管、灭菌巴氏吸管等为美国BD公司Falcon系列;丹麦IVFtech工作站,蔡司体视显微镜,奥林巴斯倒置显微镜;日本Panasonic CO2培养箱和ASTEC三气培养箱等。
三、研究方法
1. 当日配皿组中授精皿的制备:授精前1日16∶00在含9 ml Quinn’s 1020液的Falcon2001管中添加1 ml血清蛋白代用品(SPS),10 ml移液管轻轻吹打5次混匀后松开盖子置于37℃、5%CO2、5%O2的饱和湿度培养箱中过夜平衡。授精当日8∶00取出过夜平衡的含10%SPS的Quinn’s 1020液1 ml,在Falcon3037皿中小心添加1 ml后立即覆盖0.8 ml培养油,放回37℃、5%CO2、5%O2的饱和湿度培养箱待当日授精用。
2.前日配皿组中授精皿的制备:授精前1日16∶00在含9 ml Quinn’s 1020液的Falcon2001管中添加1 ml SPS,10 ml移液管轻轻吹打5次混匀,在Falcon3037皿中小心添加1 ml含10%SPS的Quinn’s 1020液后立即覆盖0.8 ml培养油,放回37℃、5%CO2、5%O2的饱和湿度培养箱待次日授精用。
3.卵裂期培养皿的制备:当日配皿组与前日配皿组均于授精前1日16∶30在Falcon3001皿中做30~50 μl含10%SPS的Quinn’s 1026液微滴,立即覆盖2.5 ml培养油,放回37℃、5%CO2、5%O2的饱和湿度培养箱过夜平衡后待次日行卵裂期胚胎培养用。
4.囊胚期培养皿的制备:授精当天记为Day0(D0),则D2 16∶00在Falcon3001皿中做30~50 μl含10%SPS的Quinn’s 1029液微滴,立即覆盖2.5 ml培养油,放回37℃、5%CO2、5%O2的饱和湿度培养箱过夜平衡后待次日行囊胚培养用。
5.小鼠卵母细胞的获取:选6~10周龄雌鼠进行超促排卵,于17∶30腹腔注射PMSG 10 U,48 h后腹腔注射HCG 10 U,次日早9∶30颈椎脱臼法处死,75%酒精消毒腹部后解剖取其输卵管,用含10%SPS的HEPS-缓冲HTF操作液Quinn’s 1023将多余的血液和脂肪去掉,在体视显微镜下用1 ml无菌注射器划破膨大壶腹部,灭菌的巴氏吸管将鼠卵于过夜平衡的含10%SPS的Quinn’s 1020中吹洗3次,随机转至当日配皿组与前日配皿组的Falcon3037授精皿中,置37℃、5%CO2、5%O2的饱和湿度培养箱培养2 h。
6.小鼠精子的获取:选8~12周龄雄鼠用颈椎脱臼法处死,75%酒精消毒腹部后解剖取其附睾下段及输精管中上段,用含10%SPS的HEPS-缓冲HTF操作液Quinn’s 1023将多余的血液和脂肪去掉,在含10%SPS的Quinn’s 1020液中用1 ml无菌注射器在体视显微镜下刺破附睾下端并挤出输精管中精子,置37℃、5%CO2、5%O2的饱和湿度培养箱上游30 min~1 h,用40%与80%密度梯度液做非连续密度梯度离心,300g离心8~15 min,去上清;加入0.5~1.0 ml含10%SPS的Quinn’s 1020液,吹打混匀后300g离心5 min,去上清;留约0.2 ml沉淀物,再次加入0.5 ml含10%SPS的Quinn’s 1020液吹打混匀,置37℃、5%CO2、5%O2的饱和湿度培养箱,待授精用。
7.体外受精:卵母细胞在37℃、5%CO2、5%O2的饱和湿度培养箱培养2 h后,将调好的精子用无菌巴氏吸管在远离卵母细胞的地方按照1~3×106/ml的终浓度轻缓注入精子,完成当日配皿组与前日配皿组授精。放回37℃、5% CO2、5%O2的饱和湿度培养箱培养4~6 h。取出Falcon3037授精皿,体视显微镜下将卵母细胞捞出,转移至已过夜平衡的卵裂期培养皿,在倒置显微镜下观察受精情况并记录。
8.胚胎发育的观察(图1):授精日记为D0、D1至D3早8∶00~9∶00观察胚胎发育情况并记录。D3观察结束后将卵裂的胚胎转至已过夜平衡的囊胚期培养皿,D5观察囊胚情况并记录。
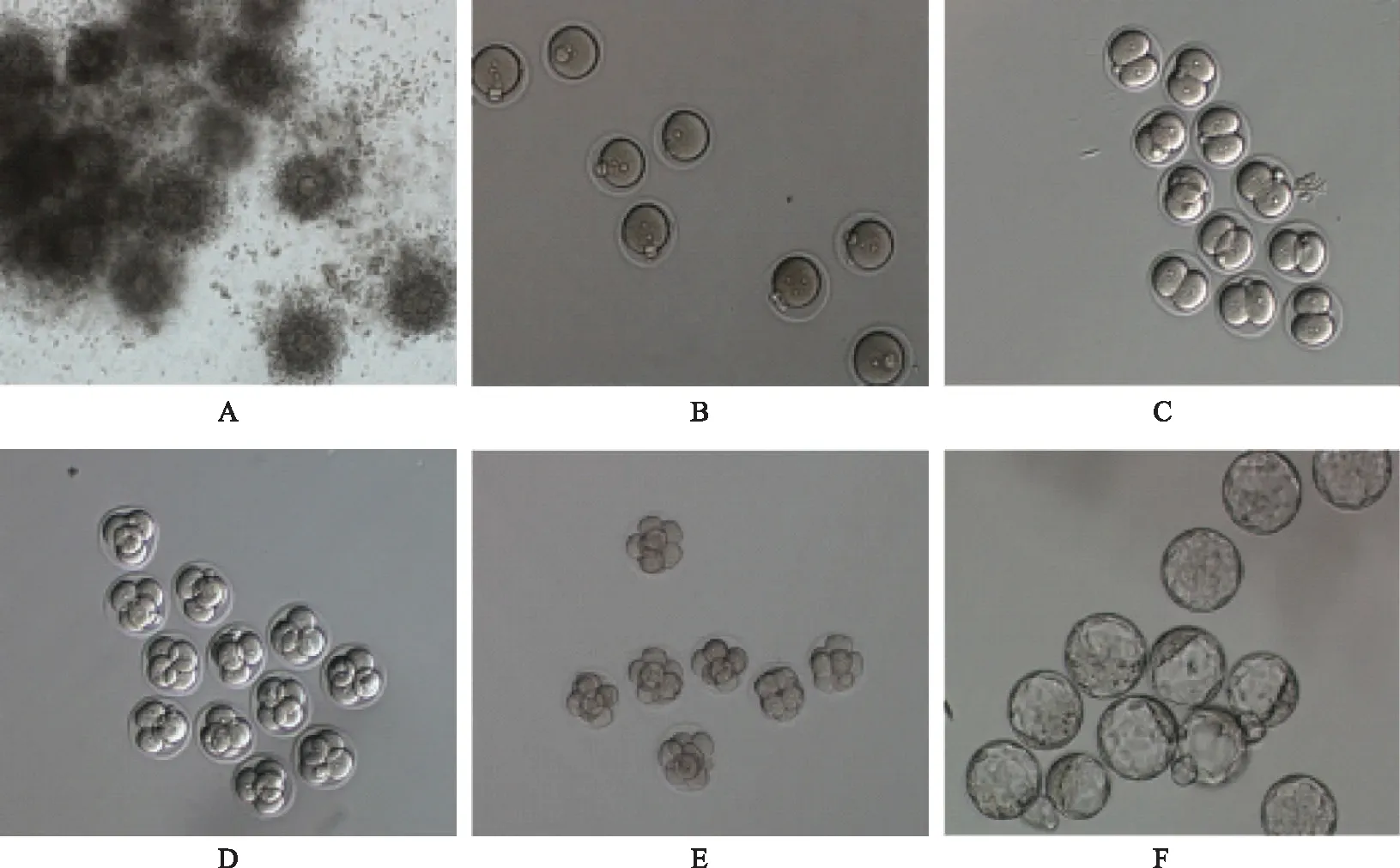
A:划破输卵管壶腹部流出的小鼠卵泡团;B:受精卵;C:2细胞鼠胚;D:4细胞鼠胚;E:8细胞鼠胚;F:小鼠囊胚图1 小鼠卵母细胞及胚胎发育过程(×10)
三、统计学分析
结 果
一、当日配皿组小鼠体外受精胚胎发育情况
当日配皿组共完成124个促排周期,总获卵数为4 731枚,受精率为68.2%(3 227/4 731),卵裂率为97.7%(3 152/3 227),囊胚率为76.7%(2 419/3 152),详见表1。
二、前日配皿组小鼠体外受精胚胎发育情况
前日配皿组共完成80例促排周期,总获卵数为2 683枚,受精率为84.5%(2 266/2 683),卵裂率为99.6%(2 258/2 266),囊胚率为88.8%(2 005/2 258),见表2。
三、不同受精培养液平衡方式对小鼠体外受精及胚胎发育的影响
当日配皿组每促排周期获卵数为(38.7±8.4)枚,前日配皿组每促排周期获卵数为(35.1±6.4)枚,两组间比较无显著性差异(P>0.05)。当日配皿组的受精率、卵裂率和囊胚率分别为68.2%、97.7%和76.7%,均显著低于前日配皿组的受精率、卵裂率和囊胚率(分别为84.5%、99.6%和88.8%)(P<0.01),见表3。
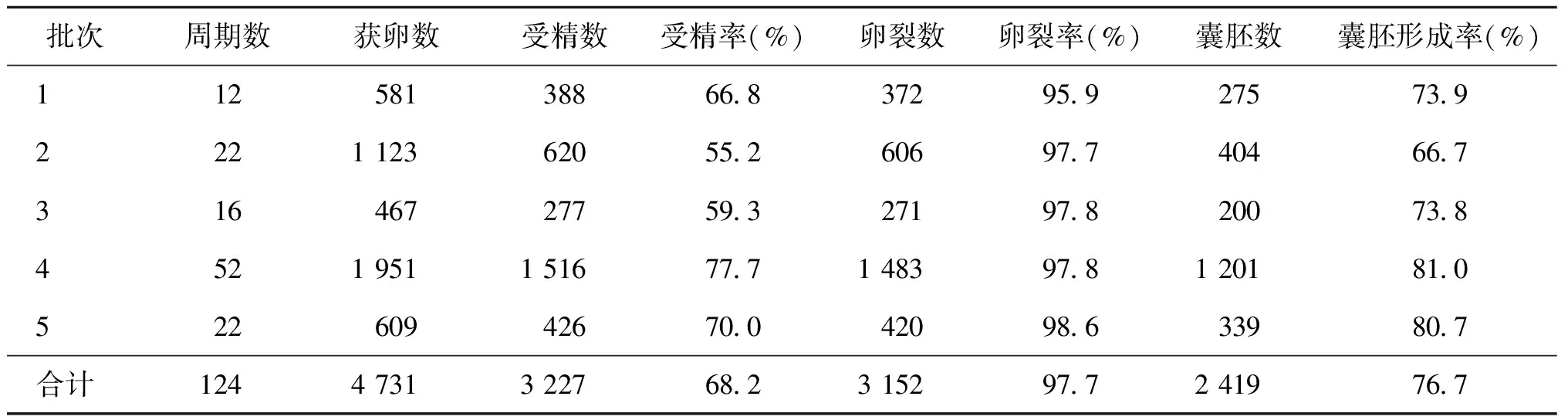
表1 当日配皿组小鼠体外受精胚胎发育情况
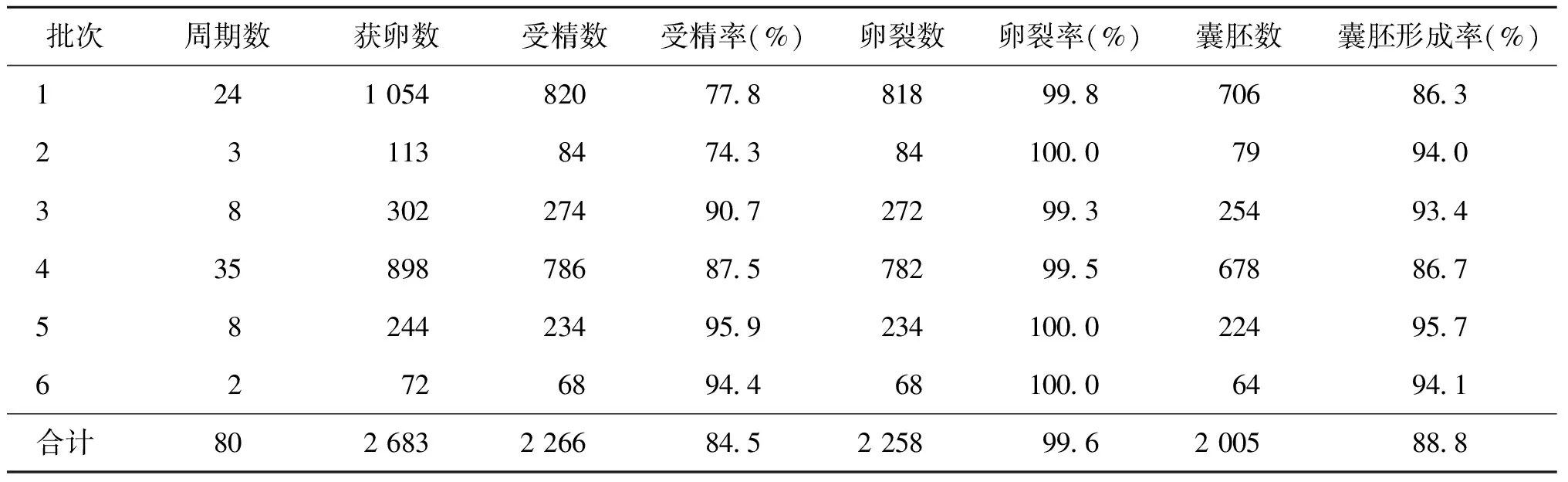
表2 前日配皿组小鼠体外受精胚胎发育情况
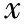
表3 不同受精培养液平衡方式对小鼠体外受精及胚胎发育的比较[(-±s),%]
讨 论
培养液的平衡对卵母细胞、胚胎的体外培养产生很大的影响,其中尤其是PH与渗透压的改变影响最为明显[5]。PH受培养箱中CO2浓度的影响,当培养液从培养箱中取出后,大气中CO2浓度的降低使得受精液中的PH缓冲系统发生改变[6-7],而早期的胚胎发育对PH的波动尤为敏感,同时加上培养液渗透压的不稳定性等因素,更容易给胚胎发育带来极为不利的影响[8-11]。
为了对新建的人类ART胚胎实验室中人类卵母细胞受精液的配制及平衡方式进行前期试验,本研究在配制含10%SPS的Quinn’s 1020培养液后按照先过夜平衡后配皿(当日配皿)与立即配皿再过夜平衡(前日配皿)分为两组进行鼠胚实验,观察含10%SPS的Quinn’s 1020受精液不同的平衡方式对卵母细胞体外受精及胚胎发育的影响。研究结果显示不同的受精液平衡方式对卵母细胞体外受精及胚胎发育具有明显影响,当日配皿组的受精率、卵裂率和囊胚率分别为68.2%(3 227/4 731)、97.7%(3 152/3 227)和76.7%(2 419/3 152)均显著低于前日配皿组的受精率、卵裂率和囊胚率[分别为84.5%(2 266/2 683)、99.6%(2 258/2 266)、88.8%(2 005/2 258)](P<0.01)。我们认为这可能与当日配皿组的受精液虽然在培养箱中平衡过夜,然而次日在配皿过程中,哪怕极短时间内,在缺乏培养油的保护作用下,受精液中的CO2很快逸出,导致PH的波动以及渗透压的改变。通过两组实验结果证明受精液的平衡过程应该采取配液后立即配皿,利用培养油覆盖受精微滴,然后再过夜平衡,这种受精液平衡方式更适合于卵母细胞的体外受精及后期的胚胎发育。因此建议在人类ART的应用过程中,对受精皿的制备采用配皿过夜平衡16~18 h后再使用。有动物实验证明过短的平衡时间会对卵母细胞的受精以及后期的胚胎发育带来不利影响[11]。同时,培养油覆盖受精液可以给胚胎更加稳定的培养环境,但无论何种情况下培养皿都不应过久的在脱离培养箱环境下进行操作[12],在捡卵、授精以及胚胎发育观察过程中,应尽快结束操作,减少PH、渗透压以及温度等的波动对卵母细胞及胚胎带来的不利影响[13-15]。
综上所述,胚胎实验室内受精液的平衡方式对昆明小白鼠卵母细胞的受精及胚胎发育可产生显著影响。本研究明确了卵母细胞和胚胎培养皿的配制方式,同时也提示将来在人类胚胎实验室中,应该在配备温度计等的基础上增加PH与渗透压检测仪,并将胚胎培养液的PH与渗透压纳入实验室的质量控制中,探求不同培养液最佳的PH,这会给配子及胚胎提供一个更加安全、稳定的培养体系,以期给更多的不孕不育患者提供更加优质的胚胎,令患者在不断发展的辅助生殖技术中受益。本研究验证了当地新的生殖中心胚胎实验室的质量控制,为桂东南地区人类ART技术的开展奠定了研究基础。

