精子DNA碎片对体外受精-胚胎移植妊娠结局的影响
谭志国,孙健,张丹,冯娜,黄卫东
(新疆佳音医院生殖医学中心,乌鲁木齐 830001)
在男性不育的检查中,精液常规分析目前仍是评估男性不育的重要参考指标,但精液常规分析不能全面地反应精子的质量和功能。在胚胎发育过程中,精子会向胚胎提供一半的遗传物质,其染色质结构的正常与否对精子的受精能力、胚胎的发育以及后期的临床妊娠起着重要的作用[1]。精子DNA碎片(sperm DNA fragmentation,SDF)是精子发生过程中产生的一种正常产物,含量在正常精子核遗传物质中所占比例较小,如果精子在发生过程中受到外界有害因素干扰,则会导致SDF的含量急剧增多,影响男性的生育能力[2]。精子DNA完整性的评估指标为DNA碎片指数(DNA fragmentation index,DFI),本研究旨在研究接受辅助生殖治疗夫妇的男性SDF程度对IVF-ET过程中受精、卵裂、胚胎发育潜能及妊娠结局的影响。
资料与方法
一、研究对象与分组
收集2016年10月至2018年12月在新疆佳音医院生殖医学中心进行辅助生殖治疗的不育夫妇为研究对象,男女双方排除辅助生殖禁忌证和染色体异常。纳入标准:(1)女方年龄<37岁;(2)女方抗苗勒氏管激素(AMH)>1.1 ng/ml,取卵当日获卵数>5个;(3)女方因输卵管因素导致不孕;(4)最终助孕方案为IVF;(5)第3天移植日有新鲜卵裂期胚胎移植。排除标准:(1)男方精液检查少精子症、弱精子症及畸形精子症患者;(2)冻胚移植和新鲜囊胚移植病例。
共有1 041对夫妇(共1 041个周期)纳入该研究,根据男方入院时生育力评估检测的DFI值,将研究对象分为4组:DFI<10%组(n=277)、10%≤DFI<20%组(n=480)、20%≤DFI<30%组(n=183)及DFI≥30%组(n=101)。
二、研究方法
1.精液采集与分析:男方禁欲2~7 d,手淫法取精,待精液液化后,按世界卫生组织(WHO)《人类精液检查与处理实验室手册》第5版标准进行观察分析计数,根据计数的精液浓度,取一定量精液稀释至100 μl,调整精子浓度为1~2×106个/ml。
2.精子DFI的检测:采用精子染色质结构分析(sperm chromatin structure assay,SCSA),精子DNA碎片检测试剂盒由浙江星博生物科技有限公司提供,试剂盒组成包括:A液、B液、C1液、C2液(含吖啶橙)。在流式细胞仪(FACSCalibur,BD公司,英国)的进样管中加入100 μl精液与A液的混合液后,加200 μl B液混匀,30 s后立即添加600 μl染色液(C1+C2液)混匀,上样,系统数据收集5 000个精子自动停止,完成检测。
3.精液处理方法:取卵当日精液处理方法为密度梯度离心加上游法,胚胎培养试剂及精液处理试剂均为SAGE公司商品化试剂,患者取卵当日手淫取精,精液于37℃培养箱中液化后,镜下观察并记录精液常规,分别取80%梯度试剂和40%梯度试剂各1.5 ml,加入15 ml离心管内使之形成界面清晰的两层,再加入1.5~3.0 ml液化后的精液,100g离心20 min后,沉淀混匀后100g5 min离心2次,收集精子沉淀后于培养箱中上游待用。
4.IVF、胚胎观察与移植:卵母细胞受精时间为绒毛膜促性腺激素(HCG)注射后约39 h,4 h后拆卵观察是否有第二极体排出,次日晨观察胚胎原核并进行原核评分,镜下见原核确定受精。第3天进行胚胎观察分级,正常受精即原核观察时为2原核者;细胞数7个以上,卵裂球大小均匀,细胞碎片在0~10%之间为Ⅰ级胚胎,即优质胚胎。移植当日酌情选择胚胎移植。
5.观察指标:MⅡ卵率=MⅡ卵数/获卵数×100%;受精率=(2原核卵母细胞数+1原核卵母细胞数+多原核卵母细胞数+未见原核卵裂卵母细胞数)/IVF受精卵母细胞总数×100%;卵裂率=卵裂胚胎数/受精卵母细胞数×100%;优质胚胎率=D3优质胚胎数/正常受精卵裂胚胎数×100%;临床妊娠率=临床妊娠周期数/移植周期数×100%;流产率=流产周期数/临床妊娠周期数×100%。
三、统计学处理
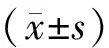
结 果
一、4组患者的基本情况比较
统计结果显示,4组间的男性DFI值差异有统计学意义(P<0.05);DFI≥30%组女方年龄显著高于DFI<10%组(P<0.05);各组间的AMH值及胚胎移植数比较均无显著性差异(P>0.05)(表1)。
二、各组获卵数及胚胎发育情况比较
不同研究组间,患者获卵数、MⅡ卵率及卵裂率比较差异无统计学意义(P>0.05);4组的受精率比较,10%≤DFI<20%组最低,显著低于DFI<10%组和20%≤DFI<30%组(P<0.05),但与DFI≥30%组的差异无统计学意义(P>0.05);优质胚胎率随DFI升高而降低,DFI<10%组显著高于10%≤DFI<20%组及DFI≥30%组(P<0.05),与20%≤DFI<30%组相比差异无统计学意义(P>0.05)(表2)。
表1 各组患者基本情况比较(-±s)
表2 各组患者获卵数及胚胎发育情况比较[(-±s),%]
三、各组患者妊娠结局比较
统计结果表明,4组患者的临床妊娠率及流产率比较差异均无统计学意义(P>0.05)(表3)。
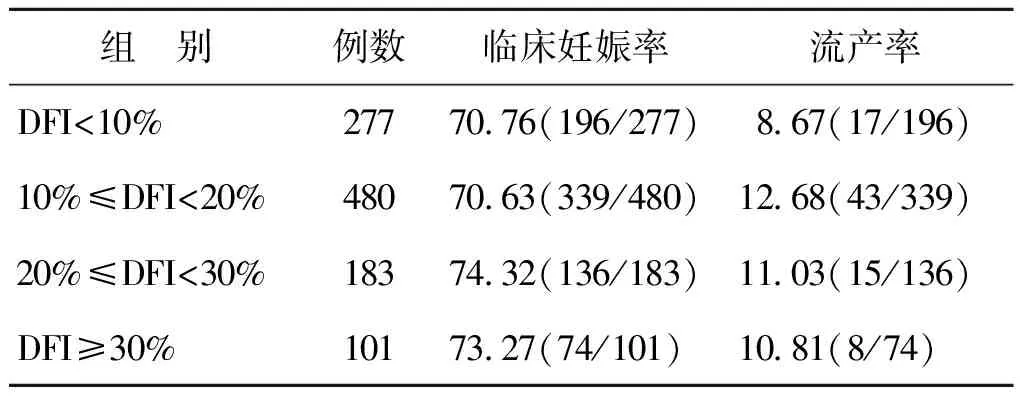
表3 各组患者妊娠结局比较(%)
讨 论
早在1999年,Evenson等[3]就提出利用SCSA检测精液样本对生育的预测作用,并认为对那些没能获得妊娠的夫妇而言,这是一个可利用的预测指标。目前,关于SDF的研究众多,但不同的研究者采用不同的检测方法,每种诊断方法的检测目的不同,虽然一些诊断方法之间有一定的相关性,但仍缺乏明确的、有说服力的临床参考值[4],研究结果缺乏再现性[5],使得SDF对胚胎受精、发育以及最终妊娠结局的影响一直存在争议。Carlini等[6]在一项针对意大利反复流产夫妇的研究中,利用转移酶介导的三磷酸脱氧鸟苷-生物素刻痕末端标记(Transferase-mediated deoxyuridine triphosphate-biotin nick end labeling,TUNEL)评估SDF,发现反复流产的夫妇中男性精液SDF值水平与不育组相似,明显高于正常生育的对照组,但其认为不能单纯以SDF作为反复流产风险的预测指标。Oleszczuk等[7]认为当DFI达到40%或更高时,流产率会明显上升,精子DNA检测可以作为选择辅助生殖技术(ART)受精方式的方法,因为对于高DFI的患者,卵胞浆内精子注射(ICSI)可能是更好的治疗方法。Kamkar等[8]采用SCSA法和TUNEL法检测反复流产夫妇男性的SDF,同时检测精液中自由基和抗氧化剂水平,认为精液的DFI、自由基和抗氧化剂水平与反复自然流产有明显的相关性。Oehninger等[9]则认为,将DNA碎片分析作为主要的诊断和筛查工具为时尚早。但随着研究的深入,相信随着时间的推移以及更多数据的支持,研究者对于精子SDF的预测价值会有一个确定的结论[10]。
本研究显示各组间女性患者获卵数、MⅡ卵率比较无显著性差异,10%≤DFI<20%组受精率最低,与DFI<10%组和20%≤DFI<30%组相比有显著性差异,这与文献中精子DFI值影响受精结果[11]、顶体酶活性[12]及精子透明质酸结合能力[13]的结论相反,推测这可能与纳入统计的数据量有关。Casanovas等[14]研究认为,即使DNA损伤不能在短时间内修复,胚胎分裂亦可进行,所以各组间卵裂率无明显差异,但双链的损伤会延续,导致染色体碎片的拆分、重排或复杂重排。虽然本研究中DFI<10%组与20%≤DFI<30%组相比,优胚率无明显差异,这可能与纳入研究的数据量有关,但各组间优质胚胎率随着DFI的升高而降低。因为即使精子存在DNA损伤,也同样能够使卵母细胞受精,当损伤的DNA融合入胚胎的基因组后,会导致复制和转录错误,导致不同胚胎阶段遗传物质的畸变[15]。虽然有研究认为SDF的升高会对妊娠结局产生不良影响[16],但本研究显示,各组间的临床妊娠率和流产率无显著性差异,这可能与移植时选择优质胚胎及移植胚胎数有关,也可能与患者年龄较小有关。
本研究的局限在于影响男性精子DFI值的因素较多,如精索静脉曲张[17]、超负荷的运动[18]、减肥[19]、禁欲时间[20]等,尤其是禁欲时间。Brandley等[21]认为,对于DFI高的患者,通过重复射精后再检测其DFI值,可能会出现DFI值下降的现象。本研究并未对患者的禁欲时间进行比较,如果能在取卵当日明确其禁欲时间同时检测其精液DFI值,就能更有效地证明DFI值与胚胎质量及妊娠结局的关系。另外,本研究纳入的研究对象为移植日有优质胚胎的人群,对于那些无优质胚胎移植的患者,是否存在更明显的DFI值变化趋势,仍需进一步研究。
综上所述,本研究认为对于年龄小于37岁、接受IVF的女性患者,优质胚胎率会随着DFI的升高而降低,而DFI对于临床妊娠和流产尚未见明显影响。但鉴于研究对象的纳入和选择限制,仍需要扩大样本量,将研究人群和对象覆盖的更广泛,以期得到更可靠的研究结论。

