内镜下黏膜剥离术与黏膜切除术治疗早期胃癌的临床对照研究
吕培标 李兴华 王志发 李祥兴 刘 洁 李 俊
1.中山大学附属第三医院粤东医院普通外科,广东梅州 514000;2.中山大学附属第三医院粤东医院消化内科,广东梅州 514000
内镜下黏膜剥离术(ES D)是建立在内镜下黏膜切除术(EMR)基础上的[1-2]。EMR 起源于1973年,Dyhie 等采用黏膜下生理盐水切除结肠无蒂息肉,随着技术不断发展,1984 年多田正弘将此项技术诊治早期胃癌,1994 年Takekoshi 等将陶瓷绝缘头的新型电刀应用于临床,1999 年日本Gotoda 等将陶瓷绝缘头的新型电刀应用于病变切除,发展成为ESD[3-4]。我国2006 年复旦大学附属中山医院首次将ESD 引入临床,目前鲜有ESD 在梅州地区早期胃癌患者应用的报道[5-6]。笔者通过分析2016年4 月~2018 年4 月我院收治的早期胃癌患者临床资料,拟探讨ESD 与EMR 治疗早期胃癌(EGC)的效果差异,现报道如下。
1 资料与方法
1.1 一般资料
选 取2016 年4 月~2018 年4 月 我 院 收 治的60 例早期胃癌患者临床资料进行回顾性分析,依据手术方式不同进行分组,内镜下黏膜切除术(EMR)组30 例,男17 例,女13 例,年龄33 ~75岁,平均(55.4±10.6)岁,肿瘤位置:胃窦15 例,贲门胃底10 例,胃角部5 例,肿瘤大小11 ~34mm,平均(19.5±8.4)mm,内镜下黏膜剥离术(ESD)组30 例,男16 例,女14 例,年 龄34 ~76 岁,平均(56.8±11.2)岁,肿瘤位置:胃窦14 例,贲门胃底9 例,胃角部7 例,肿瘤大小12 ~33mm,平均(19.0±8.0)mm,纳入标准:(1)通过内镜检查结合组织病理学检查,确诊为早期胃癌患者[7-8];排除标准:(1)排除其他类型恶性肿瘤患者;(2)排除凝血功能障碍者;(3)排除严重心、肝、肾功能障碍者。本研究在我院伦理委员会批准下进行,两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
EMR:(1)做好标记:通过内镜观察病变部位,确认病灶侵犯位置,如病灶只是侵犯黏膜层,在病灶周围5mm 位置,通过凝固电流多点黏膜电灼,以电灼白点作为标志;(2)黏膜下注射液体:确认病灶范围,黏膜下注射下液体,如肾上腺素混合美蓝、生理盐水,每个标记位置注射液体2mL,以病变位置粘膜呈现均匀隆起为止;(3)切除术治疗:透明帽辅助黏膜切除术适用于广基息肉或者是平坦类型病灶,将病灶黏膜吸附在透明帽内,通过收紧圈套器套住病灶黏膜,将套住的病变黏膜,从透明帽推出,给予高频电流将病变切除。圈套器切除可以治疗表面隆起病灶,等到高频电流圈套器释放,将隆起的病灶套住,收紧圈套器,进行电凝切割;(4)做好创面处理:如病变位置有出血或者病变残留,采用热活检钳进行凝固治疗;(5)进行标本固定,送检病理科[9-10]。
ESD:(1)确定病灶范围、性质、浸润深度:对病变范围和深度进行常规性内镜检查,主要观察病灶所在位置、大小、形态,并且结合染色结果,对病灶局部放大,对病灶具体特点进行确定。(2)标记病灶:在距离病灶边缘3 ~5mm 的位置进行电凝标记。(3)黏膜下方的注射:病灶边缘标记的位置外侧,做多点黏膜下注射,注射液体可以采用生理盐水、甘油果糖、透明质酸钠。抬起病灶,和肌层分离,这样可以更加完整的将病灶切除,避免固有肌层的损伤,降低穿孔、出血的发生率[11-12]。(4)切开病灶周围黏膜:沿着标记位置外侧缘逐步切开病灶周围部分黏膜,将黏膜下层深入切开,将周围全部黏膜切开。切开的位置在病变远侧端,如果切除过程中有困难,采用翻转内镜法。如果发生出血,注意做好电凝止血。(5)黏膜下剥离:进行黏膜剥离前,对病灶特点进行判定。随着时间推移,黏膜下注射的液体逐步吸收,如果有必要,采用黏膜下注射,保持病灶充分抬举,按照病灶特点,选择适宜的内镜和附件。(6)保持术野清晰:对术野进行剥离过程中,如果病灶很难暴露,术野不清晰,采用透明帽将黏膜下层结缔组织推开,充分的显露术野。根据病变部位,选择合适的手术器械,做好黏膜下剥离,剥离过程中,注意沿着拉镜或旋镜沿病变基底切线方向,做好剥离。根据患者自身需要,变换患者体位,对病变组织进行牵引垂挂,利于病灶切开和剥离。(7)做好创面处理:病灶剥离之后,对创面上的血管进行预防性止血处理。如果有渗血部位,采用止血钳、氩离子血浆凝固术(APC)进行处理,对局部剥离较深、肌层有裂隙者,采用金属夹夹闭。(8)做好并发症处理:较小的黏膜下层血管,采用直接电凝,较粗的血管,止血钳钳夹后电凝止血。黏膜剥离过程中,如果出血,先采用冰生理盐水冲洗创面,可用APC 或止血钳钳夹进行电凝止血。如果上述止血处理不成功,可以采用金属夹夹闭出血点,注意减少后续黏膜下剥离操作。如果手术过程中出现穿孔,线对裂口进行缝合,然后再进行剥离,也可以先进行剥离,然后再缝合裂口。手术操作时间长,患者可能有大量气体积聚,压力相对较高,较小肌层裂伤可能造成穿孔,要注意对腔内气体进行抽吸。
1.3 观察指标
观察两组患者创面直径、手术时间、胃肠道恢复时间、住院时间情况;观察两组患者病变整块切除率、完整切除率情况;观察两组患者并发症情况主要包括术后出血、术后穿孔、术后6 个月复发率、术后残留率情况,对于术后出血、术后穿孔患者给予补充外科手术治疗。术后6 个月进行患者随访,观察复发率。残留手术结束后采集纵向切缘或者横向切缘周围组织病理结果,进行残留率评价。
表1 两组患者创面直径、手术时间、胃肠道恢复时间、住院时间比较

表1 两组患者创面直径、手术时间、胃肠道恢复时间、住院时间比较
组别 n 创面直径(mm) 手术时间(min) 胃肠道恢复时间(h) 住院时间(d)EMR组 30 18.4±8.7 26.7±7.4 41.7±4.5 38.5±4.5 ESD组 30 50.2±12.3 100.8±22.3 26.8±3.8 27.6±3.4 t 11.562 17.271 13.862 10.593 P 0.001 0.000 0.000 0.001
1.4 统计学处理
采用统计学软件SPSS20.0 建立数据库,计量资料采用t检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者创面直径、手术时间、胃肠道恢复时间、住院时间比较
ESD 组患者创面直径、手术时间高于EMR 组,胃肠道恢复时间、住院时间均低于EMR 组,差异有统计学意义(P<0.05)。见表1。
2.2 两组患者病变整块切除率、完整切除率情况比较
ESD 组患者病变整块切除率、完整切除率均高于EMR 组,差异有统计学意义(P<0.05)。见表2。
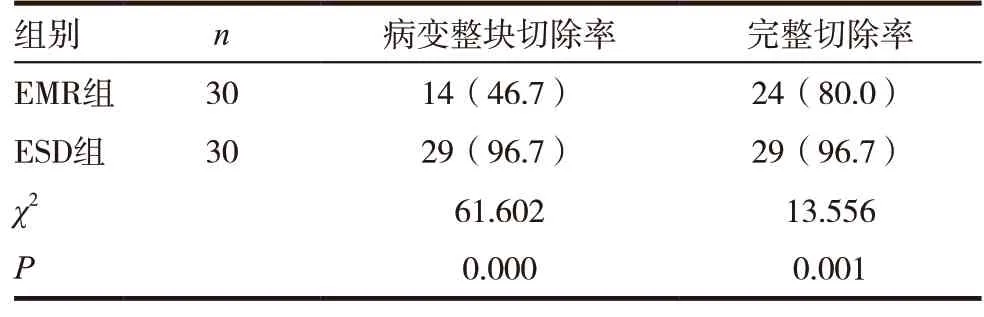
表2 两组患者病变整块切除率、完整切除率情况比较[n(%)]
2.3 两组患者并发症情况比较
两组患者出血、穿孔发生率比较,差异无统计学意义(P>0.05),ESD 组患者复发率、残留率低于EMR 组,差异有统计学意义(P<0.05)。见表3。
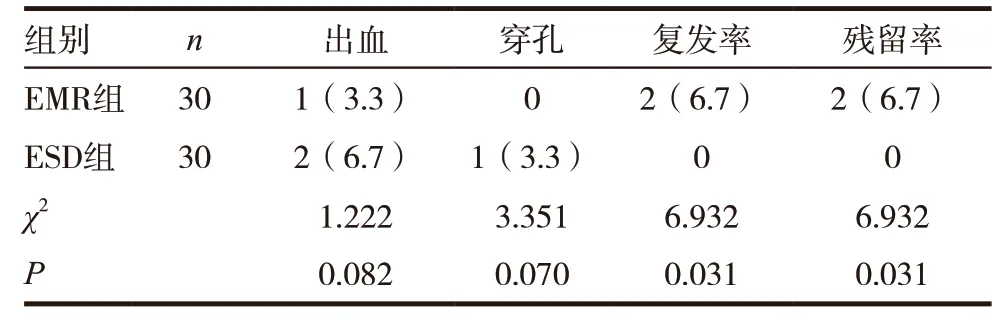
表3 两组患者并发症情况[n(%)]
3 讨论
ESD 是建立在EMR 基础上逐步发展的手术方式,其可以依据病灶不同位置、大小、浸润深度情况,选择有效的电切刀,在内镜观察下,逐步将黏膜层与固有肌层之间的组织进行分离,最后逐步将病变黏膜和黏膜下层进行完整的剥离[13-14]。ESD 手术过程中,可以反复性在黏膜下注射液体,从而维持病灶的充分性抬举,如果术野不是十分清晰,采用透明帽,根据病灶具体特点,选择适宜性的内镜和附件。如术中出血,采用各类切开刀、热活检钳及止血夹进行治疗[15-16]。如切割过程中,要对裸露血管进行观察,并且及时给与预防性止血措施,避免出血的发生。一些溃疡面要在肿瘤切除时,也一并完整切除,做好溃疡面周围血管预防性止血处理。
本研究结果表明,ESD 组患者创面直径、手术时间高于EMR 组,胃肠道恢复时间、住院时间均低于EMR 组,提示笔者根据早期胃癌患者临床特点,根据病灶部位、大小等特点,给予ESD 手术治疗,其创面直径、手术时间虽然稍高于EMR,但是胃肠道恢复时间、住院时间低于EMR,最大限度的保留了正常组织和功能,促进患者术后尽快恢复,利于患者耐受。ESD 组患者病变整块切除率、完整切除率均高于EMR 组,ESD 组患者复发率、残留率低于EMR 组,提示ESD 可以提供完整的组织标本,明确了肿瘤的浸润、分化情况,可以将大面积、形态不规则肿瘤,一次性从固有肌层剥离下来,进而提高了病变整块切除率、完整切除率,这在一定程度上也降低了病灶的复发率和残留率。
综上所述,ESD 治疗早期胃癌患者,病灶切除彻底,预后良好,优于EMR,值得临床推广应用。

