姜黄素通过上调miR-15a/16表达抑制人非小细胞肺癌A549细胞增殖促进细胞凋亡的机制
秦芳 秦淑英 王新森 刘文玉 李伟伟
(1安阳职业技术学院讲师,河南 安阳 455000;2安阳市肿瘤医院放射二科;3濮阳市安阳地区医院普外科;4新乡医学院第一附属医院肿瘤二科)
非小细胞肺癌是肺癌导致的相关性死亡的首要原因,手术治疗、放疗和化疗等是其常用的治疗手段,但效果均不太理想。姜黄素是一种来自姜科植物姜黄等根茎的酚性色素,因其具有毒副作用小和抗癌谱广等优势一直备受肿瘤界学者们的青睐〔1~3〕。有研究〔4,5〕发现,姜黄素可通过上调(miR-15a/16)发挥促乳腺癌凋亡和抗白血病细胞增殖的作用。已研究〔6~8〕证实,miR-15a/16在非小细胞肺癌组织中低表达,并且姜黄素可抑制非小细胞肺癌A549细胞的增殖,并诱导细胞凋亡,但姜黄素的抗肿瘤作用是否通过调控miR-15a/16表达来执行尚不清楚。本研究旨在探讨miR-15a/16在姜黄素抑制人非小细胞肺癌A549细胞增殖及促凋亡过程中的作用及机制。
1 材料与方法
1.1试剂 杜尔贝科改良伊格尔培养基(DMEM)培养基、胎牛血清和胰蛋白酶购于美国GIBCO公司,姜黄素和噻唑蓝(MTT)试剂购于美国Sigma公司,Trizol和Lipofectamine2000购于美国Invitrogen公司,miR-15a/16模拟物及对照、miR-15a/16抑制剂及对照购于美国RiboBio公司,双荧光素酶报告质粒购于上海吉玛公司,细胞周期蛋白(CyclinD1)抗体、B淋巴细胞瘤(BCL)2抗体、甘油醛-3-磷酸脱氢酶(GAPDH)抗体和辣根过氧化氢酶标记的二抗均购于美国Santa Cruz公司。聚偏氟乙烯(PVDF)膜购于美国Pall公司,总RNA提取试剂盒、逆转录试剂盒、总蛋白提取试剂盒、TUNEL-DAPI双染试剂盒和Caspase 3活性检测试剂盒均购于上海碧云天生物技术研究所,双荧光素酶活性检测试剂盒购于美国Promega公司。
1.2方法
1.2.1细胞培养 A549细胞购于中国科学院细胞库,采用DMEM培养基(含10%胎牛血清)于培养条件为饱和湿度、5%CO2和37℃细胞培养箱内常规培养。待A549细胞汇合度达85%以上时,以0.25%胰蛋白酶消化,按照1∶3比例传代。收集长势良好的第4代对数生长期细胞进行实验。
1.2.2MTT法检测细胞增殖 将A549细胞以每孔200 μl(浓度为6×105个/ml)接种于96孔细胞板上,于培养箱中贴壁培养过夜后,加入终浓度分别为0.0、12.5、25.0、50.0 μmol/L姜黄素处理A549细胞,并标记为对照组(0.0 μmol/L姜黄素)、姜黄素12.5 μmol/L组、姜黄素25.0 μmol/L组和姜黄素50.0 μmol/L组,每个处理组设置6个平行孔。于培养箱内孵育48 h后,加入40 μl浓度为5 mg/ml的MTT溶液,孵育4 h。弃上清后,加入200 μl的二甲基亚砜,震荡反应10 min。待紫色结晶充分溶解后,选取490 nm波长,以酶联免疫检测仪检测各孔细胞的光密度值(A)。根据细胞存活率=100%×(处理组A/对照组A)计算各处理组细胞的细胞存活率。实验重复3次,取均值。
1.2.3Caspase3活性检测 收集以0.0、12.5、25.0、50.0 μmol/L姜黄素处理48 h后A549细胞,以1 000 r/min离心弃上清后,加入细胞裂解液,参照Caspase3活性检测试剂盒操作步骤检测各浓度姜黄素处理下A549细胞的Caspase3活性。
1.2.4RT-PCR检测miR-15a/16表达 经0.0、12.5、25.0、50.0 μmol/L姜黄素处理48 h后,收集A549细胞,以总RNA提取试剂盒获取总RNA,并以1 μg总RNA为模板,采用逆转录试剂盒合成cDNA。以4.0 μl cDNA、各1.0 μl浓度为10 μmol/L的正反引物、1 μl ROX Reference Dye Ⅱ、25 μl 2×SYBR Premix Ex Taq和18 μl ddH2O配成50 μl反应体系,进行PCR扩增:94℃ 预变性 5 min,1个循环;95℃变性 15 s、58℃ 退火30 s、72℃ 延伸30 s,40个循环;以U6为内参,2-△△Ct法检测不同浓度姜黄素处理下A549细胞中miR-15a/16的相对表达量。PCR扩增引物由上海生工生物合成,各基因引物序列:miR-15a:上游:5′-GCGGTAGCAGCACATAATG-3′,下游:5′-GTGCAGGGTCCGAGGT-3′;miR-16:上游:5′-UAGCAGCACGUAAAUAUUGGCG-3′,下游:5′-C-CAAUAUUUACGUGCUGCUAUU-3′;U6:上游:5′-CT-CGCTTCGGCAGCACA-3′,下游:5′-AACGCTTCACG-AATTTGCGT-3′。
1.2.5细胞转染 取对数生长期的A549细胞,以200 μl(浓度为6×105个/ml)接种至6孔细胞板上,于细胞培养箱中培养过夜。待细胞密度达70%以上时,开始进行瞬时转染。将细胞分为对照组(未处理)、姜黄素组(给予50 μmol/L姜黄素)、anti-NC+姜黄素组(转染抑制剂阴性对照后,给予姜黄素处理)、anti-miR-15a+姜黄素组(转染miR-15a抑制剂后给予姜黄素处理);anti-miR-16+姜黄素组(转染miR-16抑制剂后给予姜黄素处理)。根据Lipofectamine2000说明书步骤将抑制剂阴性对照、miR-15a抑制剂和miR-16抑制剂分别转染至A549细胞中。待转染24 h后,加入浓度为50 μmol/L姜黄素处理48 h。并设置未经转染也未经姜黄素处理的对照组和未经转染只给予50 μmol/L姜黄素处理的姜黄素组。采用RT-PCR检测各处理组中miR-15a和miR-16的相对表达量。MTT法检测各组细胞的活力。具体步骤参照1.2.4和1.2.2。
1.2.6流式细胞仪检测细胞周期 收集上述瞬时转染miR-15a抑制剂、miR-16抑制剂和阴性对照并给予姜黄素处理的各组细胞及对照组和姜黄素组的细胞,以磷酸缓冲液洗涤后,1 000 r/min离心弃上清。加入预冷的乙醇(浓度为70%)于4℃下对细胞进行固定。离心后,以胰蛋白酶消化,加碘化丙啶染色后,上流式细胞仪进行检测。实验重复3次。
1.2.7TUNEL-DAPI双染检测细胞凋亡 以适当密度将对数生长期的A549细胞接种6孔细胞板(放有无菌盖玻片),培养至细胞贴壁后,按照1.2.5中的方法转染和给予姜黄素处理后,离心弃培养液,在20℃条件下以浓度为4%甲醛对各处理组细胞进行固定。固定结束后,用磷酸缓冲液洗涤细胞。参照TUNEL-DAPI双染试剂盒说明书步骤,加入TUNEL反应液,并以3%H2O2充分固定。磷酸缓冲液洗涤后,加入0.1% TritonX-100于4℃下充分反应。再次洗涤后,于37℃下避光加入TUNEL反应液作用1 h后,加4′,6-二脒基-2-苯基吲哚二盐酸盐(DAPI)染色。采用荧光显微镜检测400倍视野下细胞的凋亡情况,并拍照。
1.2.8双荧光素酶报告基因实验检测miR-15a/16靶基因 Targetscan软件预测发现miR-15a和miR-16均与CyclinD1和BCL2 的3′-非编码区(UTR)存在结合位点。为了验证miR-15a和miR-16与CyclinD1和BCL2是否存在靶向关系,取对数生长期的A549细胞,以适当密度接种至24孔板上,于培养箱内常规培养24 h后,将细胞分为阴性对照组+CyclinD1野生型(BCL2野生型),miR-15a模拟物(miR-16模拟物)+CyclinD1野生型(BCL2野生型),anti-NC+CyclinD1野生型(BCL2野生型),anti-miR-15a(anti-miR-16)+CyclinD1野生型(BCL2野生型)。按照Lipofectamine 2000说明书步骤分别转染CyclinD1野生型(BCL2野生型)报告质粒分别与miR-15a模拟物(miR-16模拟物)或miR-15a抑制剂(miR-16抑制剂)、模拟物阴性对照或抑制剂阴性对照进行共转染,实验设置3个重复。转染48 h后,根据双荧光素酶报告基因检测试剂盒检测各组细胞中双荧光素酶的活性。其中,将阴性对照组的荧光素酶活性设为1,并以海肾荧光素酶活性作内参对目的基因的荧光素酶活性进行标化。
1.2.9Western印迹检测CyclinD1和BCL2蛋白表达 A549细胞处理后,参照总蛋白提取试剂盒提取各处理组细胞中的总蛋白,并采用二喹啉甲酸(BCA)蛋白检测试剂盒测定蛋白的浓度。取蛋白样品80 μg,加入等体积上样缓冲液,于沸水浴中变性3~5 min。上样至十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶中电泳分离后,采用湿转仪进行转膜。转PVDF膜结束后,放入含5%的脱脂牛奶的封闭液中处理2 h。CyclinD1一抗的稀释比例为1∶800,BCL2和GAPDH一抗的稀释比例均为1∶1 000。 4℃下,将封闭后的PVDF膜与一抗反应24 h后,于37℃下加入1∶2 000倍稀释的二抗,震荡反应2 h后,加入化学发光剂显影曝光,凝胶成像系统扫描分析。
1.3统计学分析 采用SPSS22.0软件进行方差分析,两组间比较采用t检验。
2 结 果
2.1姜黄素抑制A549细胞增殖促进细胞凋亡 以0.0、12.5、25.0和50.0 μmol/L姜黄素处理48 h后,MTT检测发现A549细胞的存活率依次降低,姜黄素能够呈浓度依赖地抑制A549细胞增殖(P<0.05)。进一步检测凋亡相关指标Caspase3活性发现,12.5、25.0和50.0 μmol/L姜黄素作用后,A549细胞的Caspase3活性较对照组均明显升高,姜黄素能够呈浓度依赖地诱导A549细胞中Caspase3活性增加(P<0.05)。见表1。

表1 姜黄素对A549细胞活力和Caspase3活性的影响
与对照组比较:1)P<0.05,表2同
2.2姜黄素呈浓度依赖地诱导A549细胞中miR-15a/16的表达 RT-PCR检测0、12.5、25和50 μM姜黄素处理48 h后A549细胞中miR-15a/16的相对表达量依次升高。与对照组相比,miR-15a/miR-16的表达水平差异均有统计学意义(P<0.05),且表现出一定的姜黄素浓度依赖性。见表2。

表2 姜黄素对A549细胞中miR-15a/16表达的影响
2.3下调miR-15a/16可逆转姜黄素对A549细胞增殖的抑制 姜黄素处理后A549细胞中miR-15a和miR-16的表达水平较对照组均明显升高(P<0.05),转染阴性对照未能改变姜黄素诱导的miR-15a和miR-16的表达(P>0.05),但转染miR-15a和miR-16抑制剂后,姜黄素诱导的miR-15a和miR-16的表达均明显受到抑制(P<0.05)。MTT检测发现,姜黄素处理后A549细胞存活率较对照组明显减弱(P<0.05),转染阴性对照对姜黄素处理下A549细胞存活率无显著影响(P>0.05),而转染miR-15a和miR-16抑制剂后,能够明显逆转姜黄素对A549细胞增殖的抑制(P<0.05)。流式细胞仪检测发现,与对照组相比,姜黄素能够使A549细胞在G1期所占比例明显升高(P<0.05),而S期所占比例明显降低(P<0.05);转染阴性对照不影响上述姜黄素对A549细胞的作用(P>0.05),而miR-15a和miR-16抑制剂能够明显逆转姜黄素引起的G1期比例明显降低、S期比例明显升高(P<0.05)。见表3。

表3 下调miR-15a/16对姜黄素作用下A549细胞增殖的影响
与对照组比较:1)P<0.05;与anti-NC+姜黄素组比较:2)P<0.05
2.4下调miR-15a/16可逆转姜黄素对A549细胞凋亡的诱导作用 TUNEL-DAPI双染色结果发现,姜黄素处理后,TUNEL阳性细胞比例较对照组明显升高(P<0.05);转染阴性对照后,TUNEL阳性细胞比例与姜黄素处理组无明显差异(P>0.05),而转染miR-15a和miR-16抑制剂后,TUNEL阳性细胞比例较姜黄素处理组明显降低(P<0.05)。进一步检测各处理组中Caspase3相对活性发现,姜黄素处理后A549细胞中Caspase3活性较对照组明显升高(P<0.05),转染阴性对照未能改变姜黄素对Caspase3活性的影响(P>0.05),但转染miR-15a和miR-16抑制剂后,姜黄素诱导的Caspase3活性明显受到抑制(P<0.05)。见图1、表4。

图1 下调miR-15a/16对姜黄素诱导的A549细胞凋亡的影响(×200)

表4 下调miR-15a/16对姜黄素诱导的A549细胞凋亡的影响
与对照组比较:1)P<0.05;与anti-NC+姜黄素组比较:2)P<0.05
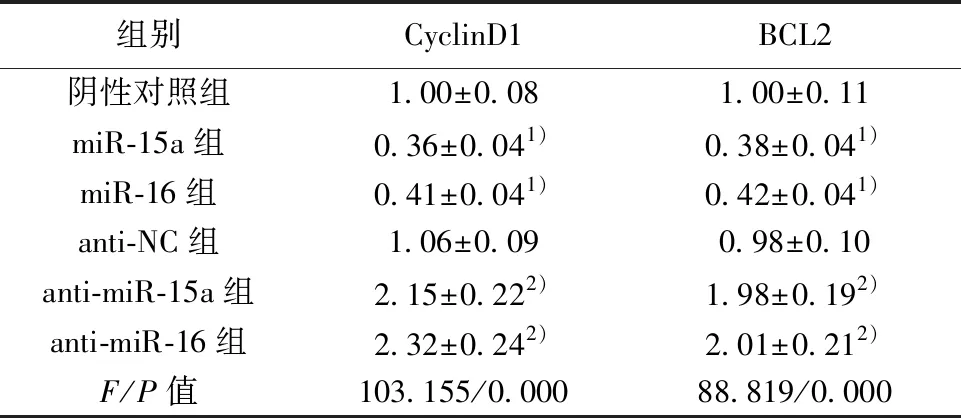
2.5CyclinD1和BCL2是miR-15a/16的靶标 利用Targetscan软件预测发现CyclinD1和BCL2的3′-UTR中含有与miR-15a/16互补的核苷酸序列,见图2A。双荧光素酶报告基因实验结果显示,转染miR-15a模拟物后,CyclinD1和BCL2的荧光素酶活性与相应的阴性对照相比均明显降低(P<0.05);同时转染miR-16模拟物后,CyclinD1和BCL2的荧光素酶活性也明显降低(P<0.05)。反之,转染miR-15a抑制剂后,CyclinD1和BCL2的荧光素酶活性明显升高(P<0.05);转染miR-16抑制剂后,与转染miR-15a抑制剂的结果相一致,CyclinD1和BCL2的荧光素酶活性均显著升高(P<0.05)。进一步检测CyclinD1和BCL2蛋白表达的表达发现,与阴性对照相比,转染miR-15a模拟物能够显著下调CyclinD1和BCL2蛋白表达(P<0.05);反之则上调CyclinD1和BCL2表达(P<0.05);同时,转染miR-16模拟物后CyclinD1和BCL2蛋白的表达也显著下降,反之则明显升高(P<0.05)。见图2B和表5、6。

1~6:阴性对照组、miR-15a组、miR-16组、anti-NC组、anti-miR-15a组、anti-miR-16组图2 miR-15a/16与靶基因CyclinD1和BCL2的结合位点及对靶基因蛋白表达的影响
组别CyclinD1BCL2阴性对照组1.00±0.081.00±0.11miR-15a组0.36±0.041)0.38±0.041)miR-16组0.41±0.041)0.42±0.041)anti-NC组1.06±0.090.98±0.10anti-miR-15a组2.15±0.222)1.98±0.192)anti-miR-16组 2.32±0.242)2.01±0.212)F/P值103.155/0.00088.819/0.000
与阴性对照组比较:1)P<0.05;与anti-NC组比较:2)P<0.05;下表同

表6 miR-15a/16对蛋白表达的影响
3 讨 论
肺癌是导致人类癌症死亡的重要原因,而非小细胞肺癌约占肺癌的85%。miRNAs是一类在机体生长发育、细胞生物学过程和应激反应等中发挥重要作用的非编码RNA,大量研究〔9~11〕证实,非小细胞肺癌的发生发展与miRNAs的异常表达及调控关系密切。miR-15a和miR-16作为miRNAs中的重要成员,在卵巢癌、慢性淋巴细胞白血病和前列腺癌等多种肿瘤组织或细胞中异常低表达,是肿瘤诊断和治疗的分子标记物和靶基因〔12~14〕。在多发性骨髓瘤中,下调miR-15a/16可通过增强CABIN1表达促进肿瘤细胞的增殖〔15〕;而上调miR-15a/16表达可促进人骨肉瘤SOSP-9607细胞凋亡并抑制细胞增殖〔16〕。另外,miR-15a/16的过度表除了抑制了人宫颈癌HeLa细胞的增殖和诱导G1/S细胞周期转变外,还能够显著增强了抗癌药物喜树碱诱导的HeLa细胞自噬和凋亡〔17〕。此外,具有抗肿瘤作用的白藜芦醇和野黄芩苷等均能够通过上调miR-15a/16的表达发挥抑制肿瘤细胞的增殖和诱导癌细胞凋亡的作用〔18,19〕。姜黄素是一种研究较多的抗肿瘤药物,其对非小细胞肺癌的进展具有较好的抑制作用,但其抗非小细胞肺癌的机制并不完全清楚〔20〕。有报道〔4,5〕显示,姜黄素可通过上调miR-15a和miR-16表达促进乳腺癌凋亡和抑制白血病细胞增殖,但其抗非小细胞肺癌是否通过上调miR-15a/16表达来执行并不清楚。本研究结果表明,CyclinD1和BCL2是miR-15a/16的靶基因。这一结果与Cai等〔21〕和Zhang等〔22〕报道的miR-15a/16通过直接结合CyclinD1 和BCL2 3′-UTR抑制CCND1和BCL2的转录,进而诱导细胞凋亡和细胞周期阻滞的结果相吻合。综上,姜黄素是一种很有潜力的抗非小细胞肺癌的药物,其通过上调miR-15a/16表达来发挥抗肿瘤的活性可能是其重要的途径之一,miR-15a/16有望成为非小细胞肺癌治疗的重要靶基因。

