高迁移率族蛋白B1促进结肠癌细胞增殖、迁移与侵袭的机制探讨*
王思萱, 龙露叶, 方雪娇, 徐建昕, 钱诗菡, 吕建新
(温州医科大学检验医学院、生命科学学院, 浙江省医学遗传学重点实验室, 浙江 温州 325035)
结直肠癌是位列于肺癌、肝癌和胃癌后的第4种致死恶性肿瘤,每年约70万人死于结肠癌[1],我国结肠癌发病率正逐年上升[2]。近年全球对于结肠癌的筛查技术如大便隐血、基因检测和结肠胶囊内镜等已经逐步推广,成为常规检测项目。研究者们也在开发能替代侵入性结肠镜检查的新型检测方法[1]。
1973年Goodwin等[3]发现一组具有高电泳迁移率的非组蛋白,即高迁移率族(high mobility group,HMG)蛋白,其中包括HMGB、HMGA和HMGN 3个超家族。HMGB1在细胞内是高度保守的DNA伴侣蛋白,而在胞外是一种典型的炎症因子,与细胞因子、趋化因子和生长因子共同发挥作用[4]。近年研究表明,HMGB1不仅参与炎症性疾病进程,还与多种恶性肿瘤细胞的增殖和转移相关[5-7],HMGB1在结肠癌组织中高表达,可促进细胞的增殖转移,但具体的作用机制尚不明确[8]。本项工作通过检测结肠癌细胞和正常结肠上皮细胞FHC中HMGB1的表达情况,体外构建HMGB1表达下调的结肠癌SW620细胞,并分析下调HMGB1表达对SW620细胞增殖、迁移和侵袭能力的影响,以探讨HMGB1在结肠癌发生发展中可能的作用机制。
材 料 和 方 法
1 细胞
人结肠上皮细胞株FHC和结肠癌SW620细胞株均购自中科院上海细胞库。
2 主要试剂
胎牛血清(Lonsera);Matrigel 基质胶(BD);RPMI-1640培养液(Gibco);CCK-8试剂(Dojindo);兔抗c-Myc单克隆抗体、兔抗p-ERK单克隆抗体、兔抗ERK多克隆抗体、兔抗人HMGB1单克隆抗体、兔抗E-cadherin单克隆抗体、兔抗N-cadherin单克隆抗体、兔抗Bax单克隆抗体和兔抗Bcl-2单克隆抗体(Abcam);兔抗人MMP-2/9单克隆抗体(华安生物技术有限公司);鼠抗人GAPDH单克隆抗体(杭州戴格生物技术有限公司);LipofectamineTM3000转染试剂(Invitrogen);QuantiFast SYBR Green PCR Kit(QIAGEN);无义序列shNC(5’-GTTCTCCGAACGTGTCACGT-3’),shHMGB1(5’-CCCGTTATGAAAG-AGAAATGA-3’)由上海吉玛生物公司合成;HMGB1和GAPDH引物(HMGB1:上游5’-GGCCTTCTTCCTCTTCTGCT-3’,下游5’-GCAACATCACCAATGGACAG-3’;GAPDH:上游5’-GCCAGTGGACTCCACG-AC-3’,下游5’-CAACTACATGGTTTACATGTTC-3’)由Tsingke合成。
3 主要方法
3.1细胞培养 人正常结肠上皮细胞FHC和结肠癌SW620细胞用RPMI-1640培养液(含10%胎牛血清和1%链青霉素)置于37 ℃、5% CO2恒温培养箱中常规培养,2~3 d换液1次。待细胞长至80%~90%密度时,按1 ∶2或1 ∶3传代培养
3.2转染及分组 将SW620细胞消化后接种于6孔板内,每个孔接种3×104个细胞,放置于37 ℃、 5%CO2恒温培养箱培养24 h后,根据Lipofectamine 3000试剂盒说明书的转染试剂配比,将含5 μg目的质粒的稀释液加入含有3.75 μL Lipofectamine 3000的稀释液中混匀,室温孵育5~10 min后加入6孔板孵育,2 d后更换完全培养液,荧光显微镜下观察细胞转染效率,通过G418筛选14 d构建稳定shHMGB1和shNC组细胞。本实验分组情况:空白对照组(blank组,未做任何处理的SW620细胞)、阴性对照组即shNC组(转染shNC质粒的SW620细胞)和HMGB1低表达组即shHMGB1组(转染shHMGB1质粒的SW620细胞)。
3.3qPCR检测基因表达 TRIzol法提取细胞RNA,逆转录为cDNA。qPCR采用20 μL体系进行扩增。以GAPDH为内参照,采用 2-ΔΔCt法计算基因相对表达量,对比不同组基因在转录水平的差异,ΔCt =Ct(目的基因)-Ct(内参基因),ΔΔCt=ΔCt(样本)-ΔCt(对照组)。
3.4细胞活力实验 采用CCK-8法检测稳定结肠癌SW620细胞活力。取对数生长期细胞,将细胞按每孔5×103个接种于96孔板。细胞贴壁后,每组3个复孔,在常规培养0、24、48、72和96 h后,加入CCK-8溶液每孔10 μL,37 ℃孵育1 h,用酶标仪检测450 nm处吸光度值(A值),实验独立重复3次。
3.5平板集落形成实验 取对数生长期细胞消化,按每孔500个接种于6孔板,每组3个复孔。常规培养14 d,出现肉眼可见集落后,无水甲醇固定20 min,去除固定液后加入结晶紫染色15 min,去除染色液后沿壁加入蒸馏水轻柔洗脱染色液,静置干燥。肉眼计数细胞集落数,以集落形成率表示细胞生长情况,集落形成率(%)=集落个数/接种细胞数×100%。
3.6细胞迁移实验 采用Transwell法,在小室上室加入200 μL以无血清培养液重悬的细胞悬液,细胞数每孔1×105个,下室加入600 μL含20%FBS的RPMI-1640培养液,于37 ℃下培养48 h,用4%多聚甲醛固定细胞20 min,结晶紫溶液染色15 min,用棉签擦去上室的细胞,显微镜下随机取5个视野拍照(×100)并做相应记录,计算穿过膜后下室表面的细胞数量,重复3次独立实验,比较细胞迁移能力的差异。
3.7细胞侵袭实验 采用Transwell法,使用10% Matrigel包被小室上室,随后加入200 μL以无血清培养液重悬的细胞悬液,细胞数每孔1.2×105个,下室加入600 μL含20%FBS的RPMI-1640培养液,于37 ℃下培养48 h,用4%多聚甲醛固定膜下室面的细胞,去除固定液用结晶紫溶液染色15 min,随机取5个视野(×100),计数膜下室表面细胞,重复3次独立实验,比较细胞侵袭能力的差异。
3.8Western blot 将细胞经RIPA细胞裂解液冰上裂解20 min 后,离心收集上清,BCA法检测蛋白浓度,变性,分装后于-80 ℃冻存。以每孔20 μg总蛋白上样,浓缩胶70 V电泳30 min, 分离胶110 V 电泳1.5 h。常规湿法转膜,封闭2 h后加入I抗[抗HMGB1(1 ∶5 000)、c-Myc(1 ∶1 000)、p-ERK(1 ∶1 000)、ERK(1 ∶1 000)、MMP-2/9(1 ∶1 000)、E-cadherin(1 ∶2 000)、N-cadherin(1 ∶1 000)、Bax(1 ∶1 000)、Bcl-2(1 ∶1 000)及 GAPDH(1 ∶1 000)抗体],4 ℃孵育过夜。洗膜后加入II抗(1 ∶1 000)于37℃孵育1h,TBST 漂洗3次,ECL液显影,ImageJ分析软件对蛋白印迹条带进行定量。目的蛋白相对表达量=目的蛋白灰度值/GAPDH灰度值。实验重复3次,取平均值。
4 统计学处理
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(mean±SD)表示,两样本均数比较采用t检验,多组间均数比较采用单因素方差分析。以P<0.05为差异具有统计学意义。所有实验结果均独立重复3次。
结 果
1 正常结肠上皮细胞和结肠癌SW620细胞中HMGB1的表达
qPCR检测结果表明,结肠癌SW620细胞中HMGB1的mRNA相对表达量显著高于正常结肠上皮细胞FHC(P<0.01),见图1A;Western blot结果显示,结肠癌SW620细胞中HMGB1蛋白表达显著高于FHC细胞(P<0.05),见图1B。
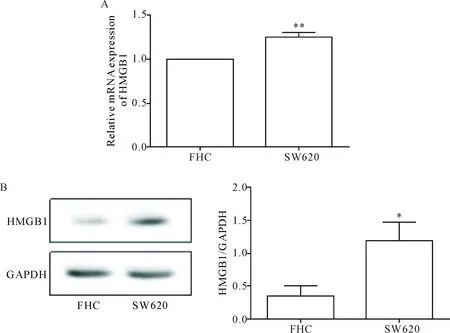
Figure 1.The expression level of HMGB1 in FHC cells and colon cancer SW620 cells. A: the mRNA expression of HMGB1 was detected by qPCR; B: the protein expression was determined by Western blot. Mean±SD.n=3.*P<0.05,**P<0.01vsFHC cells.
图1 在结肠癌SW620细胞与正常人结肠上皮细胞FHC中HMGB1的mRNA和蛋白表达水平
2 构建HMGB1表达下调的SW620细胞株
采用qPCR检测HMGB1的表达量,结果显示shHMGB1组中HMGB1的mRNA表达较blank组和shNC组下降(P<0.05),见图2A;Western blot检测HMGB1的蛋白表达结果显示,与空白对照组和shNC组比较,shHMGB1组蛋白表达显著降低(P<0.01),见图2B。
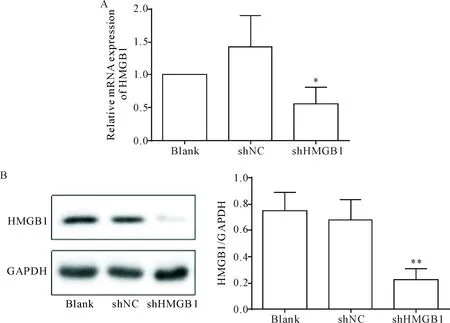
Figure 2.Transfection with shHMGB1 decreased HMGB1 expression in the colon cancer cell line SW620. A: the mRNA expression of HMGB1 was detected by qPCR; B: the protein expression was detemined by Western blot. Mean±SD.n=3.*P<0.05,**P<0.01vsblank group and shNC group.
图2 转染后SW620细胞中HMGB1的mRNA和蛋白表达水平
3 HMGB1表达下调抑制SW620细胞的活力和平板集落形成能力
CCK-8实验结果显示,同blank组和shNC组相比,shHMGB1实验组细胞的A值显著降低,随时间延长,差异逐渐增大(P<0.05),见图3A。平板集落形成实验结果表明,shHMGB1实验组的细胞平板集落形成能力显著降低(P<0.01),见图3B。
4 HMGB1表达下调抑制SW620细胞的迁移和侵袭能力
采用Transwell小室分别检测下调表达HMGB1对SW620细胞迁移和侵袭能力的影响。迁移实验结果表明,blank组和shNC组穿过小室迁移的细胞数分别为(85.2±32.7)和(58.4±3.5)个,shHMGB1组为(19.4±5.7)个,shHMGB1组中穿过小室膜的细胞数显著低于对照组(P<0.01),见图3A。侵袭小室的实验结果显示,shHMGB1组穿过小室的细胞数为(15.9±11.4)个,显著少于blank组的(91.5±40.6)和shNC组的(51.3±4.9)个(P<0.01),见图4B。
5 HMGB1对SW620细胞迁移侵袭及凋亡相关蛋白的影响
Western blot实验结果表明,同blank组和shNC组比较,shHMGB1实验组细胞中侵袭和迁移相关蛋白MMP-2、 MMP-9和N-cadherin表达下调,抗凋亡蛋白Bcl-2表达下调,促凋亡蛋白Bax表达上调(P<0.05),E-cadherin蛋白在3组间表达差异无统计学意义(P>0.05),见图5。
6 HMGB1对ERK/c-Myc信号通路的影响
Western blot结果表明,同blank和shNC组相比,shHMGB1实验组的细胞ERK表达无差异,而p-ERK蛋白表达下调(P<0.05),c-Myc蛋白表达显著低于blank和shNC组(P<0.01),见图6。
讨 论
我国结直肠癌发病率与死亡率分别位居恶性肿瘤中的第3位和第5位[2]。尽管结肠癌的诊疗手段不断改进,但结肠癌的转移与复发仍严重影响患者预后及术后生活质量。寻找有效的治疗靶点以提高患者生存质量或将成为结肠癌治疗新的突破点[9-10]。MAPK/ERK信号通路可通过蛋白泛素化和降解参与肿瘤的发生发展,且在肿瘤细胞增殖与侵袭过程中通路相关蛋白异常激活[11]。
HMGB1为细胞内高度保守的DNA结合蛋白,参与染色质构建、调节基因转录并维持核小体结构[12]。HMGB1所处定位决定其主要功能,在胞质或线粒体内,HMGB1可促进细胞自噬抑制凋亡,参与调节线粒体结构和功能;当其分泌至细胞间质时,则参与调节炎症、免疫反应和细胞增殖等[4]。HMGB1在胃癌、肝癌和头颈癌等多种恶性肿瘤中高表达,与不良预后相关[7, 13]。HMGB1促进结肠癌细胞自噬,进而抑制结肠癌细胞凋亡[14],表明HMGB1可能参与了结肠癌的发生发展。
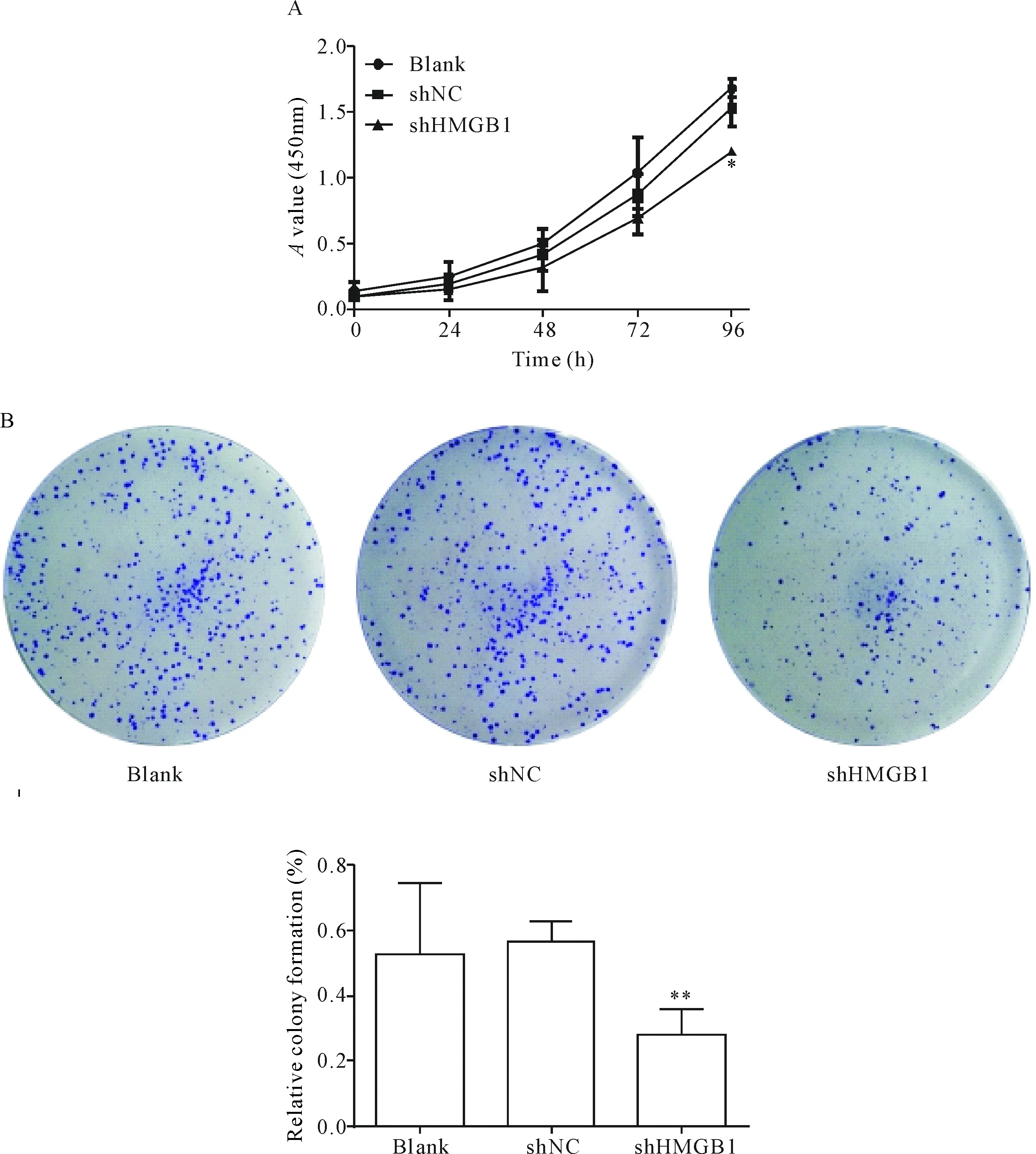
Figure 3.The effect of shHMGB1 on the proliferation of the SW620 cells. A: the cell viability was measured by CCK-8 assay; B: the growth of SW620 cells was detected by colony formation assay. Mean±SD.n=3.*P<0.05,**P<0.01vsshNC group and blank group.
图3 HMGB1在SW620细胞中对增殖的影响
目前HMGB1对结肠癌细胞生物学特性的影响及机制尚未明确。本实验通过qPCR与Western blot检测显示,结肠癌SW620细胞中HMGB1在mRNA和蛋白水平表达均高于正常结肠上皮细胞,表明HMGB1在结肠癌细胞中异常高表达。对细胞功能的影响分析显示,与blank和shNC组相比,shHMGB1组SW620细胞活力和集落形成能力下降,与在肝癌和子宫内膜癌细胞中结果相符[15-16],提示HMGB1能够影响结肠癌细胞的增殖能力。本实验同时观察到shHMGB1组细胞迁移与侵袭的细胞数较对照组减少,同时上皮-间充质转化(epithelial-me-senchymal transition, EMT)相关蛋白E-钙黏蛋白表达上调,N-钙黏蛋白、MMP-2及MMP-9表达降低,与Kuniyasu等[17]的研究具有相同趋势,提示抑制HMGB1表达对结肠癌SW620细胞迁移和侵袭功能及相关蛋白具有抑制作用。有研究报道ERK通路参与胰腺癌、肺癌、乳腺癌等肿瘤细胞的增殖、迁移及侵袭过程[18-20],我们观察到下调HMGB1降低了p-ERK和c-Myc蛋白表达,提示HMGB1可能通过活化ERK通路对结肠癌细胞生物学功能产生影响,同时观察到促凋亡蛋白Bax表达增加,抑凋亡蛋白Bcl-2表达减少,这与Wang等[21]的研究结果趋势一致,同时在肾癌及血管瘤内皮细胞中也观察到HMGB1下调促进细胞凋亡[22-23],这提示HMGB1可能参与抑制结肠癌细胞凋亡促进细胞增殖的过程,但有待进一步的研究证实。
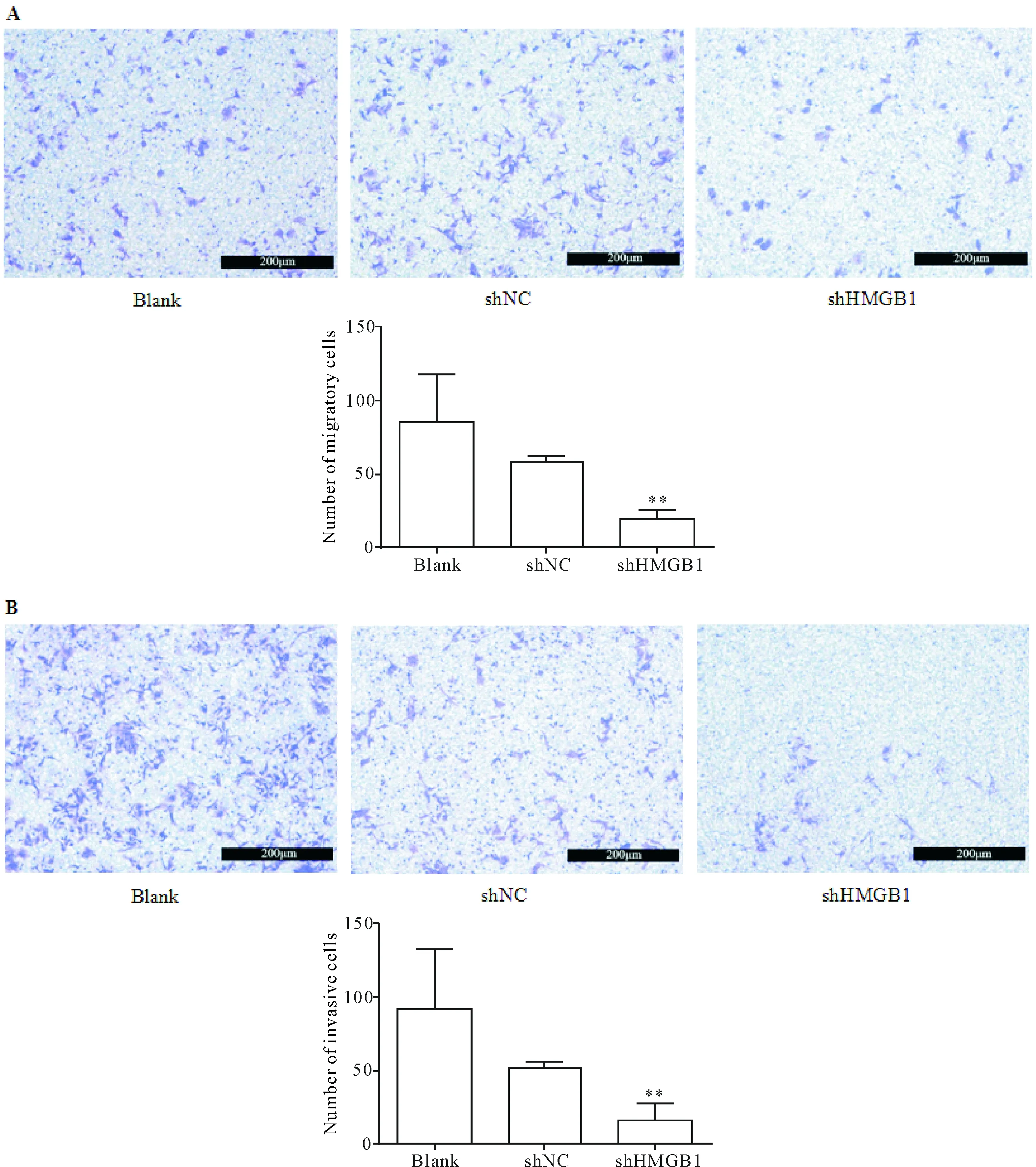
Figure 4.Downregulation of HMGB1 inhibited the migration (A) and invasion (B) of the SW620 cells. The migration and invasion of SW620 cells were detected by Transwell assays. The scale bar=200 μm. Mean±SD.n=3.**P<0.01vsshNC group and blank group.
图4 在SW620细胞中下调HMGB1对细胞迁移和侵袭的影响
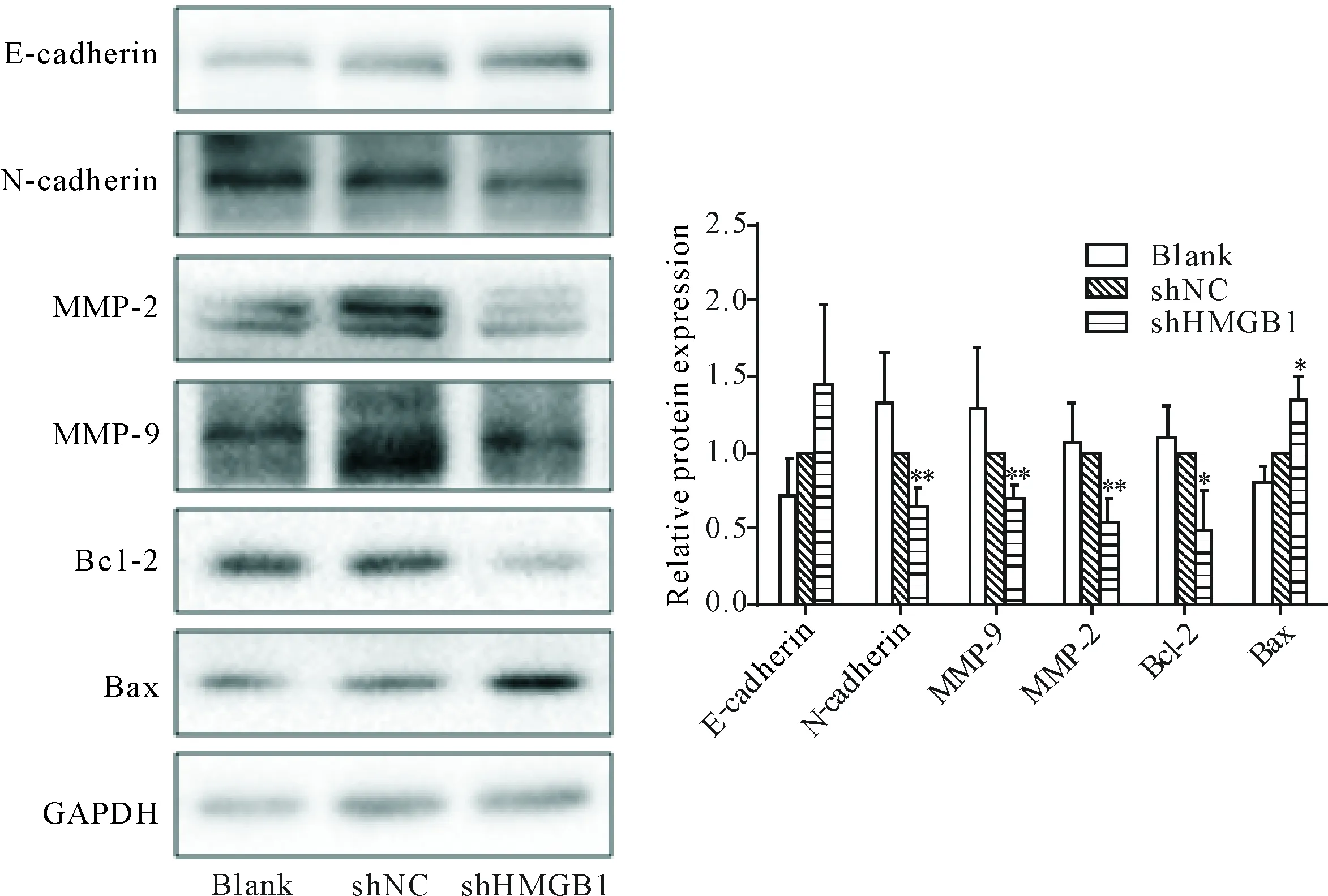
Figure 5.The effects of shHMGB1 on the expression of EMT- and apoptosis-related proteins in the SW620 cells. Mean±SD.n=3.*P<0.05,**P<0.01vsshNC group and blank group.
图5 HMGB1下调对结肠癌SW620细胞中EMT及凋亡相关蛋白的表达影响
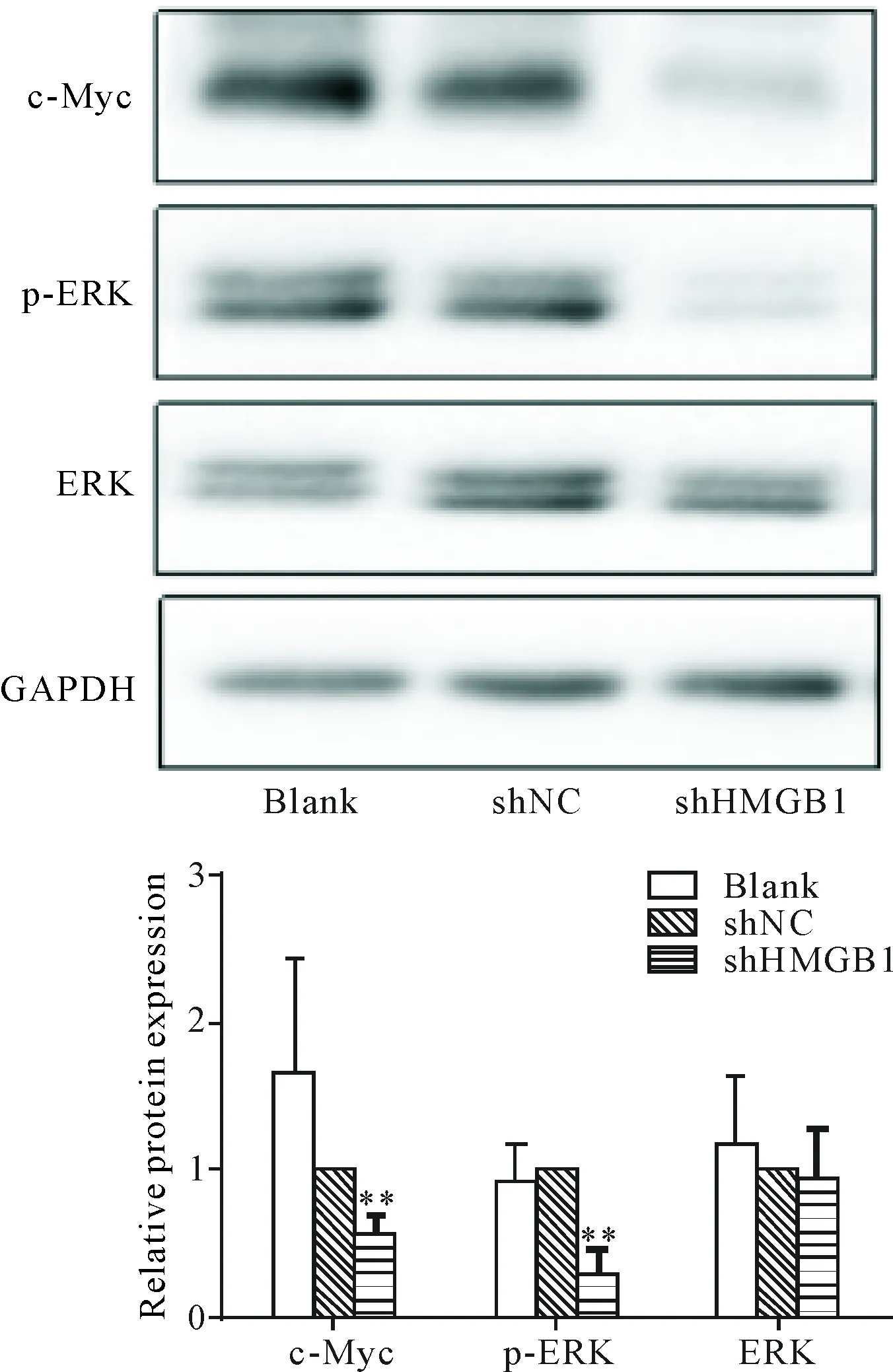
Figure 6.The effects of shHMGB1 on the protein levels of c-Myc and p-ERK in the SW620 cells. Mean±SD.n=3.**P<0.01vsshNC group and blank group.
图6 HMGB1下调对结肠癌SW620细胞中c-Myc、p-ERK及ERK蛋白表达的影响
综上所述,HMGB1在结肠癌细胞中表达异常升高,其基因可能作为致癌基因促进结肠癌的发生发展,抑制HMGB1的表达可降低ERK信号通路相关蛋白表达,从而抑制了结肠癌细胞生物学功能,同时影响了EMT相关蛋白表达。

