活化血小板表面的P-选择素对肺癌血行转移的影响*
王 倩, 朱建兵, 吴承高, 邹 娟, 李 松, 胡飘萍, 乐爱平△
(南昌大学第一附属医院 1输血科, 2心内科, 江西 南昌 330006)
血行转移微环境对肺癌转移的影响越来越受到人们的重视。已知血小板广泛参与炎症、血管止血、血栓形成和动脉粥样硬化等病理生理过程[1],诸多证据表明,血小板亦可在肺癌、胃癌、结直肠癌、乳腺癌和恶性间皮瘤等恶性肿瘤中聚集并活化,且与肿瘤的远处转移有关[2-3]。抗血小板药物(如肝素)的应用可明显抑制肿瘤转移,提示抑制血小板活化可能成为肿瘤治疗的潜在靶点。目前血小板活化影响肿瘤进展与转移的分子机制尚未明确,相关研究揭示血小板活化标志物P-选择素(P-selectin)可能是血小板与肿瘤细胞相互作用的重要黏附分子[4]。
P-selectin是选择素超家族中的主要成员,其家族成员还包括E-选择素和L-选择素等。正常情况下,P-selectin主要位于血小板α颗粒和血管内皮细胞棒管状小体(Weibel-Palade小体),静息时血小板和内皮细胞表面不表达或持续低表达P-selectin;当血小板激活后,α颗粒与血小板膜融合使P-selectin快速迁移至血小板表面[5],因此,P-selectin可作为血小板激活的标志物[1-2]。研究表明,肿瘤细胞可诱导血小板聚集活化,而血小板活化及其活化表达的P-selectin是否参与肿瘤的进展与转移并不十分清楚。Yan等[6]研究发现,膀胱癌患者血清中P-selectin、血管细胞黏附分子1和细胞间黏附分子1的表达水平均明显高于对照组;P-selectin缺陷的小鼠模型中,肺癌转移得到有效抑制;提示P-selectin可能与肿瘤转移密切相关。但P-selectin调节肿瘤转移的分子机制尚未完全阐明,其在血小板影响肺癌血行转移中的作用也不十分清楚。本文拟探讨活化血小板表面的P-selectin与肺癌临床病理特征及血行转移的关系,并初步研究其在肺癌血行转移中的作用及可能机制,为进一步明确肺癌转移机理、寻找新的治疗手段奠定理论基础。
材 料 和 方 法
1 临床资料
用于外周血血小板计数(blood platelet count,BPC)的标本采取自2015年1月~2017年6月242例在我院呼吸科和肿瘤科初诊的原发性肺癌患者,迈瑞全自动血细胞分析仪(BC-5000)自动计数外周血血小板数量。全部病例均经纤维支气管镜活检、经皮肺穿刺或胸膜活检等组织病例学确诊,并通过胸部CT等,按国际抗肿瘤联盟(UICC)2016修订的肺癌TNM分期标准(第8版)进行分期评估。病例包括非小细胞肺癌(non-small-cell lung cancer,NSCLC)和小细胞肺癌(small-cell lung cancer,SCLC),其中肺鳞癌(squamous-cell carcinoma,SCC)96例,肺腺癌(lung adenocarcinoma,LAC) 85例,SCLC 61例,并排除其它疾病干预因素。所有病例在检测前2周均未服用影响血小板功能的药物。
2 材料
人LAC细胞系A549、人肺SCC细胞系H520、人SCLC细胞系H446和人肺泡上皮细胞(human alveolar epithelial cells, HPAECs)均购自中科院上海细胞生物学研究所。鼠抗人P-selectin单克隆抗体和鼠抗人P-选择素糖蛋白配体1(P-selectin glycoprotein ligand-1,PSGL-1)单克隆抗体(Santa Cruz);pSilen-cer-PSGL-1-shRNA (李明宇课题组赠予)。
3 方法
3.1血小板分离提取 病例晨起空腹采血7 mL, 2 500 r/min离心12 min,取上层血浆进行500 r/min二次离心6 min,即分出上层浓缩血小板血浆。再次重离心(3 200 r/min,30 min,4 ℃)后丢弃上清收集血小板[7]。将收集的血小板用0.01 mol/L PBS洗涤2次(3 200 r/min,30 min,4 ℃),以10 %胎牛血清DMEM培养基重悬备用。
3.2流式细胞术检测血小板P-selectin的表达 将收集的外周血血小板分离纯化后,每管加0.01 mol/L PBS 50 μL重悬,加入抗P-selectin抗体5 μL (1∶50),37 ℃孵育1 h,然后0.01 mol/L PBS洗脱2次(3 000 r/min,3.5 min),弃上清后加入FITC标记的 II 抗(1∶50)5 μL,再用0.01 mol/L PBS洗脱2次(3 000 r/min,3.5 min)后上机检测。
3.3血小板和肺癌细胞共培养 将前述提取的血小板进行P-selectin表达检测,根据检测结果分为P-selectin高表达组(≥60%)和P-selectin低表达(<20%)组,并分别以含10% FBS的DMEM重悬,调整血小板计数为3×1011/L备用。在接种于6孔板并置于37 ℃、5% CO2培养箱培养24 h的肺癌细胞中加入各组血小板200 μL,共培养24 h,收集细胞进行后续实验或检测。
3.4质粒转染 取对数期细胞进行铺板,待细胞融合度达70%~80%时进行质粒转染。按Lipofectamine 2000转染试剂说明书,6孔板细胞每孔转染质粒4 μg,将质粒加入250 μL无血清培养基中,将脂质体10 μL加入250 μL无血清培养基中,室温静置5 min。后混合Lipofectamine 2000和质粒的稀释液,轻轻混匀并于室温下静置20 min。pSilencer-PSGL-1-shRNA质粒和pSilencer空载体分别与脂质体孵育,转染肺癌细胞。4 h后更换新鲜培养基,继续培养24~48 h。
3.5RT-qPCR分析 收集细胞加入1 mL TRIzol并按操作说明提取总RNA、测定RNA浓度。以1 μg RNA为模板,按RT-PCR逆转录试剂盒操作说明逆转录cDNA;以1 μL cDNA为模板进行real-time PCR反应。总反应体系为10 μL,包括SYBR®Premix Ex TaqTMⅡ(2×) 5.0 μL、引物0.2 μL、cDNA 1.0 μL、ddH2O 3.8 μL;反应条件为95 ℃ 10 s;95 ℃ 5 s、60 ℃ 15 s、72 ℃ 15 s,40个循环。采用2-ΔΔCt法计算结果。PSGL-1的上游引物序列为5’-TGAGTCTACCACTGTGGAGCC-3’,下游引物序列为5’-GGTT-GAGTGGTCTGTATCTCC-3’;ITGB3的上游引物序列为5’-TCATCACCATCCACGACC-3’,下游引物序列为5’-CCACATACTGACATTCTCCC-3’;GAPDH的上游引物序列为5’-CCCATGTTCGTCATGGGTGT-3’,下游引物序列为5’-TGGTCATGAGTCCTTCCACGATA-3’。
3.6Western blot实验 用蛋白质提取试剂盒提取细胞总蛋白,BCA法对蛋白质进行定量,经SDS-PAGE分离、转模、脱脂牛奶封闭后,加入 I 抗4 ℃过夜,1×TBST洗膜3次,每次10 min,加入相应 II 抗孵育1 h,1×TBST洗膜3次。自动曝光仪曝光获取图像。ImageJ软件分析蛋白质和GAPDH内参照的灰度,计算灰度比值。
3.7Transwell侵袭实验 无血清培养基8∶1稀释Matrigel均匀铺于Transwell小室,每孔50 μL,37 ℃ 30 min。各组细胞以每孔5×104个/孔接种于Transwell小室,用无血清培养基进行培养,放置于含有10 % FBS培养基的24孔板上,5 % CO2培养箱中37 ℃培养24 h。甲醛固定10~20 min,0.1%结晶紫染色20 min,湿棉棒轻轻擦去上层未迁移细胞,PBS洗3遍,显微镜下观察细胞并计数。
4 统计学处理
采用SPSS 19.0统计软件进行数据分析。所有计量资料均经过Shapiro-Wilk正态检验,以均数±标准差(mean±SD)或中位数(下四分位数,上四分位数)表示,两组比较用t检验或Mann-WhitneyU检验;计数资料比较用2检验,当理论频数小于5,改用Fisher确切概率法;多组间比较先采用单因素方差分析(one-way ANOVA)或Kruskal-Wallis检验,后采用SNK-q检验或Dunn-Bonferroni检验进行多组间两两比较;相关性分析采用Bivariate Correlations 分析。以P<0.05为差异具有统计学意义。
结 果
1 健康对照及不同病理类型肺癌患者外周血的BPC水平
30例健康对照BPC中位数为191.00(150.25,227.75)×109/L。242例肺癌患者中,肺SCC 96例,BPC中位数为248.5(215.0,307.0)×109/L;LAC 85例,BPC中位数为287.0(220.0,343.0)×109/L;SCLC 61例,BPC中位数为275.0(227.0,324.0)×109/L。肺SCC、LAC及SCLC中BPC明显高于健康对照(P<0.05);3种病理类型中LAC的BPC水平有增高趋势,但各组间比较无显著差异,见图1。
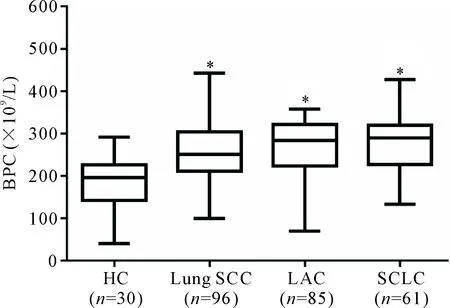
Figure 1.The levels of peripheral blood platelet count (BPC) in healthy controls (HC), and lung squamous-cell carcinoma (SCC), lung adenocarcinoma (LAC) and small-cell lung cancer (SCLC) patients. Median (Q1,Q3).*P<0.05vsHC group.
图1 正常健康对照及不同病理类型肺癌患者BPC水平的比较
2 外周血BPC与肺癌TNM分期的关系
不同TNM分期(T1+2vsT3+4; N0vsN1vsN2)及临床分期(Ⅰ+ⅡvsⅢ+Ⅳ)之间BPC的差异均有统计学意义(P<0.05),见表1。
表1 BPC水平与肺癌临床分期的相关性分析
Table 1.The correlation between the periphery BPC level and the clinical stage of the lung cancer patients
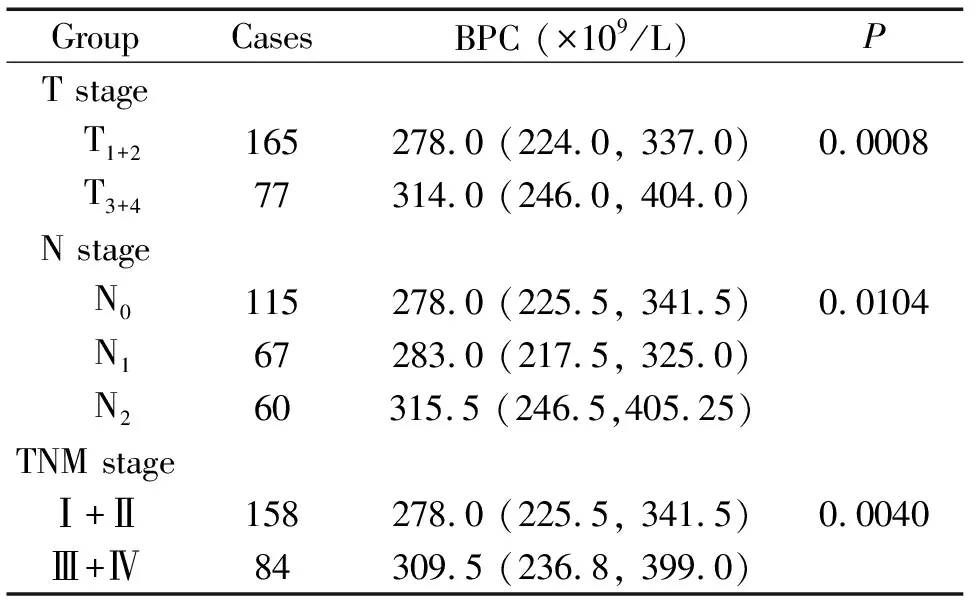
GroupCasesBPC (×109/L)PT stage T1+2165278.0 (224.0, 337.0)0.0008 T3+477314.0 (246.0, 404.0)N stage N0115278.0 (225.5, 341.5)0.0104 N167283.0 (217.5, 325.0) N260315.5 (246.5,405.25)TNM stageⅠ+Ⅱ158278.0 (225.5, 341.5)0.0040Ⅲ+Ⅳ84309.5 (236.8, 399.0)
3 血小板P-selectin水平与肺癌临床病理特征的关系
通过流式细胞术检测肺癌患者外周血血小板P-selectin的水平发现,LAC患者的P-selectin表达较对照组明显升高(P<0.05),且高于SCC组和SCLC组(P<0.05);而SCC组和SCLC组分别与对照组比较均显著升高(P<0.05),但SCC组与SCLC组之间比较的差异无统计学显著性,见图2。
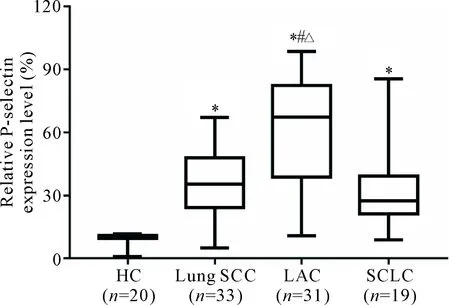
Figure 2.The P-selectin expression on activated platelets in the patients with lung cancer. Median (Q1,Q3).*P<0.05vsHC group;#P<0.05vsSCC group;△P<0.05vsSCLC group.
图2 肺癌患者血小板活化表达P-selectin水平的比较
4 血小板P-selectin水平与肺癌远处血行转移的相关性
本研究检测的83例肺癌患者中,发生血行转移的32例。流式细胞术检测患者血小板活化后表达的P-selectin水平,结果显示患者的P-selectin水平均数为(48.05±16.87)%,据此将患者分为2组(≥48%和<48%)。采用相关分析探讨P-selectin对肺癌患者发生血行转移的相关性,结果显示P-selectin水平和血行转移的相关系数为0.256(P<0.05),提示两者间存在明显相关性,见表2。
表2 患者血小板活化表达P-selectin水平与肺癌血行转移的相关性分析
Table 2.The correlation between the P-selectin expression level on activated platelets and the hematogenous metastasis of primary lung cancer

FactorsCode01rPP-selectin (n)<48%(46)≥48%(37)0.2560.013Hematogenous metastasis (n)Negative (51)Positive (32)
5 不同类型肺癌细胞系PSGL-1的表达
Western blot检测结果显示,A549和H520细胞中PSGL-1的表达较HPAECs显著升高(P<0.05);而H446细胞中PSGL-1的表达较弱,与HPAECs比较差异无统计学显著性,见图3。
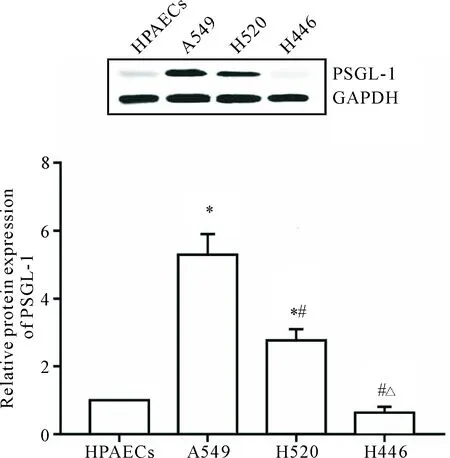
Figure 3.The expression levels of PSGL-1 in different types of lung cancer cell lines. Mean±SD.n=6.*P<0.05vsHPAECs group;#P<0.05vsA549 group;△P<0.05vsH520 group.
图3 不同类型肺癌细胞系PSGL-1表达水平的比较
6 质粒转染敲减肺癌细胞PSGL-1表达后其侵袭力及ITGB3表达水平的变化
A549细胞转染pSilencer-PSGL-1-shRNA 后,采用RT-qPCR检测细胞PSGL-1 的mRNA水平,结果显示转染pSilencer-PSGL-1-shRNA质粒可显著抑制PSGL-1的表达(P<0.05),见图4A。
采用Transwell小室实验观察P-selectin与其配体PSGL-1相互作用对肺癌细胞侵袭能力的影响,细胞分为A549+P-selectin低表达血小板组、A549+P-selectin高表达血小板组和A549+shRNA+P-selectin高表达血小板组,结果表明高P-selectin表达血小板与肺癌细胞共培养组细胞侵袭力和整合素β3 (integrin β3,ITGB3)水平均明显升高,干扰肺癌细胞PSGL-1表达后,细胞跨膜侵袭和ITGB3水平均受到明显抑制(P<0.05),见图4B、C。
讨 论
血行转移是肺癌的重要恶性特征,也是患者预后不良的主要原因之一。近来,血小板活化与肿瘤发生、特别是肿瘤血行转移的关系越来越受到人们的关注,研究证实高BPC是临床癌症患者静脉血栓形成最重要的、也是独立危险因素[8]。我们对不同临床分期和病理类型的肺癌患者进行外周血BPC检测,提示肺癌患者BPC增高与肺癌发生、发展及远处转移具有明显相关性,初步证实了血小板的促肺癌血行转移作用,但血小板影响癌细胞血行转移的机制尚不明确。
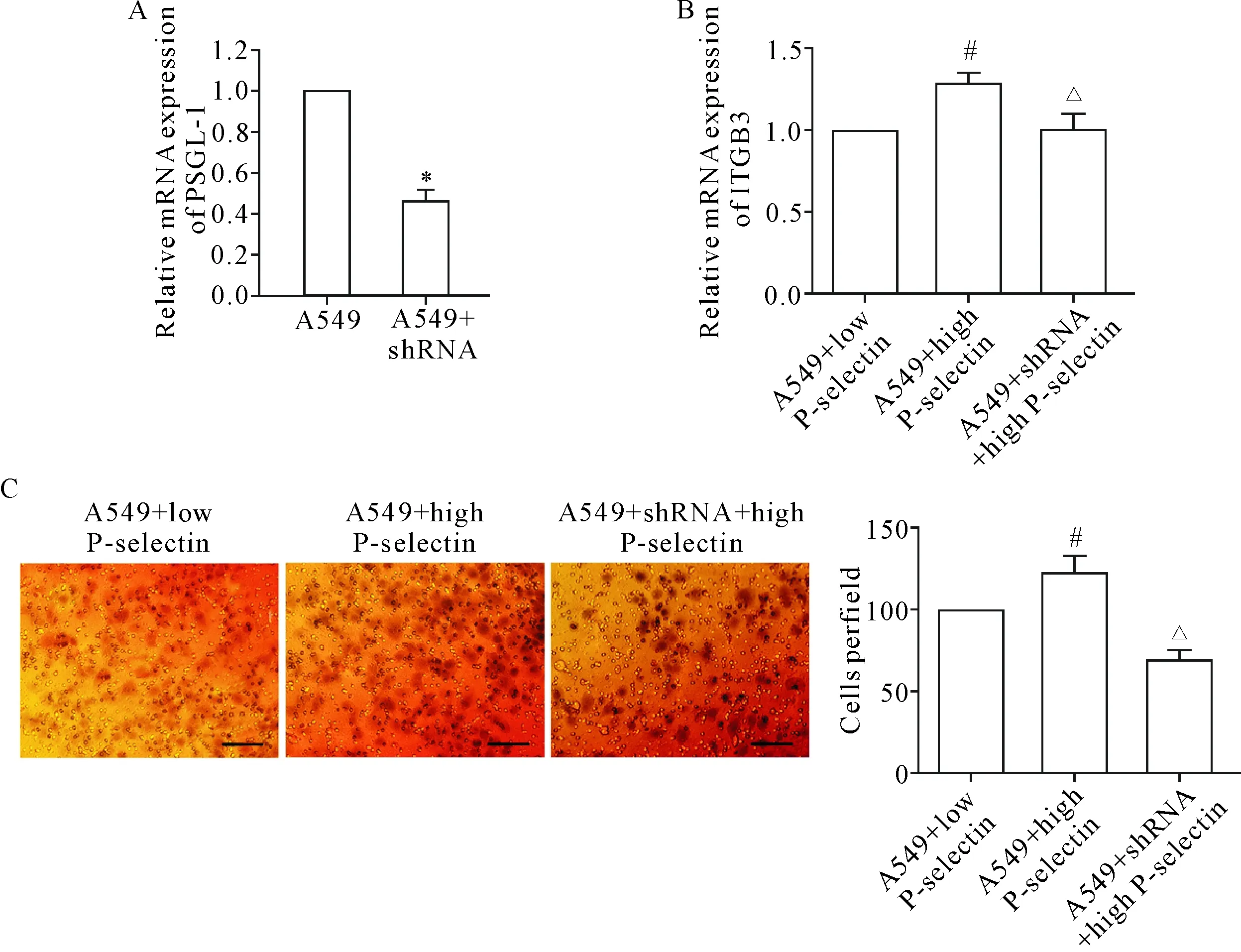
Figure 4.The changes of PSGL-1 (A) and ITGB3 (B) mRNA expression and the invasion ability of the lung cancer cells (C) after plasmid transfection. The scale bar=100 μm. Mean±SD.n=3.*P<0.05vsA549 group;#P<0.05vsA549+low P-selectin group;△P<0.05vsA549+high P-selectin group.
图4 质粒转染肺癌细胞后PSGL-1表达、侵袭力及ITGB3水平的变化
肿瘤血行转移过程需多种黏附分子共同参与,且存在细胞外基质及血细胞间的相互作用。血液中的肿瘤细胞通过激活血小板,诱导其聚集在瘤细胞周围形成瘤栓,一方面实现“免疫逃逸”;另一方面帮助肿瘤细胞和血管内皮细胞黏附,为血行转移创造条件。血小板活化标志物——P-selectin作为一种重要的细胞黏附分子,通常情况下存在于血小板α颗粒或血管内皮细胞Weibel-Palade小体中,血小板和内皮细胞表面不表达或低表达。当凝血酶、肿瘤坏死因子和钙离子载体等物质刺激后,P-selectin迅速表达于血小板表面参与多种生物活动,其水平增高常见于动脉粥样硬化、急性冠脉综合征和脑血管栓塞等疾病。近年研究发现,P-selectin在肿瘤的进展和转移中发挥重要作用[9];在结直肠癌患者中,P-selectin水平显著高于健康对照组,且与无转移组比较,转移组P-selectin水平显著升高[10];膀胱癌患者血清中P-selectin和细胞间黏附分子1均明显高于对照组,且P-selectin升高与肿瘤转移相关。然而这些研究大多检测的是血清中游离的P-selectin,其来源可能是血小板或血管内皮,还有可能来自肿瘤细胞自身。为揭示瘤细胞与活化血小板的直接关系,本研究对患者外周血血小板表面P-selectin进行流式细胞术检测,结果显示肺癌患者血小板P-selectin比率明显高于健康对照组,且肺腺癌组表达最高。同时,活化血小板的P-selectin水平与肺癌尤其是肺腺癌血行转移之间存在明显相关。
进一步地,我们通过体外实验研究血小板P-selectin促进肺癌血行转移的分子机制。研究表明,选择素发挥功能需要与其特异性配体结合,从而实现细胞间的接触、黏附乃至信号传导[11]。有迹象表明P-selectin可通过与瘤细胞表面配体结合调控肿瘤细胞转移[12],然而不同类型肿瘤细胞P-selectin配体的表达不尽相同,如前列腺癌高表达配体PSGL-1、乳腺癌高表达配体CD24等[13],其中PSGL-1是P-selectin的重要配体之一,相对分子质量为120 kD,其糖链富含唾液酸和岩藻糖结构,易与选择素结合[11]。Raes等[14]证实,PSGL-1在淋巴瘤血行转移中扮演重要角色,而PSGL-1是否参与肺癌血行转移尚不明确。我们通过研究发现,肺癌细胞尤其是肺腺癌细胞PSGL-1表达增高,而肺腺癌是肺癌中较多发生远处血行转移的病理类型,因此我们推测活化血小板P-selectin与其配体PSGL-1结合可能是肺腺癌血行转移的重要机制[15-16],而小细胞肺癌由于其与非小细胞肺癌起源和生物学特性不同,二者转移机制可能有所差异[5,17]。通过Transwell实验对不同干预下肺癌细胞侵袭力进行检测,结果发现,P-selectin高表达血小板共培养的肺癌细胞与对照组比较跨膜侵袭力明显增强;特异性干扰肺癌细胞PSGL-1表达后,肺癌细胞跨膜侵袭力受到抑制。与此同时本实验发现,当抑制PSGL-1表达后,癌细胞上整合素ITGB3水平也显著降低,而整合素可通过促进细胞骨架重排、增强肿瘤变形能力以及通过调节肿瘤与细胞基质黏附促进肿瘤转移近来在肿瘤转移中的作用逐渐受到重视,提示血小板P-selectin与配体PSGL-1结合促进肺癌进展与ITGB3水平升高有关。

