二吲哚吡啶基噻唑烷对肺癌A549细胞增殖的影响*
颜 亮, 曹 陇, 张名康, 陆鑫宇, 李雨朦, 马金珠, 徐 蕾, 范 倩
(1皖南医学院活性生物大分子安徽省重点实验室, 安徽 芜湖241002; 2天津市肿瘤医院, 天津300060)
据最新的全球肿瘤统计数据,肺癌位于全球肿瘤发病率及致死率第1位,已成为严重危害人类健康的疾病之一[1]。随着医疗技术的发展,肺癌的早期诊断及治疗方式有了明显的进步,但由于肺癌发病机制的复杂性,肺癌患者的5年存活率还是很低[2]。因此,对肺癌的发病机制进行研究,发现并合成新的肺癌治疗的有效药物对肺癌的有效治疗至关重要。
近年来,氧化吲哚螺环类衍生物已被证明具有良好的抗病毒[3]、抗肿瘤[4]、抗炎[5]及抗结核[6]等药理活性。由于氧化吲哚螺环具有很好的靶向性以及药理活性,据报道有多种以氧化吲哚螺环为基本骨架的靶向先导药物已经进入临床试验阶段[7-8]。而在肺癌中,有关氧化吲哚螺环类衍生物的生物学活性及抗肿瘤活性的研究还很少。基于氧化吲哚螺环类衍生物在抗肿瘤药物研发中的重要作用,本研究观察了氧化吲哚螺环新的衍生物二吲哚吡啶基噻唑烷(di-indolyl thiozoline, DIIT)对肺癌A549细胞增殖的影响,初步探索了DIIT在肺癌中的潜在抗肿瘤活性。
材 料 和 方 法
1 材料
人肺癌细胞株A549购自中科院上海细胞库。DIIT为南京大学化工学院合成,其化学结构式如图1A所示;胎牛血清购自Gibco;CCK-8试剂盒购自日本同仁化学试剂有限公司;EdU试剂盒购自广州锐博生物科技有限公司;DAPI购于北京凯基生物科技有限公司;抗p-Akt、p-mTOR、细胞周期蛋白依赖性激酶4(cyclin-dependent kinase 4, CDK4)、细胞周期蛋白D1(cyclin D1)及GAPDH抗体购自Cell Signaling Techology;Ⅱ抗购自Santa Cruz。
2 方法
2.1细胞培养 人肺癌细胞株A549在37℃、5% CO2的环境下,用浓度为10%胎牛血清和抗生素(1×105U/L 青霉素和100 mg/L链霉素)的DMEM完全培养基进行培养,待细胞生长到对数期进行后续实验。
2.2CCK-8法检测细胞活力 按照密度为每孔1×104将人肺癌细胞A549接种到96孔板中。加入浓度为(12.5、25、50和100 mg/L)的DIIT处理细胞24 h后,每孔加入10 μL CCK-8试剂(2.5 g/L),继续培养2 h,使用酶标仪在450 nm波长下测定每孔的吸光度(A)值。细胞相对活力=实验组A450值/空白对照组A450值。
2.3EdU/DAPI双染法检测细胞增殖情况 细胞处理方法同2.2,将处理后的细胞按照每孔1×104的密度接种到48孔板,每孔加入150 μL浓度为50 μmol/L的EdU培养基,37 ℃孵育2 h;PBS清洗细胞3次,每次5 min;在每孔加入200 μL浓度为4%多聚甲醛,固定40 min;每孔加入200 μL浓度为2 g/L甘氨酸,孵育5 min;弃去溶液,PBS清洗细胞3次,每次5 min;每孔加入200 μL含0.5% Triton X-100 的PBS清洗1次;每孔加入200 μL Apollo染色液,暗室孵育30 min,再每孔加入浓度为1 mg/L的DAPI暗室染色20 min,通过荧光倒置显微镜观察并拍照。
2.4Western blot实验检测相关蛋白的表达水平 细胞处理方法同2.2,将各组细胞裂解物收集。4 ℃、12 000 ×g离心5 min,吸取上清液。BCA法测定每组蛋白浓度,加入5×上样缓冲液,100 ℃ 5 min,冷却后,根据每组蛋白浓度,按照每孔60 μg进行上样。经SDS-PAGE(10%)后,把蛋白转移至PVDF膜上。用TBST配制的5% 脱脂奶封闭PVDF膜,室温1 h。然后加入稀释的 I 抗(1∶1 000),4 ℃孵育过夜。TBST清洗6次,每次5 min。加入稀释好的 II 抗(1∶1 000),室温孵育1 h,TBST清洗6次,每次5 min。清洗好的膜放入暗盒上,正面朝上,加入发光底物,暗室曝光。
3 统计学处理
采用SPSS 19.0软件进行数据处理和统计分析。所有数据以均数±标准差(mean±SD)表示。采用单因素方差分析进行组间比较,以P<0.05为差异有统计学意义。
结 果
1 DIIT抑制A549细胞的活力
使用浓度为12.5、25、50和100 mg/L的DIIT孵育A549细胞24 h,采用CCK-8法检测细胞活力,结果显示,与DMSO对照组相比,25、50和100 mg/L的DITT处理后细胞相对活力均显著下降(P<0.01)。运用GraphPad软件(V5.0)计算了该化合物的IC50值为91.02 mg/L,实验结果表明DIIT可以剂量依赖性抑制A549细胞活力,见图1B。为了检测DIIT对A549 细胞形态的影响,通过倒置显微镜下观察并收集了细胞图像,结果显示,与DMSO对照组相比,随着DIIT浓度的增加,细胞体积缩小、连接疏散,细胞间隙增大,与周围细胞脱离,生长状态差,见图2。以上结果表明DIIT显著抑制了A549细胞的活力。
2 DIIT抑制A549细胞的增殖
使用EdU/DAPI双染法检测DIIT对A549细胞增殖的影响,结果显示,EdU阳性细胞相对数比DMSO对照组分别降低10%、21%(P<0.05)、26%(P<0.05)及34%(P<0.01),见图3,说明DIIT可以剂量依赖性抑制A549细胞增殖。
3 DIIT对细胞增殖相关蛋白的影响
为了验证DIIT对细胞增殖相关蛋白表达的影响,使用12.5、25、50和100 mg/L DIIT处理A549细胞24 h,Western blot法检测了细胞增殖相关蛋白水平等变化。结果显示,与DMSO对照组相比,DIIT可以抑制Akt及mTOR的磷酸化水平,抑制细胞周期蛋白CDK4及cyclin D1的表达水平(P<0.01),见图4。
讨 论
近年来,研究表明以氧化吲哚螺环为基本结构的化合物在抗肿瘤的治疗方面表现出良好的药理活性,如彭礼军等[9]合成了新型的芳姜黄酮拼合吡咯螺环氧化吲哚类化合物,并发现该化合物对白血病细胞具有一定的抑制活性;另有报道表明,新型烷氧基嘧啶拼接3-吡咯螺环氧化吲哚类化合物对肺癌、前列腺癌和白血病细胞具有抑制作用[10],上述报道主要关注其合成过程及抗肿瘤活性,关于其抗肿瘤的具体机制研究还很少。本研究评估了DIIT对肺癌细胞增殖的影响,结果表明DIIT可以直接抑制A549细胞生长,改变细胞形态并抑制细胞的增殖。
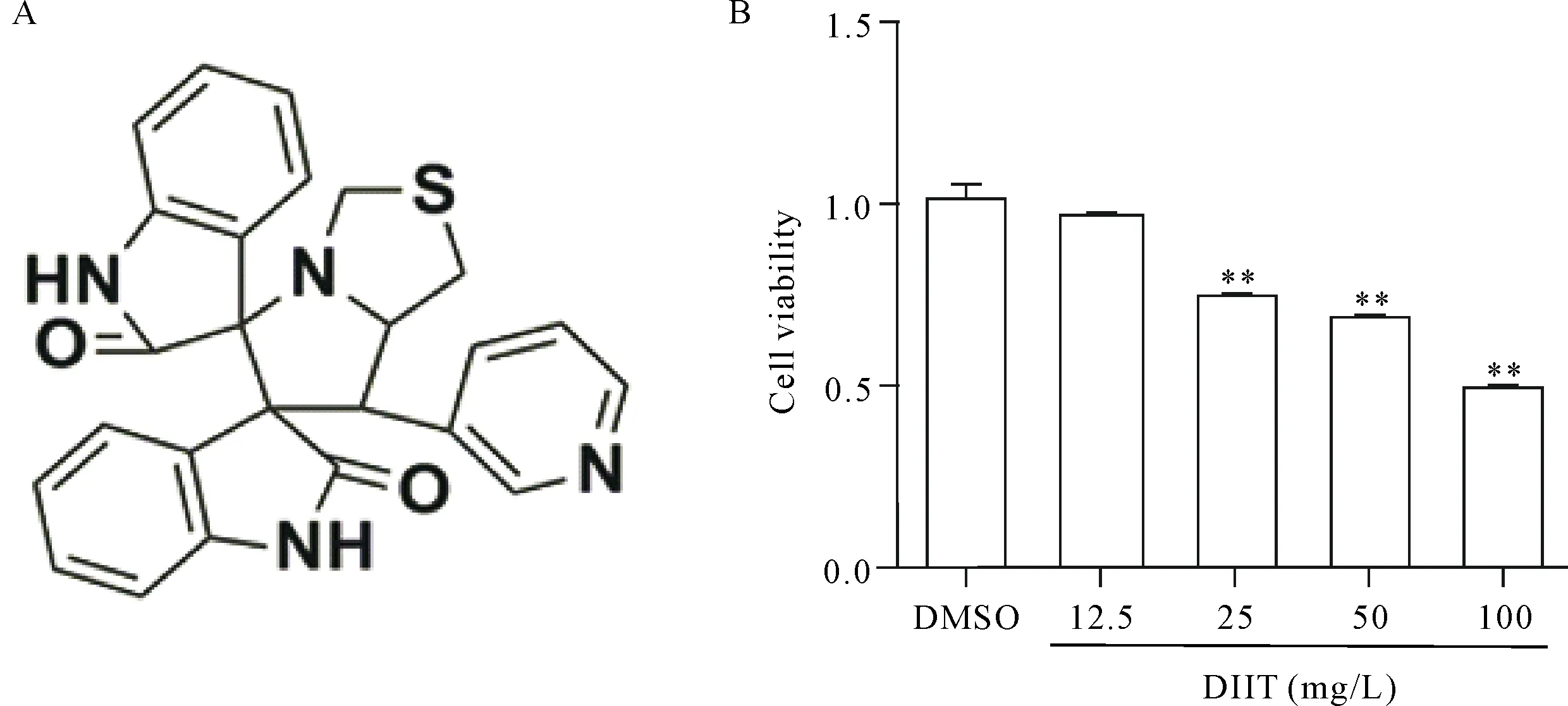
Figure 1.The structure of DIIT and its effect on the viability of A549 cells. A: the structure of DIIT; B: the effect of DIIT on the viability of A549 cells. Mean±SD.n=3.**P<0.01vsDMSO group.
图1 DIIT的化学结构及其对肺癌细胞A549活力的影响

Figure 2.The effect of DIIT on the morphology of A549 cells (×200).
图2 DIIT对A549细胞形态的影响
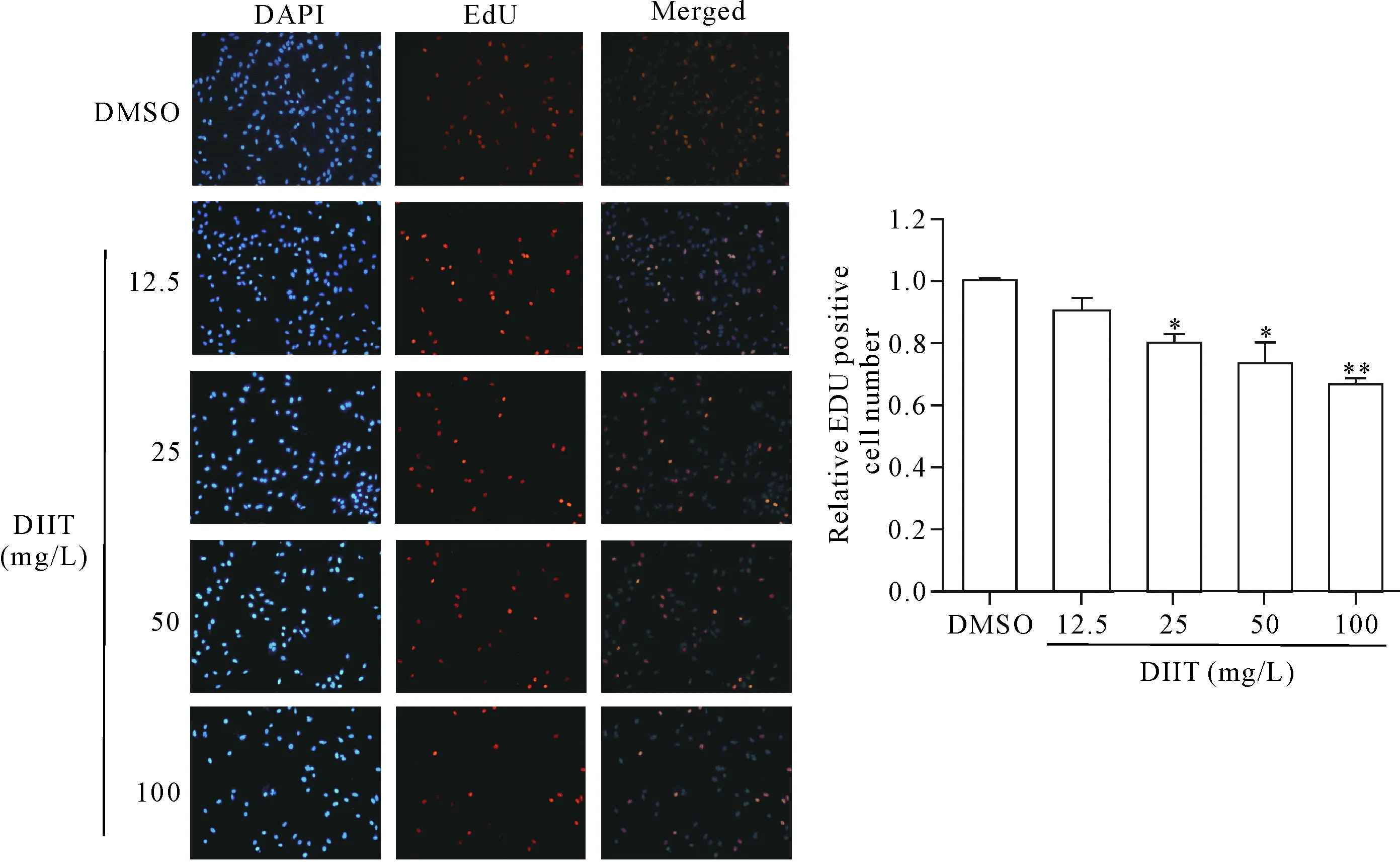
Figure 3.The effect of DIIT on the proliferation of A549 cells by EdU assay. Mean±SD.n=3.*P<0.05,**P<0.01vsDMSO group.
图3 DIIT对A549细胞增殖的影响
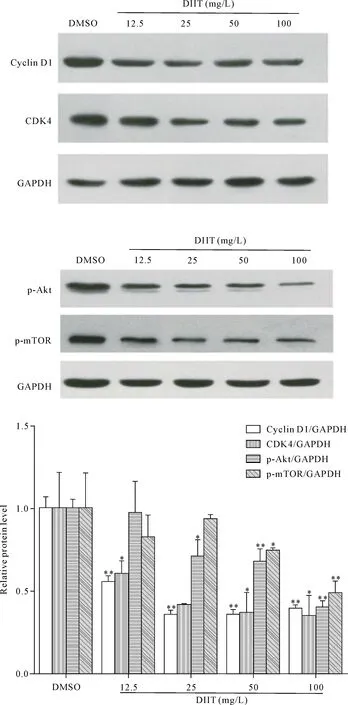
Figure 4.The effect of DIIT on the expression of cell proliferation signaling pathway-related proteins in A549 cells. Mean±SD.n=3.*P<0.05,**P<0.01vsDMSO group.
图4 DIIT对肺癌A549细胞增殖信号通路相关蛋白水平的影响
研究表明,在肺癌细胞的增殖过程中,PI3K/Akt/mTOR 信号通路发挥着重要作用,该信号通路中的一些信号蛋白分子可以作为肿瘤治疗的潜在靶点[11-13]。本研究检测了经DIIT处理后肺癌A549细胞的Akt及mTOR磷酸化水平,结果表明DIIT可以有效抑制Akt及mTOR的磷酸化,提示Akt及mTOR可能是DIIT抑制A549细胞增殖的作用靶点。细胞周期调控发生异常也是肺癌发病的机制之一,cyclin D1在肺癌中常出现异常高表达[14-16],该蛋白是CDK4的调节亚基,其异常表达会影响CDK4的表达,最终引起细胞周期异常[17-18]。因此,本研究检测了经DIIT处理肺癌A549细胞后细胞周期蛋白CDK4及cyclin D1的表达水平,发现DIIT可以有效抑制CDK4及cyclin D1的表达水平,提示DIIT可能通过抑制细胞周期相关蛋白的表达进而抑制肺癌A549细胞增殖。
综上所述,本研究在体外证实了DIIT具有抑制肺癌A549细胞增殖的作用,其机制可能与抑制AKT及mTOR的磷酸化水平,并抑制细胞周期蛋白CDK4及cyclin D1的表达水平有关。但细胞形态学的结果表明,随着DIIT浓度的增加,细胞形态发生改变并发生了脱落,以上结果表明DIIT并不仅仅只抑制了肺癌A549细胞的增殖,后续研究需要关注其对A549细胞凋亡及其它功能的影响及其具体机制。上述研究结果为该类新合成的化合物具有的抗肿瘤潜在活性及其机制提供了实验依据,在后续的研究中我们要进一步明确DIIT抑制肺癌A549细胞增殖的具体机制。

