二甲双胍通过lncRNA-MALAT1对人血管平滑肌细胞活力、迁移及凋亡的影响*
游赣花, 龙向淑, 宋 方, 黄 晶, 田茂波, 肖 燕, 邓世燕, 吴 强△
(1贵州大学医学院, 贵州 贵阳 550025; 2贵州省食品药品检验所, 贵州 贵阳 550004; 3贵州省人民医院, 贵州大学人民医院心内科, 贵州 贵阳 550002)
血管平滑肌细胞(vascular smooth muscle cells, VSMC)是构成血管壁的重要成分,其异常增殖和迁移是动脉粥样硬化(atherosclerosis, AS)、高血压以及冠状动脉介入治疗术后再狭窄等血管增殖性疾病发病的重要病理生理基础[1-2]。二甲双胍(metfor-min,Met)是一种广泛应用于临床的2型糖尿病降糖药;此外,二甲双胍还具有抗AS特性。在一项纳入了3 234名前驱糖尿病受试者进行的临床研究中,与安慰剂组比较,二甲双胍组冠状动脉钙化发生率和严重程度均显著降低,提示二甲双胍可能对糖尿病导致的冠状动脉粥样硬化起抑制作用[3]。长链非编码RNA(long noncoding RNA, lncRNA)是一类转录物长度大于200 nt且不具有蛋白编码功能的非编码RNA[4],可参与调控AS的发生发展[5-6]。研究显示二甲双胍可抑制人原代VSMC增殖和迁移[7],但二甲双胍是否通过lncRNA肺腺癌转移相关转录本1(metastasis-associated lung adenocarcinoma transcript 1, MALAT1)影响VSMC细胞增殖和迁移尚未明了。鉴于此,本研究拟观察二甲双胍与lncRNA-MALAT1的相关性及VSMC活力、迁移及凋亡的相应变化,为防治血管增殖性疾病提供新参考资料。
材 料 和 方 法
1 实验材料
人VSMC购自中南大学湘雅细胞库。二甲双胍购自北京索莱宝科技有限公司;RPMI-1640培养液和Opti-MEM转染培养液购自Gibco;胎牛血清购自BI;CCK-8试剂盒购自日本同仁化学研究所;双染法细胞凋亡检测试剂盒购自上海七海复泰生物科技有限公司;Lipofectamine 2000转染试剂购自Invitrogen;PCR荧光染料试剂盒购自TaKaRa;血液总RNA快速提取试剂盒购自北京百泰克生物技术有限公司;GAPDH内参照抗体购自上海碧云天生物技术研究所;抑癌因子 p53 抗体购自沈阳万类生物科技有限公司;小干扰RNA由上海吉玛制药技术有限公司合成;PCR扩增引物由上海生工生物工程有限公司合成。
2 主要方法
2.1病例收集 35例冠心病(coronary heart di-sease, CHD)患者(男, 24例;女, 11例),平均年龄(64.6±8.8)岁,均于2018年6~8月在贵州省人民医院经冠状动脉造影确诊。对照组38例(男, 22例;女, 16例),平均年龄(57.3±6.1)岁,为在贵州省人民医院例行健康体检者。冠心病病例纳入标准:至少一支主要冠状动脉血管狭窄>80%的稳定型心绞痛患者。排除标准:(1)不稳定型心绞痛或心肌梗死;(2)合并其他器质性心脏病;(3)合并严重肝肾疾病、家族性高胆固醇血症、恶性肿瘤及炎症性疾病。以上人群均每例取静脉血3 mL,所有标本收集过程均在贵州省人民医院伦理委员会审查通过,病人知情的情况下进行。
2.2VSMC的培养 快速从液氮罐中取出VSMC冻存管经37 ℃水浴,再加入5~10倍体积的RPMI-1640完全培养液160×g离心5 min后弃上清液,加入1 mL 10% RPMI-1640培养液重悬细胞后,加培养液至4 mL,置于37 ℃含5% CO2培养箱内,24 h后更换新培养液。
2.3细胞干预方法 给予终浓度为0、5、10和20 mmol/L的二甲双胍进行细胞活力检测,并选择10 mmol/L的二甲双胍进一步进行实验;或经siRNA转染,分为非特异性siRNA转染组(si-NC组)和50 nmol/L MALAT1 siRNA转染组。
2.4siRNA转染 取对数生长期细胞接种于6孔板中(每孔2×105/个),用不含双抗的10% RPMI-1640培养液培养,待细胞生长至50%时进行转染。按siRNA transfection reagent说明书操作,加入转染复合物干预5 h后,换正常含双抗的培养液培养一定时间后收集细胞用于实验。si-MALAT1序列,forward: 5’-GACCUUGAAAUCCAUGACCUU-3’, reverse: 5’-AACGUCAUGGAUUUCAAGGU C-3’; si-NC,forward: 5’-UUCUCCGAACGUGUCACGUTT-3’, reverse: 5’-ACGUGACACGUUCGGAGAATT-3’。
2.5CCK-8检测细胞活力 取对数生长期细胞,按每孔3×103个接种于96孔板,细胞孵育过夜后按上述分组进行给药或转染处理,每组分别设6个复孔,并设置2个调零孔,继续培养72 h后每孔加入10 μL CCK-8溶液,将96孔板置入培养箱内继续孵育2 h后经酶标仪测定450 nm处的吸光度。
2.6细胞划痕实验 在6孔板背面均匀画出6条横穿过孔的线条(每孔3条),待孔内各组细胞汇合度达90%后,用划线工具垂直于孔背面横线在细胞表面划痕。吸弃孔内液体,并用PBS缓冲液轻柔的清洗2遍,加入低血清培养液。显微镜下拍照,放入细胞培养箱继续培养24 h并拍照,计算迁移面积。
2.7流式细胞术检测细胞凋亡 收集细胞,加入400μL 1×Binding Buffer 轻轻重悬细胞,加入5 μL Annexin V-FITC轻轻混匀,室温避光孵育15 min,加入10 μL PI染色液,轻轻混匀,冰浴避光放置5 min,在30 min内进行流式细胞术检测。
2.8RT-qPCR检测mRNA表达 按TRIzol法提出细胞总RNA后(血液中RNA的提取按照血液总RNA快速提取试剂盒说明书进行),逆转录成cDNA,RT-qPCR进行扩增。PCR扩增条件为:95 ℃ 1 min预变性;95 ℃ 15 s,60 ℃ 1 min,重复循环40次;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s进行熔解曲线分析。以GAPDH为内参照,2-ΔΔCt法计算各组lncRNA-MALAT1和p53 mRNA的相对表达量。MALAT1的上游引物序列为5’-AATGTTAAGAGAAGCCCAGGG-3’,下游引物序列为5’-AAGGTCAAGAGAAG TGTCAGC-3’;p53的上游引物序列为5’-CTCCTCAGCATCTTATCCGAG-3’,下游引物序列序列为5’-GCTGTTCCGTCCCAGTAGATTA-3’;GAPDH的上游引物序列为5’-AGCCACATCGCTCAGACAC-3’,下游引物序列为5’-GCCCAATACGACCAAATCC-3’。
2.9Western blot检测蛋白表达 提取细胞总蛋白,每孔上样30 μg蛋白样品进行SDS-PAGE,湿法转膜转移蛋白条带至PVDF膜。将膜置Western 封闭液中室温下封闭2 h;加入p53 I抗工作液置4 ℃冰箱过夜;TBST缓冲液(pH=7.4)洗膜,室温下孵育稀释的II抗1.5 h;TBST洗膜,电化学发光(ECL)显影。同法封闭、孵育GAPDH。ImageJ 软件对条带进行灰度分析。
3 统计学处理
应用GraphPad Prism 7.0统计软件进行统计分析,数据用均数±标准差(mean±SD)表示,两组独立样本比较采用t检验,多组独立样本比较采用单因素方差分析(one-way ANOVA),以P<0.05为差异有统计学意义。
结 果
1 lncRNA-MALAT1表达情况的检测
RT-qPCR检测38例无CHD的对照人群与35例冠脉狭窄>80%的CHD患者血样中lncRNA-MALAT1的表达水平;si-NC和si-MALAT1瞬时转染细胞,进行沉默效率检测;10 mmol/L二甲双胍给药,并分别于24、48和72 h后检测lncRNA-MALAT1的表达。结果显示,与对照人群相比,lncRNA-MALAT1在CHD患者血样中表达显著升高(P<0.05),见图1A;与Si-NC组相比, si-MALAT1组中lncRNA-MALAT1的表达显著降低(P<0.05),见图1B;二甲双胍给药后lncRNA-MALAT1的表达呈时间依赖性降低(P<0.05),见图1C。

Figure 1.RT-qPCR was performed to detect the expression of lncRNA-MALAT1. A: the expression of MALAT1 in peripheral blood samples; B: detection of the silencing efficiency of si-MALAT1; C: the expression of MALAT1 after metformin (Met) administration. Mean±SD.n=3.*P<0.05vsnormal group;△P<0.05vssi-NC group;#P<0.05vscontrol group.
图1 RT-qPCR检测lncRNA-MALAT1的表达
2 二甲双胍给药对VSMC活力、迁移及凋亡的影响
CCK-8结果显示,5、10和20 mmol/L二甲双胍给药24 h、48 h和72 h均可在一定程度上呈浓度及时间依赖性抑制VSMC细胞活力(P<0.05),见图2A;划痕实验结果显示,与空白对照组相比,10 mmol/L二甲双胍给药24 h后VSMC的迁移率显著降低(P<0.05),见图2B;流式细胞术结果显示,10 mmol/L二甲双胍给药48 h后VSMC的凋亡率显著升高(P<0.05),见图2C。
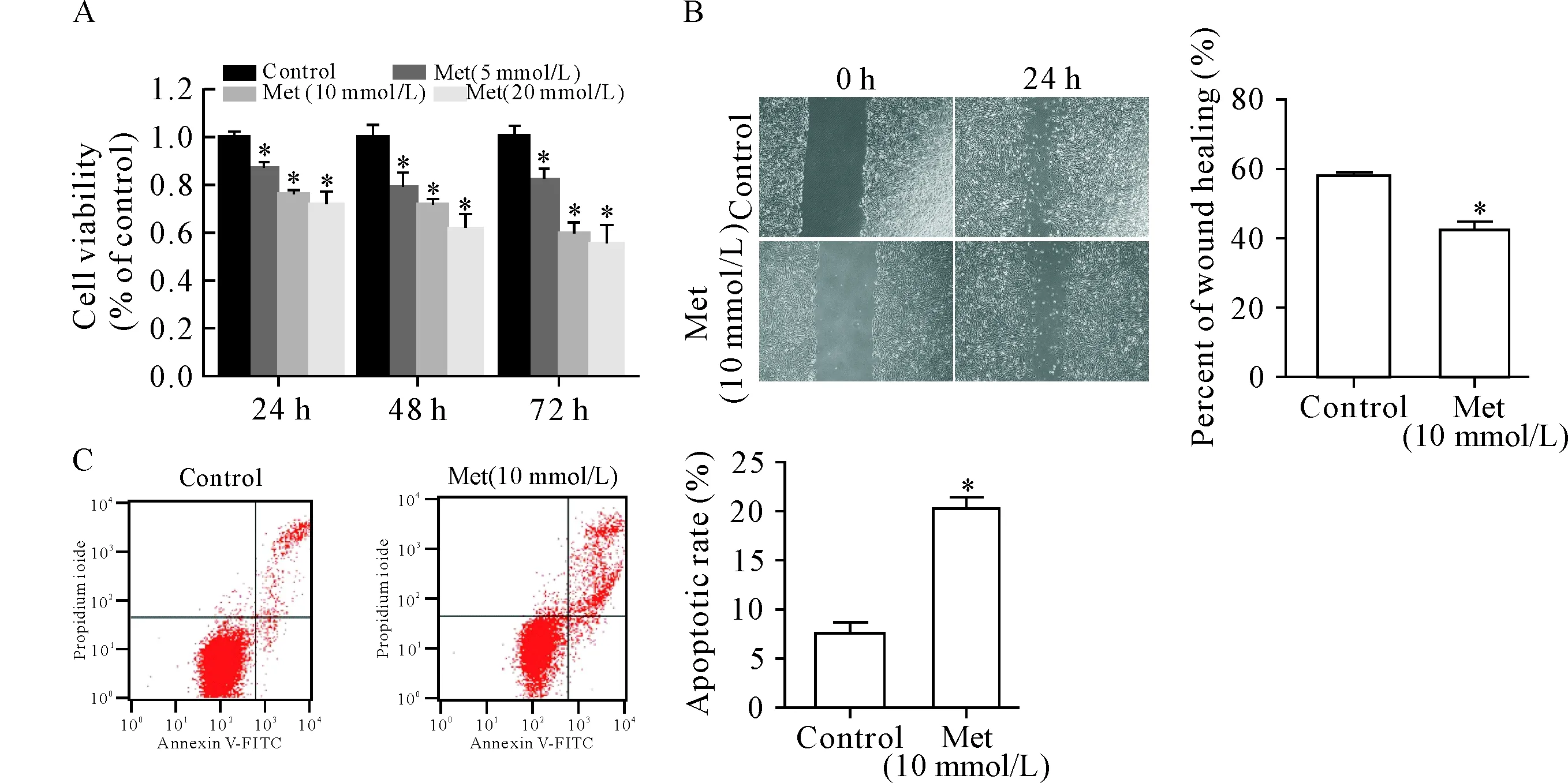
Figure 2.Effect of metformin (Met) on VSMC viability, migration and apoptosis. A: the viability of VSMC detected by CCK-8 assay; B: the migration ability of VSMC detected by wound healing assay (×40); C: the apoptosis rate of VSMC detected by flow cytometry. Mean±SD.n=3.*P<0.05vscontrol group.
图2 二甲双胍对VSMC活力、迁移和凋亡的影响
3 si-MALAT1对VSMC活力、迁移及凋亡的影响
CCK-8结果显示,与si-NC组比较,si-MALAT1分别转染细胞24 h、48 h和72 h后呈时间依赖性抑制VSMC细胞活力(P<0.05),见图3A;划痕实验结果显示,si-MALAT1转染24 h后VSMC的迁移率显著降低(P<0.05),见图3B;流式细胞术结果显示,si-MALAT1转染48 h后VSMC的凋亡率升高不明显,见图3C。
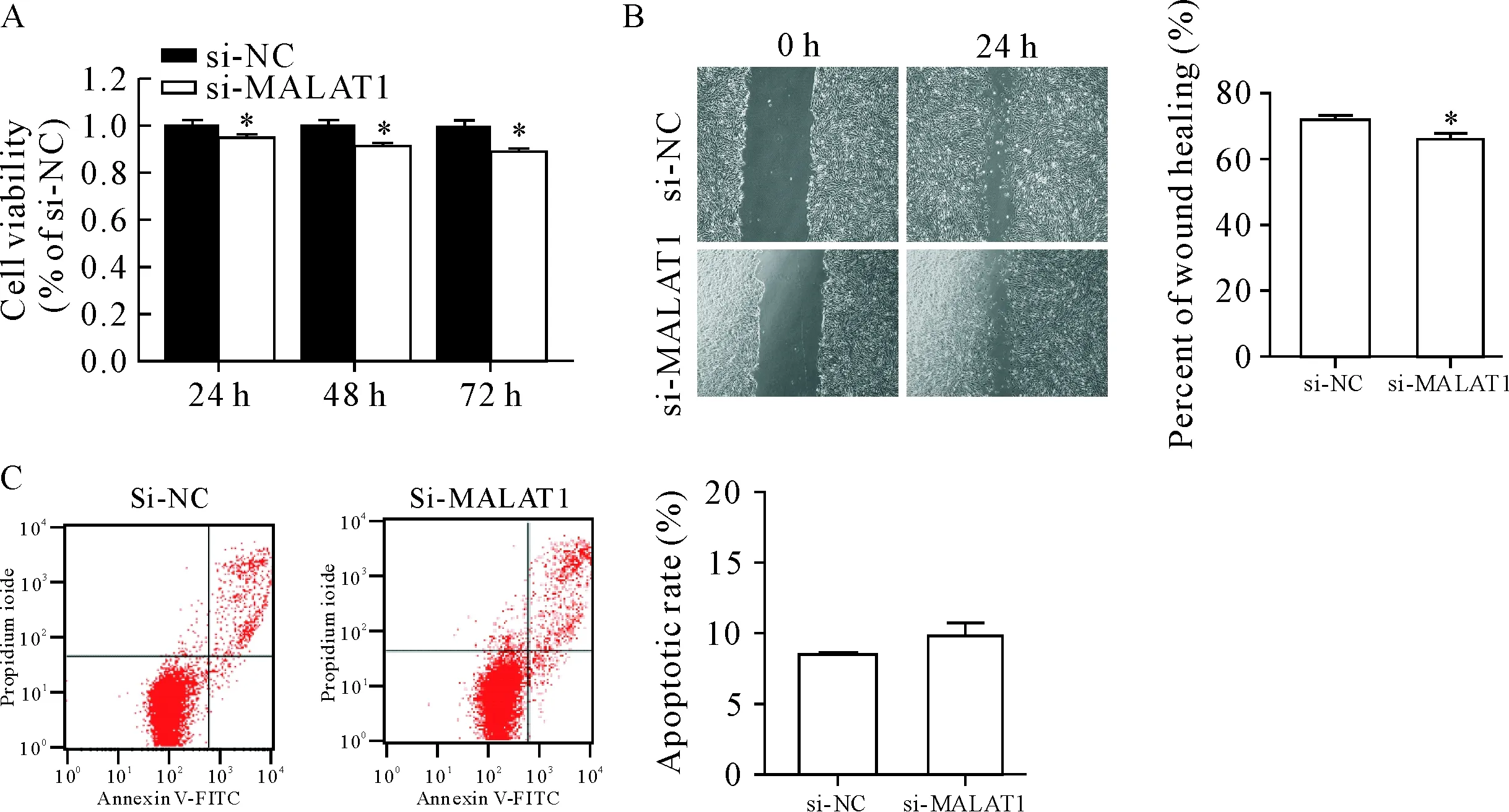
Figure 3.Effect of si-MALAT1 on VSMC viability, migration and apoptosis. A: the viability of VSMC detected by CCK-8 assay; B: the migration ability of VSMC detected by wound healing assay (×40); C: the apoptosis of VSMC detected by flow cytometry. Mean±SD.n=3.*P<0.05vssi-NC group.
图3 Si-MALAT1对VSMC活力、迁移和凋亡的影响
4 二甲双胍给药对p53表达水平的影响
我们进一步用RT-qPCR和Western blot检测了二甲双胍给药后p53的表达变化。与空白对照组比较,10 mmol/L二甲双胍给药48 h后p53 mRNA水平显著升高(P<0.05),见图4A;同时p53蛋白表达水平亦显著升高(P<0.05),见图4B。
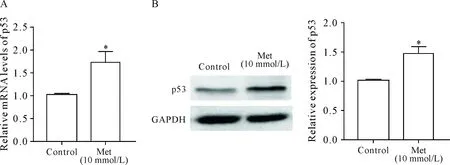
Figure 4.Effect of metformin (Met) on the expression of p53 at mRNA and protein levels. A: the mRNA expression of p53 detected by RT-qPCR; B: the protein expression of p53 detected by Western blot. Mean±SD.n=3.*P<0.05vscontrol group.
图4 二甲双胍给药对p53 mRNA及蛋白表达水平的影响
5 si-MALAT1转染对p53表达水平的影响
接下来,我们用RT-qPCR和Western blot检测了si-MALAT1转染后p53的表达变化。与si-NC组比较,si-MALAT1转染细胞48 h后p53 mRNA水平显著升高(P<0.05),见图5A;同时p53蛋白表达水平亦显著升高(P<0.05),见图5B。
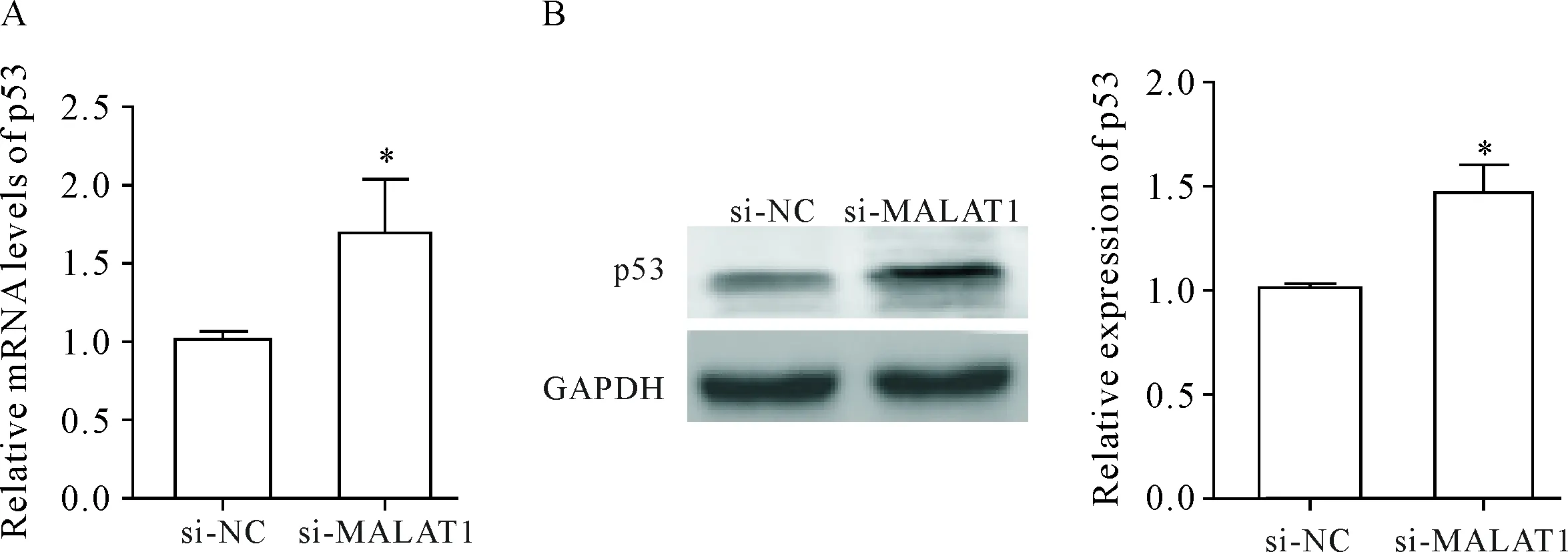
Figure 5.Effect of si-MALAT1 on the expression of p53 at mRNA and protein levels. A: the mRNA expression of p53 detected by RT-qPCR; B: the protein expression of p53 detected by Western blot. Mean±SD.n=3.*P<0.05vssi-NC group.
图5 si-MALAT1转染对p53 mRNA及蛋白表达水平的影响
讨 论
VSMC过度增殖是血管增殖性疾病发病的主要环节,研究如何采取有效措施抑制VSMC增殖、迁移以及表型转化等是血管增殖性疾病领域研究的热点[1-2]。
二甲双胍因其作用广泛、副作用小而成为近年来的研究热点。研究显示二甲双胍具有抗AS作用[7-8],但相关的分子机制尚未完全明确。
研究发现哺乳动物基因中超过98%转录为非编码RNA,仅有不到2%的基因转录为蛋白质[9-10]。lncRNA与AS密切相关,差异表达的lncRNA可为诊治心血管疾病提供潜在的新靶点[11-12]。MALAT1也被称为核富集转录本2(nuclear-enriched abundant transcript 2, NEAT2),是在多种癌症中过度表达的lncRNA,其高表达与高增殖和肿瘤生长、转移相关[13-14],而沉默MALAT1表达可抑制迁移、转移和降低致癌性[15]。VSMC过度增殖及迁移是AS及CHD发病的病理基础,而MALAT1是否参与上述疾病的发生及二甲双胍是否通过影响MALAT1表达而发挥其抗AS作用未见文献报道。本研究首次发现CHD患者外周血中MALAT1表达较无CHD的对照人群显著升高。体外研究显示,敲减VSMC中MALAT1表达能抑制VSMC的活力和迁移,但对其凋亡无明显影响;同时,二甲双胍给药后MALAT1表达呈时间依赖性降低,由此提示二甲双胍可能通过下调MALAT1表达而抑制VSMC活力和迁移。因下调MALAT1表达后对VSMC凋亡无明显影响,推测二甲双胍靶向下调MALAT1表达可能通过影响增殖相关因子或非典型促凋亡通路而发挥其抑制VSMC增殖及迁移作用。此外,本研究采用的人VSMC细胞系未模拟AS模型给予相应处理而有可能导致VSMC反应与AS病变的VSMC有一定的差异性。
p53是被广泛研究的转录因子,其激活效应包括诱导细胞周期阻滞、细胞凋亡、自噬和衰老以及抑制侵袭、迁移、干细胞重建和代谢重编程[16-17]。MALAT1沉默可导致p53和其靶标如p21激活,Tripathi等[18]在HeLa、U2OS和WI-38-VA13等癌细胞系中沉默MALAT1后发现其具有弱的p53活性,提示p53可能是MALAT1的下游靶分子。本研究在VSMC中敲减MALAT1表达,发现p53 mRNA水平及蛋白表达均显著升高,与已报道的研究结果相一致。结合二甲双胍可呈时间依赖性降低MALAT1表达,推测二甲双胍可能靶向MALAT1而激活p53表达。
综上所述,二甲双胍可能靶向MALAT1而调控VSMC活力及迁移,且该效应可能与p53的激活有关,但二甲双胍、MALAT1及p53之间具体的分子作用机制有待进一步研究。

