外加碳源对蚯蚓-污泥系统细菌群落结构的影响
李春蕊, 徐 敏, 宋志文, 梁沪莲, 徐爱玲*
(1.青岛理工大学 环境与市政工程学院,山东 青岛 266033;2.青岛市市容环境卫生管理中心, 山东 青岛 266073)
利用生物对有机废弃物进行资源化处理已成为当今可持续发展的一个重要思路[1]。蚯蚓被认为是生态系统的工程师[2],利用蚯蚓生物反应器实现有机废弃物消解及资源化的研究及应用受到越来越多的关注。与其他处理方式相比,蚯蚓消解污泥、动物粪便和垃圾具有低成本、安全、高效等优点,是现阶段大规模低成本处理有机废弃物行之有效的方法[3]。蚯蚓还可以用来调节土壤肥力、修复污染土壤、抑制虫害与土传病害等[4-7]。蚯蚓的生态功能与微生物密切相关,它可以通过调节微生物数量以及活性来影响对有机质的分解[8]。研究表明,蚯蚓的肠道运转显著改变了基质微生物群落组成[9]。蚯蚓的肠道微生物来自其所处环境,但与周围环境微生物群落结构又存在较大差别,且蚯蚓能通过物理运动和排泄蚓粪改变环境微生物群落组成[10-11]。蚯蚓对周围环境中微生物的影响包括直接效应[12-13]和间接效应[14]两种方式。直接效应是指蚯蚓肠道通过对有机质和微生物的摄取、消化、吸收,包括增加有机质的表面积和改变微生物群落的构成,来影响有机物的分解速率[15-16];而间接效应是直接效应的延伸,包括蚓粪的熟化过程和蚓粪与基质的混合,以及排泄出的蚓粪对周围环境中微生物的影响,这个过程不需要蚯蚓的参与[17]。因此,了解基质与蚓粪中微生物的变化与关系非常重要。 研究表明,在蚯蚓处理技术中,有机物的降解是在水溶性阶段完成的,溶解性有机碳(Dissolved Organic Carbon,DOC)的含量决定微生物种群结构和代谢类型[18]。本研究在构建蚯蚓-污泥系统的基础上,采用Illumina MiSeq高通量测序方法,研究外加葡萄糖、乳糖、淀粉、纤维素4种碳源对污泥和蚓粪的细菌多样性及群落结构组成的影响,对于揭示不同碳源影响下蚯蚓肠道与蚓粪、污泥微生物间的相互关系,阐明污泥中有机质转化过程的微生物原理以及进一步研究蚯蚓的生态学功能具有重要意义。
1 材料与方法
1.1 材料
1.1.1 蚯蚓 选用赤子爱胜蚓(Eiseniafoetida),体长80 mm,体宽3~5 mm。
1.1.2 污泥 采自青岛某人工湿地污水处理系统,污泥理化指标见表1。
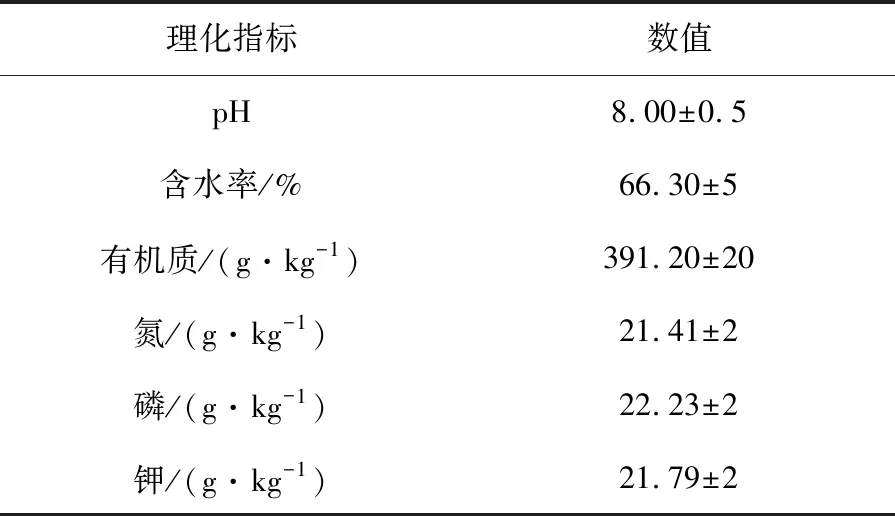
表1 污泥基本理化指标
1.1.3 养殖装置 采用HDPE周转箱(长40 cm×宽20 cm×高20 cm)。每个养殖装置内污泥添加量500 g,均放入蚯蚓30 条。养殖装置上部覆有纱网,养殖期间温度(22±0.5) ℃,湿度65%。
1.1.4 主要仪器与设备 E. Z. N. A. Soil DNA Kit试剂盒(OMEGA,美国);微量核酸蛋白分析仪(Implen公司,德国)。
1.2 方法
1.2.1 碳源添加 将蚯蚓放入养殖装置中养殖15 d,待其适应污泥环境后,在4 个养殖装置中分别添加葡萄糖、乳糖、淀粉、纤维素各2 g,再养殖15 d,同时设置无外加碳源的对照组,养殖期满30 d后分别提取实验组和对照组污泥和蚓粪DNA。A0、A1、A2、A3、A4分别表示对照组和添加葡萄糖、乳糖、淀粉、纤维素实验组的污泥样品;B0、B1、B2、B3、B4分别表示对照组和添加葡萄糖、乳糖、淀粉、纤维素实验组的蚓粪样品。
1.2.2 样品采集和总DNA提取 污泥采集选用分层、多点混合法,将采集的污泥样品放置于灭菌培养皿中,用灭菌镊子除去草根、碎石等,称取0.8 g于灭菌的2 mL离心管中,用E. Z. N. A. Soil DNA Kit试剂盒提取细菌总DNA,放入冰箱中冻存备用。30 d实验期结束后,从各养殖装置中手工分离10 条健康蚯蚓,自来水洗净污泥,用无菌水冲洗2~3次后放置于预先灭菌的培养皿,使蚯蚓在23 ℃恒温培养箱中吞吐20~24 h,收集新鲜蚓粪,称取0.8 g于灭菌的2 mL离心管中,采取与污泥样品一致的方法提取细菌总DNA。利用微量核酸蛋白分析仪对分离纯化后的DNA浓度与纯度进行检测,全部样品DNA波长260/280值均在1.8~2.0间。检测合格的基因组DNA样品进行高通量测序。
1.2.3 高通量测序及数据分析 委托上海派森诺生物科技股份有限公司,利用Illumina MiSeq平台对16S rRNA V3~V4区进行高通量测序。采用滑动窗口法对双端的FASTQ序列做质量过滤,利用软件FLASH(version 1.2.7,http://ccb.jhu.edu/software/FLASH/)[19]对通过质量过滤的序列进行连接,对连接上的序列进行过滤和去除嵌合体,然后对得到的优质序列进行OTU聚类和注释,绘制稀释曲线(Rarefaction curve),进行多样性指数分析,并在不同分类水平上进行物种丰度差异分析和微生物群落结构组成的统计分析。利用NCBI BLAST将查到菌种的信息与测序得到的微生物信息进行比对,对信息不全的细菌进行补充,然后分析细菌门、纲和OTU比例>0.1%优势种。
2 结果与分析
2.1 物种丰度
2.1.1 OTU稀释性曲线 图1为各实验组和对照组污泥和蚓粪稀释曲线[20]。从图1中可以看出,不同处理条件下污泥和蚓粪的稀释曲线基本趋于平缓,表明每个样品测序深度已基本覆盖到样品中所有的物种,即测序量足够。
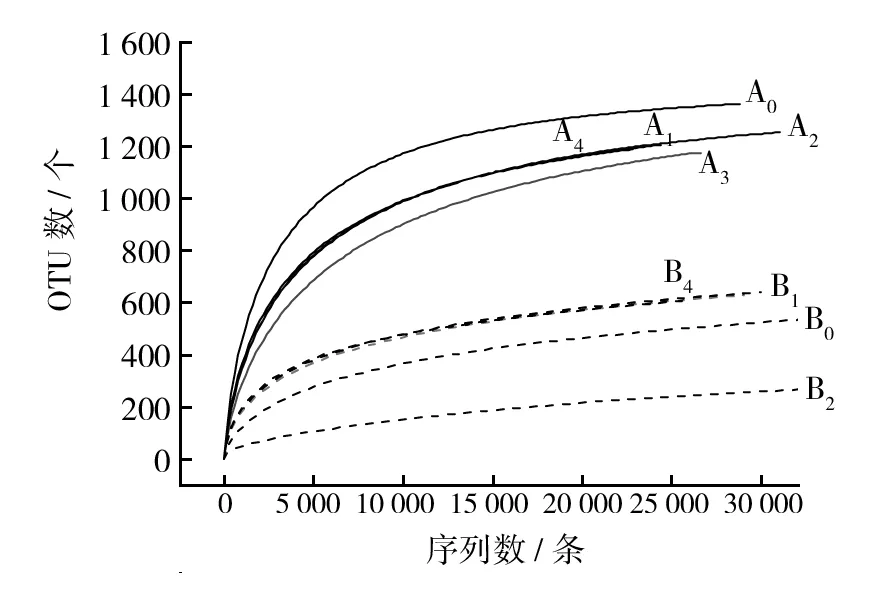
图1 污泥和蚓粪稀释曲线Fig.1 Rarefaction curves of sluge and vermicompost
2.1.2 Alpha多样性分析 实验组和对照组污泥和蚓粪的Alpha多样性指数(Alpha diversity)[21]见表2。其中,Chao和ACE是常用于估算样本物种丰度的指数,数值越大,表明样品中的物种种类越多;Shannon指数和Simpson指数是用来估算样品中微生物多样性的指数[22],Shannon指数越大,说明菌群多样性越高,Simpson指数越小,说明菌群多样性越高[23]。
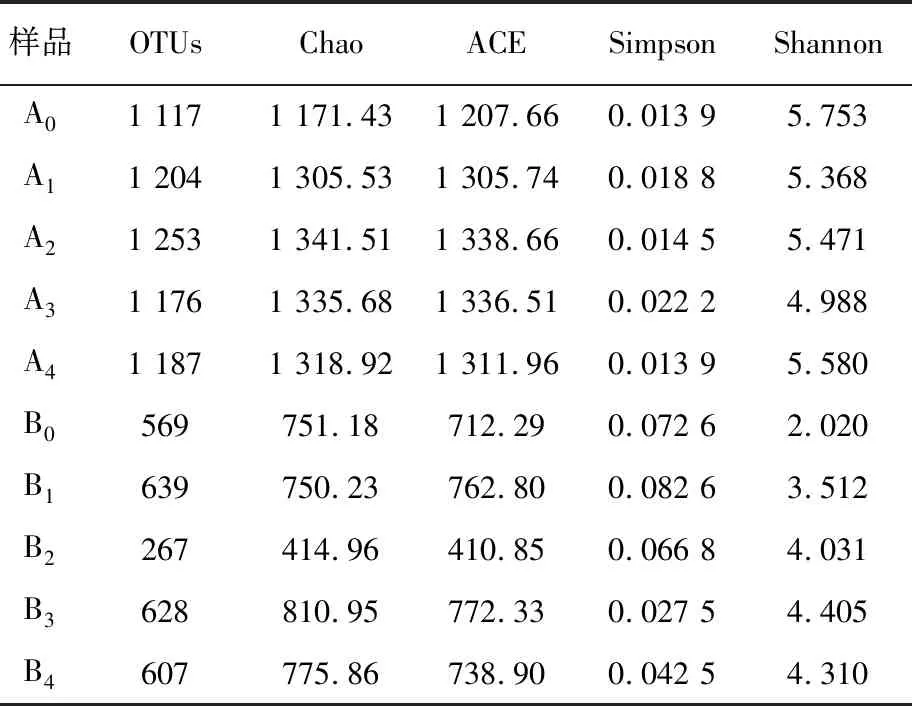
表2 污泥和蚓粪样品中Alpha多样性指数
从表2结果可以看出,所有污泥样品的Chao和ACE数值均明显高于蚓粪样品,说明污泥中细菌种类多于蚓粪,添加不同碳源的实验组间污泥(A1~A4)Chao和ACE指数差别不大,但均高于对照组(A0),说明添加碳源可增加污泥中细菌种类。添加葡萄糖(B1)、淀粉(B3)和纤维素(B4)实验组间蚓粪的Chao和ACE指数相近且高于对照组(B0),但乳糖(B2)实验组Chao和ACE指数明显低于对照组(B0),说明添加乳糖可使蚓粪中细菌种类降低。Simpson和Shannon指数也得到与Chao和ACE相似的结果。
2.2 细菌群落结构组成分析
2.2.1 门分类水平分析 污泥和蚓粪实验组和对照组的细菌门水平分布情况见图2,污泥实验组(A1~A4)和对照组(A0)分别检测出22、20、20、21和20个门;蚓粪实验组(B1~B4)和对照组(B0)分别检测出15、13、15、17和15个门,数量均低于相应处理的污泥,其中乳糖组蚓粪(B2)门的数量低于对照组(B0)。 污泥实验组(A1~A4)和对照组(A0)检测出的优势菌门基本相同,主要包括:变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes)和Saccharibacteriae。其中,所有样品第一优势菌门均为变形菌门,相对丰度30.83%~55.45%,淀粉组(A3)最高,葡萄糖组(A1)最低。第二优势菌门均为拟杆菌门,相对丰度14.20%~25.05%,对照组最高,淀粉组(A3)最低。另外,对照组(A0)中检测到绿菌门(Chlorobi),但实验组中没有检测到。 蚓粪实验组(B1、B3和B4)和对照组(B0)检测到的优势菌门种类基本相同,包括:拟杆菌门、变形菌门、疣微菌门(Verrucomicrobia)、厚壁菌门和放线菌门;蚓粪乳糖组(B2)的优势菌门与其余组蚓粪相比种类减少,包括:变形菌门、拟杆菌门、厚壁菌门和柔膜菌门(Tenericutes)。葡萄糖组(B1)、淀粉组(B3)、纤维素组(B4)和对照组(B0)第一优势菌门均为拟杆菌门,相对丰度41.34%~65.45%,对照组最高(B0),淀粉组(B3)最低,第二优势菌门均为变形菌门,相对丰度16.29%~33.32%,淀粉组(B3)最高,葡萄糖(B1)组最低。而乳糖组(B2)第一优势菌门则为变形菌门,相对丰度为83.96%,第二优势菌门为拟杆菌门,相对丰度7.44%,另外,乳糖组(B2)检测到柔膜菌门(Tenericutes),相对丰度为2.60%,其他实验组和对照组均未检出。

图2 污泥和蚓粪门分类水平上的微生物群落组成Fig.2 Microbial community composition of sludge and vermicompost at phylum level
2.2.2 纲分类水平分析 污泥和蚓粪实验组和对照组细菌纲水平的分布情况见图3。污泥实验组(A1~A4)和对照组(A0)分别检测到43、41、42、43和32个纲,实验组(A1~A4)纲的数量均高于对照组(A0);蚓粪实验组(B1~B4)和对照组(B0)分别检出29、19、35、30和23个纲,数量低于相应污泥,其中蚓粪乳糖组(B2)纲的数量低于对照组(B0),其他实验组(B1、B3和B4)纲的数量则高于对照组(B0)。 污泥实验组(A1~A4)和对照组(A0)中检测到的优势菌纲基本相同,主要包括:γ-变形菌纲(Gammaproteobacteria)、芽胞杆菌纲(Bacilli)、黄杆菌纲(Flavobacteriia)、放线菌纲(Actinobacteria)、噬纤维菌纲(Cytophagia)、α-变形菌纲(Alphaproteobacteria)、β-变形菌纲(Betaproteobacteria)、酸杆菌纲(Acidobacteria)、Dehalococcoidia、鞘脂杆菌纲(Sphingobacteriia)、δ-变形菌纲(Deltaproteobacteria)、厌氧绳菌纲(Anaerolineae)、Gemmatimonadales和Micrococcales。其中,实验组(A1~A4)的前两位优势菌纲均为γ-变形菌纲和芽胞杆菌纲,γ-变形菌纲相对丰度分别为14.35%~4615%,芽胞杆菌纲相对丰度10.60%~20.21%;对照组(A0)第一优势菌纲为γ-变形菌纲,相对丰度16.60%,其余9个菌纲相对丰度相似,范围为6%~8%。 蚓粪实验组(B1、B3和B4)与对照组(B0)中优势菌纲基本相同,但与污泥存在较大差异。主要包括:黄杆菌纲、γ-变形菌纲、芽胞杆菌纲、噬纤维菌纲、放线菌纲、α-变形菌纲、疣微菌纲(Verrucomicrobiae)、鞘脂杆菌纲和β-变形菌纲;蚓粪乳糖组(B2)与其余组蚓粪相比优势菌纲减少的种类较多,此组蚓粪的优势菌纲有γ-变形菌纲、黄杆菌纲、芽胞杆菌纲、鞘脂杆菌纲和柔膜菌纲(Mollicutes)。其中,葡萄糖组(B1)、淀粉组(B3)、纤维素组(B4)和对照组(B0)的第一优势菌纲和第二优势菌纲均为黄杆菌纲和γ-变形菌纲,而蚓粪乳糖组(B2)第一优势菌纲和第二优势菌纲则为γ-变形菌纲和黄杆菌纲,相对丰度分别为83.08%和6.53%,另外,蚓粪乳糖组(B2)检测到柔膜菌纲(Mollicutes),相对丰度2.60%,其他实验组和对照组均未检出。
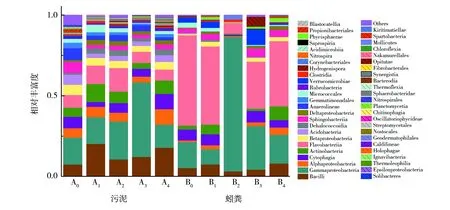
图3 污泥和蚓粪纲分类水平上的微生物群落组成Fig.3 Microbial community Composition of sludge and vermicompost at classes level
2.2.3 优势属种分析 对污泥和蚓粪实验组和对照组细菌的优势属种(OTU比例超过0.1%的细菌序列)进行分析,结果见图4。污泥实验组(A1~A4)和对照组(A0)中优势属种分别为58、59、58、58和50个,实验组优势属种数量均高于污泥对照组;蚓粪实验组(B1~B4)和对照组(B0)样品优势属种分别为55、47、56、58和49个,乳糖实验组(B2)优势属种数量低于蚓粪对照组,其他实验组优势属种数量则高于蚓粪对照组。 污泥实验组(A1~A4)和对照组(A0)相对丰度较大的优势属种包括Lactococcuspiscium、Bacillustoyonensis、Enterococcushirae、Dehalogenimonasalkenigignens、Thermomarinilinealacunifontana、Pseudomonasguineae和Flavobacteriumtructae。虽然实验组添加的碳源不同,但不同实验组中部分优势属种相对丰度与对照组相比出现类似变化,如T.lacunifontana相对丰度降低,F.tructae和P.vancouverensis相对丰度增加,同时有些实验组出现特有优势属种,如乳糖组(A2)的F.reichenbachii(7.02%)、淀粉组(A3)的Alkanindigesillinoisensis(5.73%)和Zobellellataiwanensis(4.34%)、纤维素组(A4)的Cellvibriogandavensis(5.15%)等。 蚓粪葡萄糖组(B1)、淀粉组(B3)、纤维素组(B4)和对照组(B0)共有的相对丰度较大的优势属种包括F.resistens、F.tructae、Shewanellaputrefacien、Paracoccusaminophilus、P.guineae、F.hibernum、Chryseobacteriumculicis、L.piscium、B.toyonensis、E.hirae、Algoriphaguschungangensis、Arenimonasdaejeonensis、Phycisphaeramikurensis。蚓粪乳糖组(B2)优势属种与其余组差异明显,前两位优势属种为Aeromonaspopoffii(40.96%)和A.rivipollensis(31.58%),相对丰度之和>70%,第三优势属种为F.reichenbachii(3.26%)。另外,淀粉实验组出现的特有优势属种有A.illinoisensis(7.80%)、Z.taiwanensis(2.36%)和Lacunisphaeraanatis(4.62%),纤维素实验组出现的特有优势属种为C.gandavensis(4.69%)。 尽管污泥实验组(A1~A4)与蚓粪实验组(B1~B4)优势属种存在明显差异,但在添加同一碳源的污泥和蚓粪实验组中都能发现相同的优势属种,如葡萄糖组污泥(A1)和蚓粪(B1)的F.tructae和L.piscium,乳糖组污泥(A2)和蚓粪(B2)的F.reichenbachi,淀粉组污泥(A3)和蚓粪(B3)的A.illinoisensis和Z.taiwanensis以及纤维素组污泥(A4)和蚓粪(B4)的C.gandavensis。
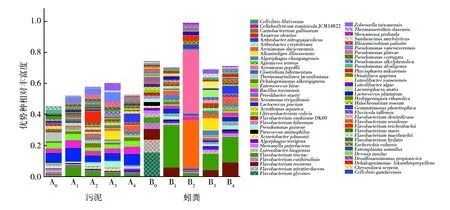
图4 污泥和蚓粪优势菌种的相对丰度Fig.4 The most abundant bacterial at genus lever in sludge and vermicompost
3 讨 论
蚯蚓肠道内的生物化学反应相当复杂,不同微生物对肠道环境反应存在差异[24-25]。通过蚯蚓肠道加工后,土壤中微生物区系和群体数量发生显著变化[26],有些细菌在通过肠道的过程中被激活,一些不受影响,另外一些数量减少[27-28],同时蚯蚓存在自己的肠道微生物或者共生体[29]。本研究发现,蚯蚓-污泥系统中污泥与蚓粪细菌群落结构存在差异,蚓粪的Chao和ACE指数低于污泥,蚓粪的细菌种类明显少于污泥的细菌种类,并且蚓粪的优势菌门、菌纲和优势属种的组成与相应的污泥相比均发生一定变化,酸杆菌门、绿弯菌门和芽单胞菌门以及酸杆菌纲、厌氧绳菌纲和芽单胞菌纲在污泥中相对丰度较大,但在蚓粪中明显降低,而疣微菌门在除乳糖组(B2)的其他组蚓粪中相对丰度增加,揭示了蚯蚓肠道对微生物群落具有调节作用。
Knapp等[30]在蚯蚓L.Rubellus肠道内发现了与摄取食物来源无关的γ-变形菌,König等[31]报道变形菌门尤其是γ-变形菌纲在土壤无脊椎动物体内大量存在。从本研究结果看,污泥及蚓粪实验组和对照组中γ-变形菌纲均为绝对优势菌纲,但与污泥相比,除蚓粪乳糖组(B2)与纤维素组(B4)外,其他蚓粪实验组和对照组中γ-变形菌纲相对丰度均有所降低,乳糖组(B2)大幅提高了36.93%,纤维素组(B4)则提高3.31%。添加不同碳源会使蚓粪细菌多样性发生变化,除乳糖组(B2)细菌多样性降低外,其余蚓粪实验组的细菌多样性均增加,且不同碳源系统的蚓粪细菌群落结构存在差异。另外,在属种水平上,蚓粪乳糖组(B2)也表现出与其他组存在差异。蚓粪乳糖组(B2)检测出柔膜菌门,在其他样品中均未发现,柔膜菌门营养要求苛刻,推测原因与添加乳糖后蚯蚓肠道环境变化有关。
与本研究结果不同,Gomez-Brandon等[32-33]用不同食物(牛粪、马粪、猪粪)喂食蚯蚓(E.andrei),发现食物通过肠道后,呈现总微生物量减少、细菌数量减少、真菌数量没有变化的情况,但食源不同的蚓粪中微生物群落结构并没有显著差异;用不同食物(牛粪、马粪、兔粪)喂食3种蚯蚓(E.andrei、E.fetida、Perionyxexcavatus)1个月,蚓粪中细菌群落结构也没有显著性差异。分析原因可能为,尽管牛粪、马粪、兔粪来源不同,但其基本有机物质组成类似,而本研究碳源中淀粉和纤维素经酶水解后都产生葡萄糖单体,所以其在蚯蚓体内的生化反应过程与葡萄糖类似,但参与乳糖代谢的酶多为诱导酶,并且部分细菌不能直接利用乳糖作为碳源和能源,导致蚯蚓肠道内乳糖代谢过程与葡萄糖存在较大差异,从而进一步影响污泥和蚓粪的微生物群落结构组成。
蚯蚓肠道对微生物的群体结构及生物活性的调节作用可提高特定微生物种群的繁殖速度及呼吸代谢活性,在一定程度上也强化微生物降解有机物的作用,提高有机物的降解效率[34-35]。蚯蚓肠道绝对优势菌门为拟杆菌门和变形菌门,Bernard等[36]研究发现拟杆菌门在有机物分解过程中起着关键作用,可为某些特定细菌提供生长介质,并且赋予它们特定的分解能力分解有机物。变形菌门被认为是顽固有机物如木质纤维素的有效降解者[37]。研究发现,添加不同碳源的同一组污泥与蚓粪中都检出适应特定碳源的细菌类型。如污泥和蚓粪葡萄糖实验组中L.piscium相对丰度高于其他实验组,L.piscium为革兰阳性球菌,10~25 ℃条件下生长繁殖快,能发酵葡萄糖;污泥和蚓粪乳糖实验组中F.reichenbachii相对丰度高于其他实验组,F.reichenbachii为革兰阴性菌,适宜生长温度20~34 ℃,可产生水解乳糖的酶;污泥和蚓粪淀粉实验组中A.illinoisensis和Z.taiwanensis相对丰度明显高于其他实验组,有研究表明Z.taiwanensis能够通过异养硝化和好氧反硝化作用去除废水中氨氮[38];污泥和蚓粪纤维素实验组中C.gandavensis相对丰度高于其他实验组,C.gandavensis是一种能降解纤维素的中温好氧菌。

