右心辅助在心脏移植术后脱机困难患者中的初步应用
林中林,周成斌,吴 敏,黄劲松,章晓华,陈寄梅,庄 建
心脏移植(heart transplantation,HT)是治疗终末期心脏病的重要手段[1]。而肺动脉高压(pulmonary hypertension,PH)是心血管外科疾病的常见并发症[2]。术前潜在的或临界状态的PH若是在体外循环下的HT手术后仍不能有效缓解,升高的肺动脉压力将引起右心衰竭,从而导致体外循环脱机困难[3]。针对这一现象,开展右心辅助,克服PH,将流向右心的静脉血注入肺动脉,使左心前负荷充盈,帮助HT患者脱离体外循环。本研究总结右心辅助在HT术后因PH引起体外循环脱机困难中的应用经验。
1 材料与方法
1.1 一般资料 自2016年6月至 2017年8月,4例终末期心脏病患者接受HT,其中男性3名,女性1名,有2例患者诊断为扩张性心肌病,2例为缺血性心脏病。 平均年龄(41±4.8)岁,平均体重(58±9.0)kg,术前平均肺动脉压(57.5±0.71)mm Hg,平均肺血管阻力(7.8±0.67)Wood。 以上患者均采用双腔法同种异体原位HT。供体均为被诊断为脑死亡,年龄(31±5)岁,平均心脏冷缺血时间(235±18)min。供体心脏心肌保护方法:灌注安贞2号冷晶体停搏液,心脏停搏后灌注HTK溶液(康斯特)1000 ml,供心保存于4℃保存液中,每隔2 h从主动脉根部灌注HTK液1000 ml。
1.2 右心衰诊断 HT术中体外循环试停机后出现右心膨胀且收缩无力、右房压或中心静脉压>20 mm Hg、左房压<15 mm Hg、心脏指数<1.8 L/(min·m2)、每小时尿量<1 ml/kg、超声心动提示右心扩大和三尖瓣返流、循环难以维持。在排除左心衰的基础上符合上述2条以上标准可临床诊断为HT术后右心功能衰竭。
1.3 右心辅助环路的安装和管理 HT术中供心吻合完毕后,停用体外循环后见供心膨胀,在行第二次转流15 min后,使用MAQUET离心泵及10 mm管路,在主肺动脉处缝合一段8 mm人造血管,从剑突下引出,再经人造血管插入18 F股动脉插管作为肺动脉灌注管,经皮穿刺右侧股静脉插入24 F股静脉插管至右心房,作为右心引流管,连接离心泵泵头。将离心泵管道预充血液后连接肺动脉段人造血管,形成一个闭合循环(其血流途径是:右心房→离心泵→肺动脉)。
安装完毕后患者均常规使用鱼精蛋白中和肝素,止血和关胸。根据术后出血以及右心辅助环路血栓生成情况决定抗凝程度,采用肝素抗凝,每2 h监测活化凝血时间(activated clottingtime,ACT)维持在 180~220 s。 调整辅助流量,维持在 2.0~2.3 L/min, 转速 1530~1600 r/min,保持混合静脉血氧饱和度>70%。连接温水箱保持血液温度35~36.5℃,并注意患者肢体的保暖,维持适宜的环境温度。右心辅助期间严密监测血气、电解质、尿量及其他血流动力学参数,及时发现和处理异常。合理补充晶体和胶体,维持晶/胶平衡,输血以新鲜血和血浆为宜。辅助期间尽量降低正性肌力药物用量,机械辅助通气模式为辅助控制通气或同步间歇强制通气加压力支持。辅助期间给予瑞莫杜林降肺压。
每日常规检测血气、血常规、各项生化指标,维持血小板计数>50×109/L,加强呼吸道管理,严密监测患者肢体温度、皮肤颜色和足背动脉搏动情况,以防缺血。红细胞比容维持在0.25以上。
1.4 右心辅助的撤除 当患者不依赖正性肌力药物的情况下,胸部X线片提示无明显异常,血气分析结果正常,且无电解质及酸碱平衡紊乱。超声心动图提示心脏射血分数(ejectionfraction,EF)≥60%,静脉氧饱和度>75%,平均肺动脉压(mean pulmonary arterial pressure,MPAP)<40 mm Hg,右心辅助流量<2.0 L/min,便可开始进行撤机试验。具体操作为:逐渐减低血流量,调整呼吸机参数(氧浓度、吸气平台压、呼气末正压、通气频率),控制抗凝剂的剂量,维持稳定的凝血指标,若MPAP<40 mm Hg和动脉氧饱和度>95%可持续1 h以上,且动脉二氧化碳分压<50 mm Hg,即可撤机。撤离时拔出剑突下插管,结扎人造血管埋于皮下,股静脉插管拔出后压迫止血。胸部X线片提示无明显异常,血气分析结果正常,且无电解质及酸碱平衡紊乱。
1.5 方法 辅助前后分别记录患者的CVP、心输出量( cardiac output,CO)、平均动脉压(mean arterial pressure,MAP)、 肺动脉压(pulmonary arterial pressure,PAP)以及 EF等数据。
2 结 果
4例患者的右心辅助相关资料和临床结果见表1。4例患者经右心辅助后MPAP、CVP明显下降,CO、MAP和EF明显上升。患者脱机率100%,均顺利出院。辅助期间无机械装置故障发生,无管道血栓形成,无脑出血,脑梗塞,感染等并发症。
3 讨 论
目前同种异体HT已成为终末期心脏病最为有效的治疗手段,使终末期心脏病患者有了新的生存希望[1]。PH作为终末期心脏病的严重并发症,被视为HT的高危因素,增加围手术期的死亡率[4],但是绝大多数患者在HT术前其肺动脉压力都已经有不同程度升高,而这正是引起术后急性右心功能衰竭的重要因素[5]。术前潜在的或临界状态的PH在体外循环下的心脏手术后仍不能有效缓解,升高的肺动脉压力将引起右心衰竭,导致体外循环脱机困难,与HT术后早期死亡率密切相关。这种心脏外科手术中因肺动脉高压造成体外循环脱机困难,并且使用血管活性药物和降肺压药物无效的情况下,应考虑及时应用右心辅助装置。有效控制PH和维持良好的右心功能是HT成功的关键[6]。
针对这一现象临床开展使用机械辅助循环(mechanical circulatory support,MCS)其主要目的包括:维持循环灌注、减少心脏做功、降低心脏的氧耗。目前因PH而造成HT术后脱离体外循环困难开展了右心辅助,能够帮助右心室克服肺血管阻力,保证右心室的血液通过肺循环进入左心,从而顺利脱离体外循环和为降肺压药物的起效赢得治疗时间,并有可能扩大心外科疾病合并PH的手术适应证。
国内外大量的实验和临床研究认为,MCS能为终末期心脏病患者提供有效可靠的血流动力学支持,明显改善生活质量,减缓或逆转疾病的发展进程,促进心脏功能的恢复,部分患者甚至能够避免HT[4,8]。也有部分中心报道使用体外膜氧合(extracorporeal membrane oxygenation,ECMO)辅助稳定 HT患者的循环[9]。但与右心辅助相比较,ECMO费用高,抗凝要求高,操作较复杂,且更为重要的是感染,脑出血,脑栓塞,多器官功能衰竭等并发症的风险更高[6]。
从目前临床应用效果来看,右心辅助循环仍是挽救严重右心功能衰竭的强有力的措施,对它的未来发展充满着希望和信心。随着研究的深入和技术的进步,更多性能优良的MCS将越来越多地用于临床,挽救更多终末期心脏病患者的生命。
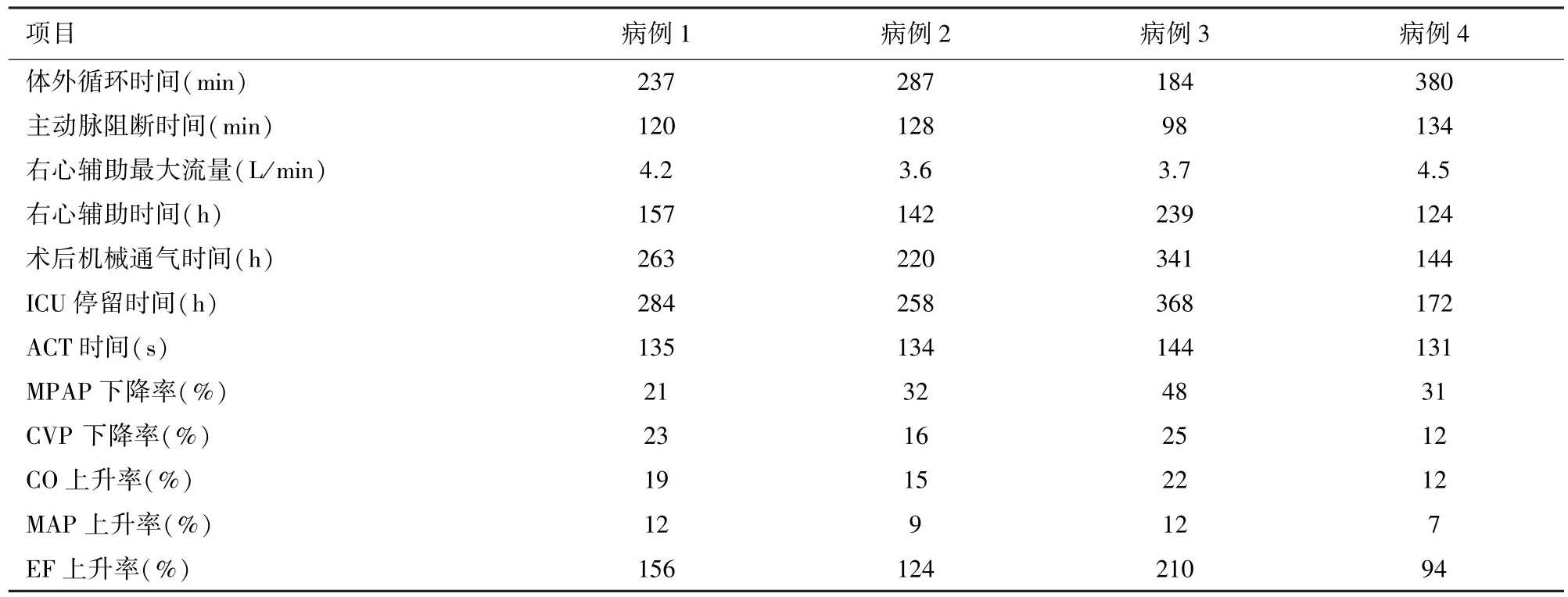
表1 4例患者的右心辅助相关资料及临床结果
4 结 论
总之,在HT术后因PH造成体外循环脱机困难,本组采用右室辅助装置可使患者恢复心功能,顺利脱离体外循环,脱机率100%,并为降肺压药物的起效赢得了宝贵时间,以及为患者后续在ICU的恢复治疗提供了良好条件,从而大大提高患者的生存率。

