兔心肺转流模型中乙醛脱氢酶2活化的心肌保护研究
邹丽华,刘晋萍,张 浩,童媛媛,唐 跃
1 材料与方法
1.1 实验耗材及试剂 膜式氧合器(Terumo baby Fx05,日本 Terumo 公司),双头滚压泵(德国 Stöckert公司),气管导管(美国Covidien公司),HTK液(批号:1208621,德国kohler化学制药公司),20 G中心静脉导管(中国深圳益必达公司)。Alda-1(25 mg,美国Sigma公司),为ALDH2特异性激动剂,经心肌灌注旁路给药,剂量为 8 mg/kg[4]。
1.2 实验动物及分组 新西兰白兔15~20周龄,体重2~3.5 kg,经动物伦理委员会批准(2013-4-150-GZR),由阜外医院动物实验中心提供。21只新西兰白兔随机分CPB不停跳组(C组,n=7)、停跳组(CA 组,n=7)、Alda-1组(CAA 组,n=7)。 另21只新西兰白兔作为供血兔,用作CPB管路预充,尽管新西兰兔存在血型,但抗原性较弱,因此同一品种的兔血不会发生溶血反应[5]。所有动物术前禁食6 h,禁饮 2 h。
1.3 建立新西兰兔CPB模型 新西兰兔入室称重,耳缘静脉置管开放静脉通路,2.5%戊巴比妥钠3~4 ml进行麻醉诱导后,经口气管插管(3.5#)行机械通气,设定氧浓度35%,通气量1 L/min,潮气量约 35~40 ml、呼吸频率 30~35 次/min、吸呼比1∶1.5。切开右腹股沟,右股动脉22 G套管针穿刺置管持续监测动脉血压,监测心电图(electrocardiography,ECG)、心率。16 G套管针置入右腋动脉,用于CPB动脉灌注。中心静脉导管(20 G)置入左腋动脉,尖端位于主动脉根部作为停搏液灌注管路。正中开胸暴露右心房,切开右心房,插入带侧孔的静脉插管(16 Fr)作为静脉引流,调整静脉插管位置,确保引流通畅后7-0尼龙线固定。若操作中发现实验兔存在左腋动脉解剖变异或置管失败导致出血,则立即止血后正中开胸,经主动脉根部置入22 G套管针并荷包缝合。
CPB管路预充液由50 ml新西兰白兔新鲜全血、5 ml复方电解质注射液(勃脉力)、10 ml琥珀酰明胶、5 ml碳酸氢钠注射液组成,实验兔全身肝素化(400 IU/kg)且ACT>480 s后开始CPB,维持流量100~ 120 ml/(kg·min),PaO2100 ~ 300 mm Hg,PaCO235~45 mm Hg。C组行常规CPB且心脏不停跳,CA组及CAA组进行CPB及心脏停跳处理,即肛温降至30℃后阻断升主动脉,灌注4℃ HTK液,剂量为 40 ml/kg,灌注起始压力控制在 80~100 mm Hg,灌注维持压力为40~60 mm Hg,灌注时间4~5 min,吸走右心房HTK液避免回收至储血室引起血液稀释,心脏停跳后表面覆盖冰屑。CPB期间肛温维持在28℃左右,缓慢复温至30℃后开放主动脉,阻断时间为120 min。开放主动脉后行全流量辅助循环,时间约60 min,复温至直肠温36℃以上调整CPB流量,生命体征平稳后停机,实验观察至心脏恢复灌注120 min(CPB实验流程见图1)。
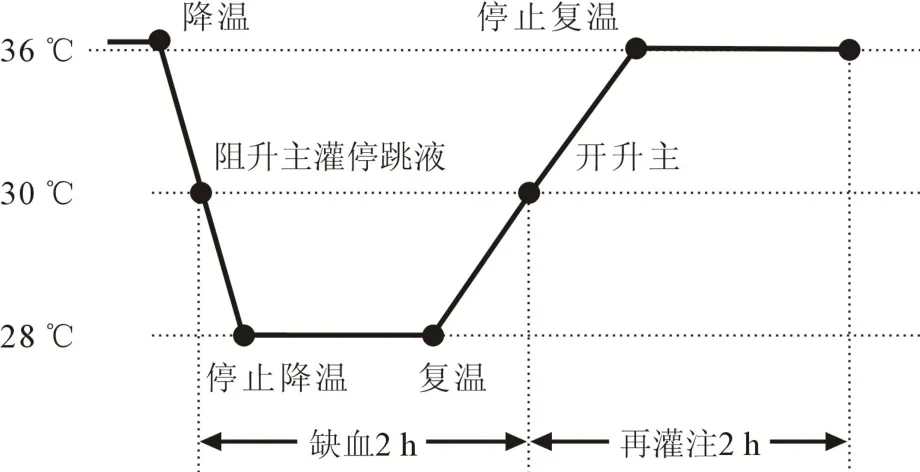
图1 兔CPB实验流程示意图
1.4 监测指标及取材 在CPB开始前(T1)、阻断前(T2)、阻断 120 min(T3)、开放后 5 min(T4)、停机后(T5)五个时点采集股动脉全血3 ml行血气分析及心肌型肌酸激酶同功酶(MB isoenzyme of creatine kinase,CKMB)检测。血样在4℃下4000 rpm离心15 min,取上清液于-20℃冰箱保存。经心尖置入左心室测压管,连接生理多导仪(RM-6000型)监测心功能,记录三组动物实验终点时左室压力形成最大速率(+dP/dtmax)、最小速率(-dP/dtmin)、左室收缩末压(left ventricular end systolic pressure,LVESP)、左室舒张末压(left ventricular end diastolic pressure,LVEDP)。
实验兔在测定心功能后,取左心室心肌组织于-80℃冰箱保存。采用比色法检测ALDH2活性[2],采用免疫印迹法(Western blot)检测心肌组织4-HNE、MDA的表达,采用酶联免疫法(ELISA)检测ALDH2、氧化型与还原型谷胱甘肽(GSH/GSSG)、蛋白羰基(protein carbonyl,PC)、血清 CKMB 含量。
1.5 统计方法 计量资料以均数±标准差表示,计数资料以例数(百分比)表示。单因素方差分析用于三组间比较,两两比较采用LSD法。血清CKMB采用红细胞比容进行校正,采用重复测量ANOVA进行分析。数据采用SPSS 21.0进行统计分析,P<0.05表示差异具有统计学意义。
2 结 果
2.1 一般资料 所有实验兔均完成CPB模型建立,三组间实验兔的年龄、体重、CPB时间不存在统计学差异(P>0.05);CA组和CAA组间降温时间、复温时间、最低肛温、开放后室颤发生率无统计学差异(P>0.05)。 见表 1。
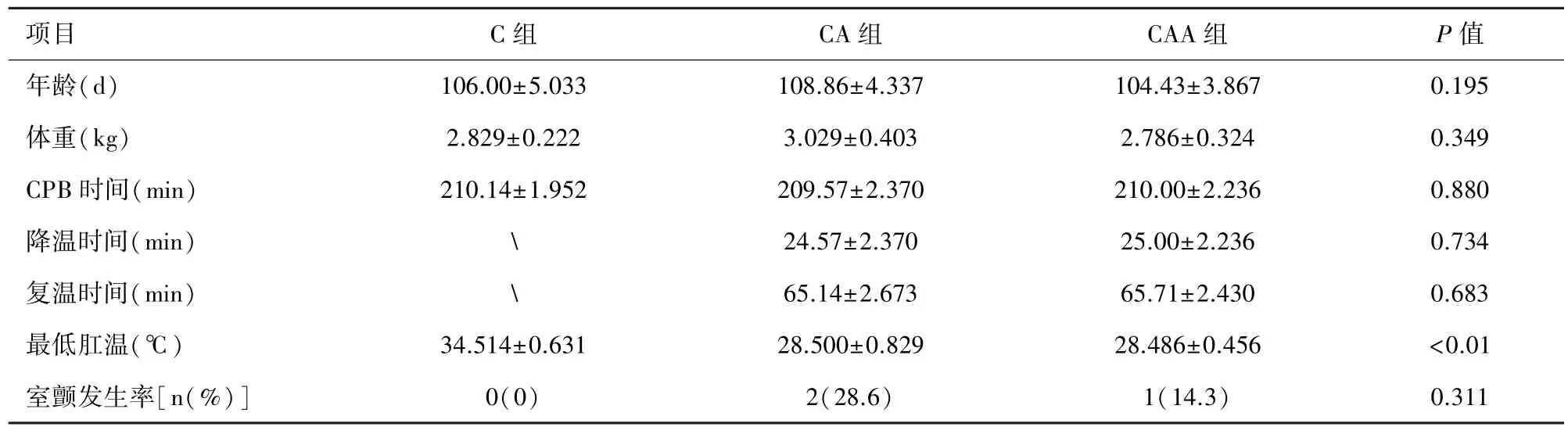
表1 实验动物的基础资料(n=7)
2.2 ALDH2含量及活性 ALDH2含量 C组为(45.93±2.86) μg/ml,CA 组为(44.89±5.38)μg/ml,CAA 组为(43.54±6.50)μg/ml,三组间比较无统计学差异(F=0.379,P=0.690)。 ALDH2 活性 C组为(2.85±0.33)U/mg,三组间比较存在统计学差异(F=16.706,P<0.001),CA 组较 C 组明显减低(P<0.001),CAA 组较 CA 组明显增加(P<0.001)。见图2。
消防用水储存于生产新水水池内,同时采取保证消防水不做他用的措施。厂区内大多为丁、戊类单层厂房,根据规范要求设置室内外消火栓给水系统,水池出水可满足消防供水压力。从消防水池设消防给水管网至厂区。
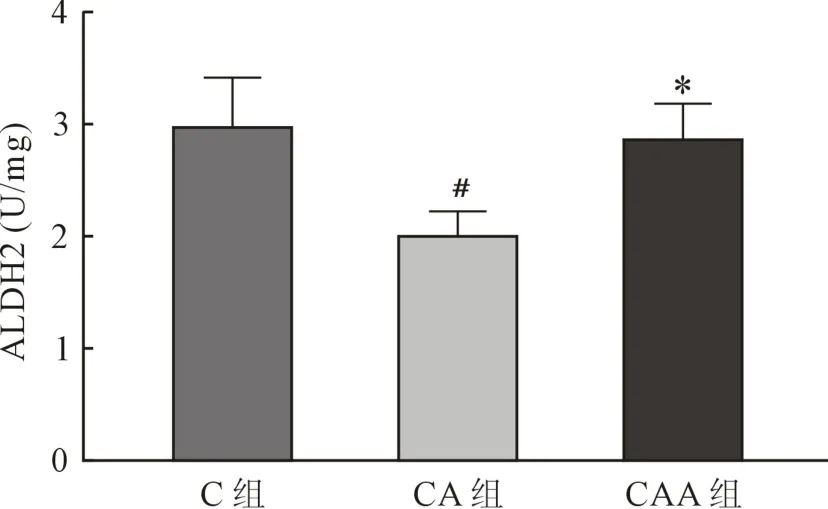
图2 心肌ALDH2活性
2.3 醛类及心肌氧化应激指标 CA组较C组心肌4-HNE及MDA含量明显增加(P<0.001)。Alda-1的应用使心肌醛类明显下降,CAA组与CA组相比存在统计学差异(P<0.005),表明心肌 ALDH2活化加强4-HNE、MDA的清除(图3A-B)。
氧化型谷胱甘肽(oxidized glutathione,GSSG)为谷胱甘肽(glutathione,GSH)氧化反应生成产物,GSH/GSSG可反映心肌氧化应激水平。GSH/GSSG CA组较C组明显减少(P=0.007)表明心肌缺血再灌注期间GSH消耗增加,CAA组较CA组明显增加(P=0.028),表明Alda-1激活ALDH2后氧化应激得以改善(图4)。
2.4 心肌损伤指标 三组间不同时点CKMB存在统计学差异[重复测量方差分析(ANOVA):F=25.402,P<0.001],时间与分组不存在交互效应(F=2.614,P= 0.057),三组间 CKMB 存在统计学差异(F=5.271,P=0.016),CKMB 水平 CA 组显著高于C组(P=0.006),Alda-1减轻 CKMB 释放,CAA组CKMB水平显著低于CA组(P=0.028)(图5)。
PC为心肌细胞氧化应激损伤指标,本研究发现CA组与C组相比PC水平明显升高(P=0.007),CAA组 PC水平较 CA组明显降低(P=0.012)(图 6)。
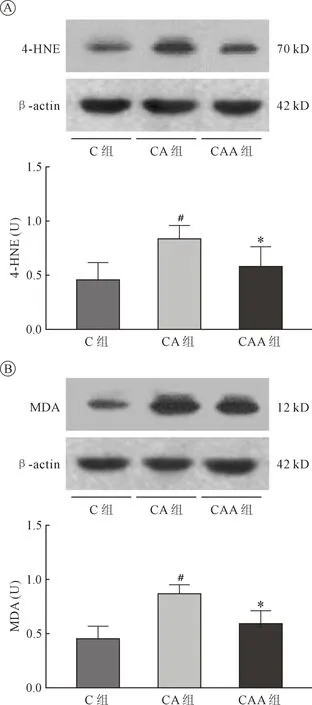
图3 4-HNE及MDA表达
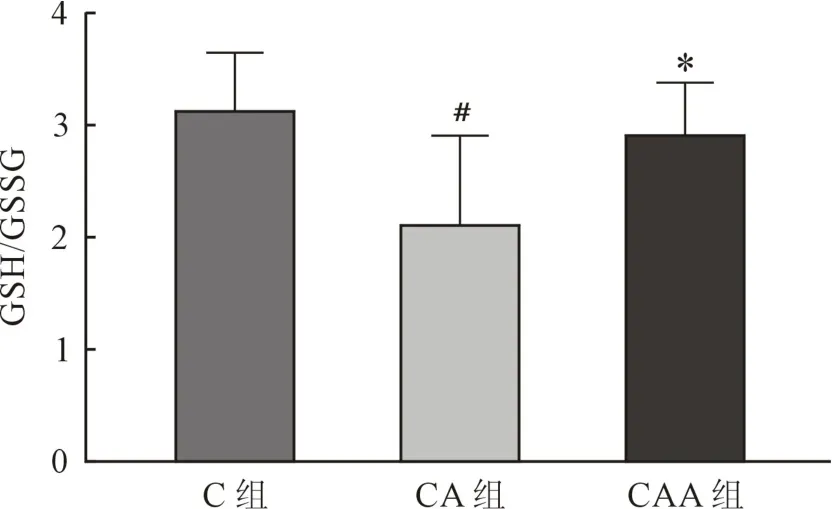
图4 GSH/GSSG水平
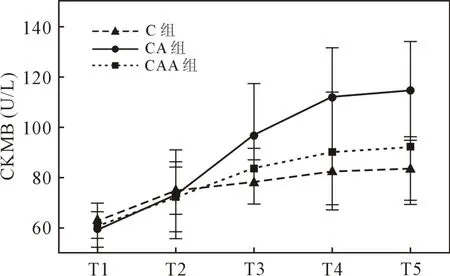
图5 不同时点血清CKMB水平
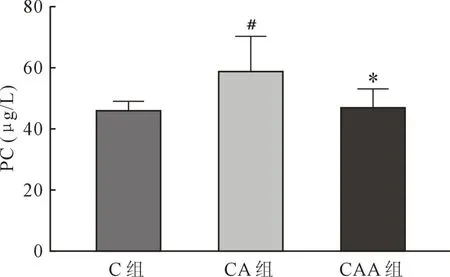
图6 三组心肌蛋白PC比较
2.5 心功能指标 停机后dp/dtmaxCA组较C组降低(P=0.032),Alda-1改善心肌收缩功能,CAA 组dp/dtmax较 CA 组明显增加(P=0.040),三组间 dp/dtmin无显著统计学差异(图7)。心率和平均动脉压、LVEDP、LVESP在三组间无统计学差异(见表2)。
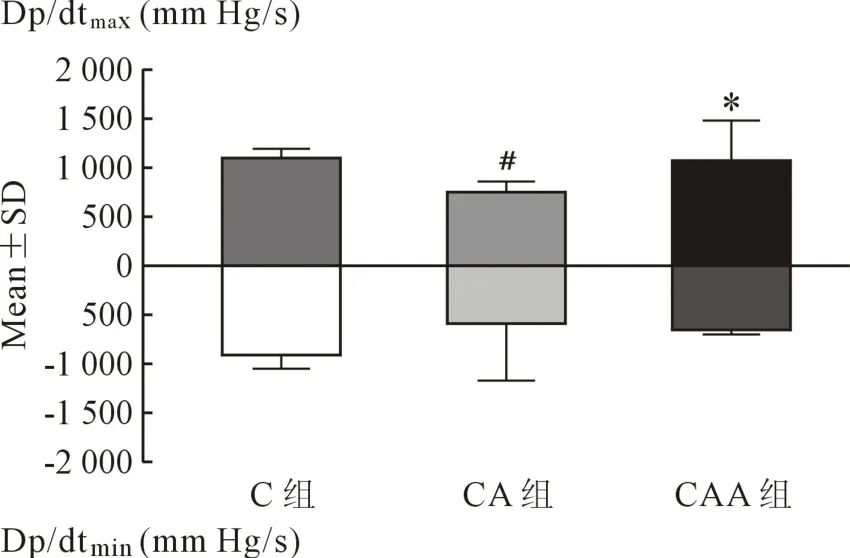
图7 三组心功能变化比较
表2 血流动力学及心功能指标(n=7,±s)
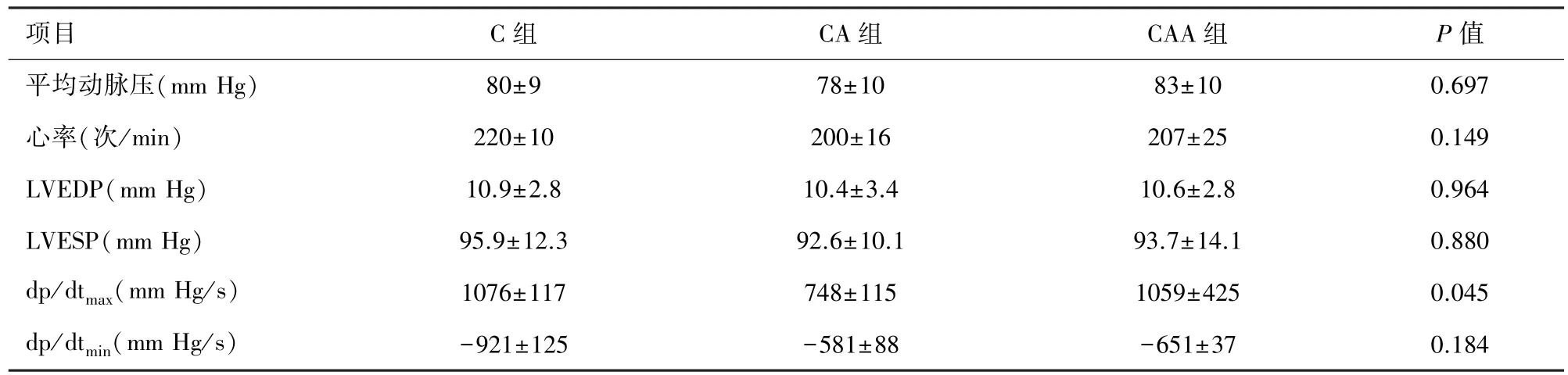
表2 血流动力学及心功能指标(n=7,±s)
项目 C组 CA组 CAA组 P值平均动脉压(mm Hg) 80±9 78±10 83±10 0.697心率(次/min) 220±10 200±16 207±25 0.149 LVEDP(mm Hg) 10.9±2.8 10.4±3.4 10.6±2.8 0.964 LVESP(mm Hg) 95.9±12.3 92.6±10.1 93.7±14.1 0.880 dp/dtmax(mm Hg/s) 1076±117 748±115 1059±425 0.045 dp/dtmin(mm Hg/s) -921±125 -581±88 -651±37 0.184
3 讨 论
CPB心脏手术期间主动脉的阻断与开放使得心肌难以避免缺血再灌注损伤,目前多种心肌保护液应用于临床,但世界各地心肌保护策略迥异,如何优化CPB心肌保护策略仍是临床关注的重要问题[6]。陈燕等在HTK液中添加依布硒啉,发现依布硒啉可明显减轻心肌的氧化应激,保护心肌线粒体结构,防止早期凋亡事件发生[7]。氧化应激过程中产生的ROS可直接或间接损伤脂质、蛋白质、DNA等[8-9],不饱和脂肪酸在ROS作用下发生过氧化反应生成有毒醛类,4-HNE占脂质过氧化产物的95%。醛类物质可加合到蛋白质、DNA等大分子物质,进而引起后者结构、功能变化,此外醛类物质还可作为自由基的第二信使发挥毒性作用[1]。研究表明,有毒醛类与心肌抗氧化能力减弱、心功能损伤显著相关[10-11]。
ALDH2为醛类氧化的关键酶,可将醛类氧化生成无活性乙酸排出体外,进而起到解毒作用。心肌ALDH2活性与低温、毒性醛类以及个体差异有关。大鼠Langendorff离体心脏灌流模型中观察到,缺血心肌的ALDH2活性在4℃低温下持续下降,1 h后为缺血前60%~70%,2 h后下降至缺血前的20%~30%,心脏恢复常温且血供恢复1 h后ALDH2活性才上升至缺血前水平[2]。其次,有毒醛类既作为ALDH2底物,又是ALDH2强有效的抑制剂,可使ALDH2活性完全缺失。此外,ALDH2具有基因多态性,全世界ALDH2突变基因携带率约8%,而亚洲人则高达40%,表现为ALDH2活性缺失或下降,饮酒后出现红脸效应[12]。研究发现携带ALDH2突变基因的紫绀型先天性心脏病患儿,心肌GSH含量代偿性增加[13]。
Alda-1为ALDH2特异性激活剂,它暴露ALDH2酶解作用的关键部位,同时部分封堵ALDH2底物结合的通道,使其免受醛类对其活性的反向抑制而始终保持活性。Alda-1还可纠正突变型酶结合位点的结构异常,恢复突变型ALDH2的活性。研究证实其可通过提高ALDH2活性减轻心肌缺血损伤[4]。
本研究发现心肌缺血再灌注后GSH/GSSG下降,可能与缺血再灌注期间氧化应激水平增强,抗氧化物质GSH耗竭有关。Alda-1通过激活ALDH2,加强醛类的清除,减轻心肌氧化应激,改善抗氧化能力,GSH/GSSG明显升高。氧化应激过程中,ROS通过氧化修饰氨基酸残基形成PC,从而损伤蛋白功能,这些氨基酸包括苏氨酸、脯氨酸、赖氨酸和精氨酸,因而蛋白PC可作为氧化应激损伤指标[12]。既往研究发现,4-HNE加合产物的形成伴随蛋白PC化水平的增加,离体研究亦证实缺血期间心肌蛋白PC 水平迅速增加[2,14]。 本研究发现,ALDH2 活化后PC化水平明显下降。
综上所述,CPB期间心肌ALDH2活化可加强毒性醛类清除,增强心肌的抗氧化损伤能力,减轻心肌的氧化应激水平,改善心肌收缩功能。

