肺移植前应用体外生命支持技术桥接治疗的研究进展
罗 渊(综述),魏 琳(审校)
作者单位:400014重庆,重庆市急救医疗中心 重庆市第四人民医院重庆大学附属中心医院心胸外科
肺移植是治疗终末期肺疾病的有效外科治疗手段。根据国际心肺移植协会(International Society of Heart& Lung Transplantation,ISHLT)的注册登记数据显示,全球开展肺移植的临床中心与手术数量稳步提升[1]。随着肺移植的数量增加,移植前需要有创机械通气(invasive mechanical ventilation,IMV)的患者数量也在极具增加[2]。虽然,IMV是等待肺移植患者的有效辅助手段之一,但其会影响患者移植后的远期预后,特别是出现机械辅助通气相关的并发症,并且在镇静状态下无法判断患者的神经功能状态,这些都会影响患者是否具备肺移植资格[3]。
近年来,体外生命支持(extracorporeal life support,ECLS)技术的飞速发展,特别是在急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)患者救治过程中,体外膜氧合(extracorporeal membrane oxygenation,ECMO)技术显示出令人满意的临床效果[4]。ECMO不仅可以辅助呼吸衰竭患者肺功能恢复,或辅助患者过渡至肺移植,其还可以有效地降低机械辅助通气并发症,降低患者镇静程度与帮助其可以进行早期功能训练[5],但ECMO相关的并发症同样也会影响临床预后。本文就ECLS在肺移植桥接治疗的临床应用进展作一综述。
1 肺移植中应用ECLS桥接治疗的临床现状
早在1992年,有研究开始报道,ARDS患者在ECMO的辅助下过渡至肺移植[6]。随后,在CESAR临床试验中,报道4例患者的应用ECMO进行桥接治疗[4]。在美国,2002年至 2015年,肺移植应用ECMO进行桥接治疗的数量由0.3%增长至4.7%,逐步超过单独应用IMV的数量[2]。在德国,ECMO桥接治疗的应用率从2011年的6.0%上升至2014年的10.7%[7]。由于肺移植人数增加与供体稀有且数量有限,患者等待移植期间的死亡率也进一步升高,越来越多临床中心考虑应用ECMO技术进行桥接治疗。
2 肺移植中应用ECLS桥接治疗的适应证与禁忌证
根据国际心肺移植协会ISHLT制定的应用ECLS的适应证[8]包括:①等待移植患者年龄小于45岁;②单一原因呼吸衰竭;③可逆性损伤;④机械辅助支持前已完成移植情况评估;⑤无ECLS相关禁忌证。禁忌证[8]包括:①不可逆性肺外疾病;②脓毒症休克;③长时间机械辅助通气;④动脉硬化严重;⑤年龄大于60岁;⑥开展肺移植数量较少的临床中心;⑦神经系统功能异常;⑧肥胖(体质量指数大于30);⑨合并肝素诱导血小板减少症。建立ECLS进行肺移植桥接治疗时,应当经多学科移植团队综合评估患者状态与预估潜在风险因素。由于缺乏ECLS期间移植患者状态评估经验,在ECLS建立前应当完成对患者的移植评估,或已被列入移植候选人,否则,即使ECLS辅助患者状态好转时,临床中心也不接受此类患者进行肺移植[9]。
目前,肺移植中应用ECLS对哪一类终末期肺疾病进行桥接治疗效果最佳尚无定论。ARDS患者应用ECLS进行桥接治疗过渡到肺移植的临床报道较少,并且临床预后效果不佳[7]。在临床实践中,缺乏评价ARDS患者是否合适作为移植候选人的方法,并且ARDS时发生的其他脏器损伤也影响着患者预后。对于慢性阻塞性肺病患者来说,应用ECLS进行桥接治疗的数量较少,但是研究显示,利用二氧化碳排除(CO2-removal)技术可以帮助60%的患者脱机,实现桥接治疗到恢复的过程[10]。因此,当患者已经完成移植资格评估进入肺移植等候名单,在等待期间患者出现基础疾病恶化时,可以积极考虑应用ECLS进行桥接治疗安全过渡至肺移植。
3 肺移植中应用ECLS桥接治疗的辅助模式
根据不同的管路形式,ECLS可以提供不同程度的心肺功能支持,如,氧供支持、CO2-removal及血流动力学支持等等(表1)。根据Eurotransplant与UNOS(United Network of Organ Sharing)规则分类,将ECLS技术分为CO2-removal、静脉-静脉(Venovenous,V-V)ECMO、静脉-动脉(Veno-arterial,VA)ECMO及肺动脉与左心房转流(Pulmonary artery-left atrial bypass,PA-LA)技术。目前,在肺移植ECLS桥接治疗中常见的三种模式是:V-V ECMO、V-A ECMO及CO2-removal。V-V ECMO多应用于伴有或不伴有高碳酸酸血症的呼吸衰竭患者,并且循环稳定不伴有肺动脉高压。V-V ECMO插管通常建立于下腔静脉与颈内静脉,操作方便快捷,但是容易发生形成ECMO管路内再循环[11],但通过建立双腔插管可以有效避免[12]。V-A ECMO多应用于患者等待肺移植期间出现循环不稳定[13],并且还适用于合并有肺动脉高压及右心衰的患者[14]。CO2-removal通过连接动静脉通路,形成低流量排除CO2缓解高碳酸血症,但相较于前两种应用数量有限[15]。 V-A ECMO 期间,泵流量达到 2.0 L/min 以上既可排除二氧化碳又可稳定患者循环,但对于VV ECMO来说,为了纠正低氧血症,泵流量需要达到5 L/min 以上[16]。 一般情况下,ECLS 建立时,外周血管均可用于建立动静脉通路,在V-A ECMO辅助模式时,可以选择中心型插管方式,在开胸手术等特殊情况下,还可以选择肺动脉与左心房插管方式[17]。有研究发现,相比于股动脉插管,V-A ECMO时进行锁骨下动脉插管可以更好为心脏与神经系统提供氧供[18]。当肺动脉高压较重,可以利用无泵低阻力膜肺经肺动脉与左心房建立转流[19]。
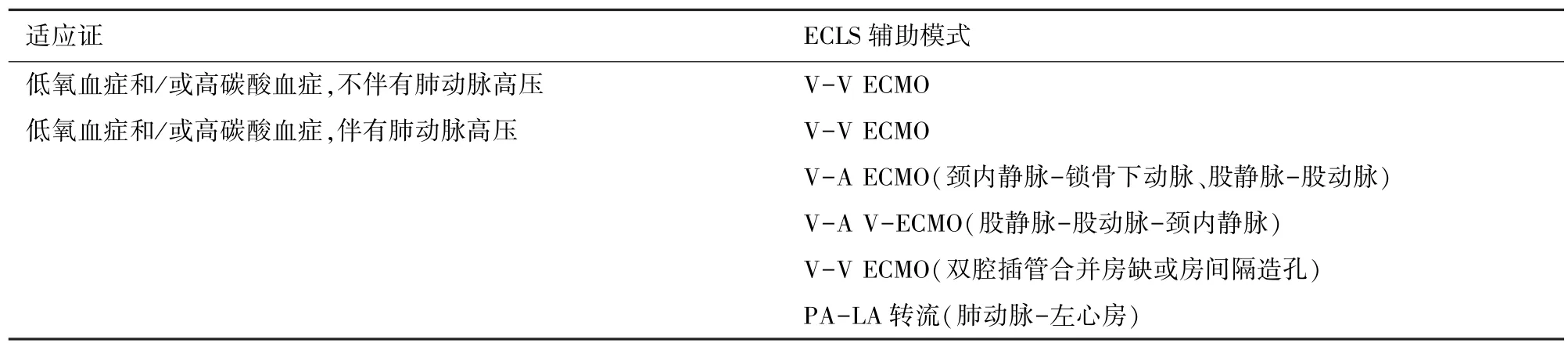
表1 肺移植中ECLS桥接治疗的辅助模式
4 肺移植中应用ECLS桥接治疗的患者管理
4.1 ECLS患者的器官分配 在有限的供体器官数量下,如何有效地进行供体器官分配是一个极为重要的事情。优化的供体器官分配策略可以降低患者移植等待期内死亡率与提高移植后远期存活率[20]。2005年5月,美国发布肺移植器官分配评分(lung allocation score,LAS)系统,德国与荷兰相继在2011年与2014年采用此评分系统[21]。在LAS评分系统中,等待移植患者应用IMV是一个重要参考因素,可以优先获得器官分配[20]。虽然,ECLS期间可以改善患者相关的LAS评分参数,降低应用IMV,但遗憾的是,美国在2015年更新LAS评分系统时,并未将ECLS纳入评分项目[22]。 目前,Eurotransplant与UNOS正在研究制定等待移植患者应用ECLS时的相关参数指标,以更好的判断患者情况,保证ECLS患者可以及时地获得器官分配。
4.2 ECLS患者的肺移植术前管理 ECLS可以有效地避免患者气管插管,避免患者处于深度镇静状态,避免发生呼吸机相关性肺炎及促进患者尽快进行功能锻炼[23-24]。等待移植患者在ECLS期间,避免气管插管与深度镇静,可以保证患者处于清醒状态,可称其为“清醒”ECMO[25]。 研究证明,患者在移植等待期间尽早的进行功能锻炼,可以提高远期生存率[26-27]。 Abrams等人报道,100例患者应用ECMO进行桥接治疗,其中35例患者进行早期功能锻炼,特别是有18例患者平均每日行走850米(2800 步/日)[24]。 因此,ECLS 患者在等待移植期间进行功能锻炼是安全可行的。
4.3 ECLS患者的肺移植术中管理 ECLS不仅可以在肺移植术前进行辅助支持,还可以在手术过程中发挥着重要作用。研究报道,相比于传统体外循环,ECMO可以显著降低炎性反应、出血风险及原发性移植物功能障碍[28],并且还可以显著降低肾功能衰竭、监护室停留时间及住院时间[29-30]。在手术过程当中,患者出现循环不稳定时,V-V ECMO可以额外增加股动脉插管来维持血流动力稳定[31]。同理,除维持氧供外,V-A ECMO也可以直接提供循环辅助支持。所以,在术前应用ECLS过度肺移植时,需提前计划安排插管方式与管理模式。
4.4 术后结局 在肺移植围术期,ECLS辅助患者需要特别注意预防出血。及时监测与补充凝血因子,术中仔细操作止血[32]。肝素可在术后48 h后开始应用,并维持活化凝血时间保持在160 s到180 s。有研究发现,ECLS辅助患者在肺移植后易发生抗人白细胞抗原(human leukocyte antigen,HLA)抗体[33]。Shumaster等发现,肺移植患者应用ECLS进行桥接治疗,术后易发生气道裂开、脑卒中、感染及肺栓塞[34]。一项美国注册登记研究显示,2000年至2011年期间,共有143名患者应用ECLS过渡至肺移植,其平均住院时间较长与易发生急性排斥反应[8]。另一项注册登记研究显示,相比于未经ECLS桥接治疗的肺移植患者,经ECLS辅助的肺移植患者预后不佳[35]。一项单中心临床研究报道,2004年至2009年期间,仅有57%的ECLS辅助患者过渡至肺移植[36]。类似的研究显示,57%~74%的患者应用ECLS过渡至肺移植。相比于单独应用机械辅助通气,ECLS联合机械通气的肺移植患者一年生存率约为61%[37]。相比于美国,德国国家移植数据库研究显示,ECLS联合机械通气的肺移植患者一年生存率约为 86%[23]。随着临床经验的增加,单独应用ECLS的概念被不断提出。一方面,其可以充分满足患者氧供需求,并且还可以为右心衰竭患者提供循环辅助支持,另一方面,单独应用可以避免联合应用时机械通气带来的不利影响[38]。除桥接治疗方式不同,开展肺移植数量较多的临床中心相比数量较低的中心,肺移植患者生存率可提高20%[34]。一项研究报道,单独应用ECLS辅助肺移植患者1年生存率达到70%[35]。另一项临床研究报道,在2007年至2016年,72名单独应用ECLS进行桥接治疗的患者,55%患者安全过渡至肺移植,并且移植后1年生存率高达90%[39]。随着肺移植ECLS桥接治疗的不断应用,患者的适应证逐步明确及ECLS设备与临床技术的进一步提高,ECLS桥接治疗的临床效果显著。
5 展 望
近些年,ECLS技术得以飞速发展,其在肺移植过程中的地位日益凸显,应用ECLS进行桥接治疗的数量急剧增加,并且1年生存率不断提高。不同的ECLS辅助模式,不仅可以充足满足患者氧供与二氧化碳排除,还可以提供循环辅助支持。单独应用ECLS可以有效地减低间歇指令通气的并发症,但需要注意的是,避免ECLS相关的并发症,提高患者生存质量。目前,临床研究多局限于短期临床结局与近期生存率,为其临床应用提供宝贵的经验教训。首先,随着临床应用技术水平的不断提高,肺移植患者的远期生存率与生活质量是评价不同策略优劣的重要考虑。其次,对于供体器官分配时,需要进一步明确ECLS桥接治疗患者的生理指标,以更好地评估患者状态,保证及时获取器官完成肺移植提高生存率。最后,ECLS现多作为过渡期辅助支持,如何进一步转型为院外可穿戴式呼吸辅助手段是未来研究的重点。

