PD-L1在乳腺癌及腋窝淋巴结中的表达及意义
王战伟 徐炜 邵霞 张明 王晓红 丁耘峰
湖州市中心医院(浙江湖州313000)
目前全球范围内在女性恶性肿瘤中乳腺癌的发病率及病死率均排在第1 位[1]。乳腺癌具有较强的侵袭、转移能力,特别易发生淋巴结转移,尽管经过规范的综合治疗,但仍然有相当部分乳腺癌患者出现复发转移。而PD-L1(programmed cell death ligation 1)在介导肿瘤免疫逃避中有重要作用[2],且PD-L1/PD-1 信号通路作为免疫治疗的靶点在非小细胞肺癌、黑色素瘤等恶性肿瘤治疗中取得了不错的效果[3]。因此研究乳腺癌中PD-L1 蛋白的表达情况可以为乳腺癌患者是否可采取免疫治疗提供理论依据。本研究采用免疫组织化学法研究PD-L1 蛋白在乳腺癌及其转移淋巴结组织中的表达情况,探讨PD-L1 蛋白的表达与乳腺癌患者临床病理参数的相关关系,并分析PD-L1 蛋白表达水平与乳腺癌患者细胞免疫的相关性,旨在为乳腺癌的免疫治疗提供新思路。
1 资料与方法
1.1 一般资料本研究所用标本均来自湖州市中心医院乳腺外科2017年10月至2018年5月因乳癌行改良根治术的76 例患者。所有患者术前未行新辅助治疗,年龄29 ~84(53.1 ± 8.9)岁;有淋巴结转移者28 例。所有病例临床病理分期根据AJCC(第八版)乳腺癌TNM 分期:Ⅰ期31 例,Ⅱ期33 例,Ⅲ期12 例。
1.2 检测方法采用SP 三步法免疫组化染色。主要试剂:小鼠抗人PD-L1(Proteintech 公司,美国,克隆号:2B11D11)、羊抗小鼠二抗、山羊血清、DAB 显色剂、过氧化氢封闭液等购自(北京中杉金桥生物技术有限公司)。石蜡标本行3 μm 厚连续切片,先后予二甲苯脱蜡,梯度酒精水化,PBS 缓冲液洗3 次(每次5 min 下同),抗原修复液及微波热抗原修复(中低火力15 min),PBS 缓冲液洗3次,3%过氧化氢封闭液室温孵育10 min 抑制内源性过氧化物酶的活性,PBS 缓冲液洗3 次,去除PBS 液后,滴加50 μL 的山羊血清,37 ℃恒温箱孵育20 min 或者室温孵育0.5 h,去除血清后加小鼠抗人PD-L1(稀释浓度为1∶40,阴性对照用抗体稀释液代替一抗),4 ℃冰箱冷藏过夜,PBS 缓冲液洗3 次,加羊抗小鼠二抗37 ℃恒温箱孵育30 min 后PBS 缓冲液洗3 次,DAB 着色,苏木素核染,脱水、干燥,封片。
1.3 镜下检查免疫组化结果判读由2 位病理科医师完成。细胞核被染成蓝色或淡蓝色,细胞质或细胞膜有淡黄色、棕黄色或者褐色颗粒的细胞为阳性表达,相反细胞膜及细胞质无着色为阴性表达。每张切片在×200 倍镜下随机选择5 个肿瘤区域进行细胞计数。参照Fromowitz 等标准按半定量分级法判定免疫组化染色结果,具体评分细则如下:(1)未着色0 分,淡黄色1 分,棕黄色2 分,棕褐色3 分;(2)阳性范围:<5%为0 分,5% ~25%为1 分,26% ~50%为2 分,51% ~75%为3 分,>75%为4 分。上述两项结果相加分值若<2 分判为阴性(-),2 ~3 分为弱阳性(+),4 ~5 分为中度阳性(++),6 ~7 分为强阳性(+++);结果≥2 分为阳性组,<2 分为阴性组。
1.4 统计学方法采用SPSS 15.0 行统计分析,PD-L1 蛋白在乳腺癌组织中的表达率与乳腺癌患者临床病理参数之间的相关性分析采用χ2或Fisher 确切概率法来检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 PD-L1 在乳腺癌原发灶及淋巴结转移组织中的表达情况PD-L1 蛋白主要表达于细胞质和细胞膜,呈棕黄色颗粒或褐黄色粗颗粒(图1);76 例乳癌原发灶标本中有阳性表达19 例(阳性率25.0%);PD-L1 在转移的淋巴结组织中阳性表达(图2),28 例淋巴结转移组织中PD-L1 呈阳性表达的有6 例(阳性率21.4%),其中57 例原发灶阴性的样本中有1 例转移灶阳性表达,19 例原发灶阳性表达的样本中5 例转移灶呈阳性表达。
2.2 PD-L1 对的表达与患者临床病理资料之间的关系经χ2检验得出:乳癌原发灶PD-L1 蛋白表达阳性率仅与患者淋巴结转移、TNM 分期、ER 及Her2 的表达有关,P值分别为0.006、0.040 、0.041、0.014,均P<0.05(表1)。
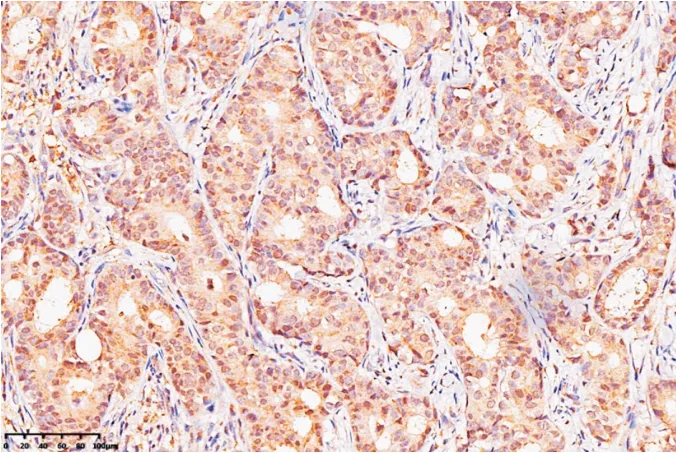
图1 乳腺癌原发灶细胞膜和细胞质PD-L1 染色阳性Fig.1 The positive expression of PD-L1 in primary breast cancer cell membrane
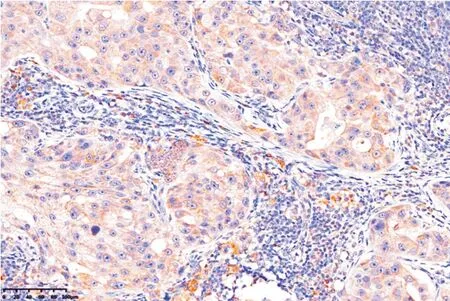
图2 乳腺癌转移淋巴结中PD-L1 的阳性表达Fig.2 The positive expression of PD-L1 in metastatic lymph nodes of breast cancer
3 讨论
PD-L1 是第3 个被发现的B7 家族成员,也被称为B7-H1(B7 homolog 1),或者CD274,属于共抑制分子,主要表达在细胞质及细胞膜上,且受到多种细胞因子及肿瘤抗原的调节。目前肿瘤细胞免疫逃逸被认为是癌症形成的机理之一,而PD-L1/PD-1 信号通路在该过程中起到重要的作用,其参与调节人体细胞及体液免疫,尤其是细胞免疫[4]。PD-L1 能与位于T 细胞表面的受体PD-1 结合传递抑制信号,导致T 细胞发生凋亡、失活,从而介导肿瘤免疫逃逸[2]。研究[5-7]报道PD-L1 蛋白在肺癌、黑色素瘤、胃癌、肠癌等多种实体肿瘤中呈高表达,且其表达水平与患者的临床病理参数及预后密切相关。
本研究结果显示PD-L1 表达于乳腺癌组织的细胞膜和细胞质中,19 例PD-L1 阳性表达,阳性率25.0%。目前因PD-L1 抗体型号及判读标准不同,各研究报道的阳性率差异较大,且如何定义PD-L1在细胞表达的阳性部位也有待进一步的研究[8]。本研究发现PD-L1 的表达与淋巴结转移及TNM 分期有关,PD-L1 阳性乳腺癌患者的淋巴结转移率高,TNM 分期高。这可能与肿瘤细胞上高表达的PD-L1,通过与PD-1 受体结合,传递抑制信通过多种机制包括激活T 细胞凋亡、抑制穿孔素的产生、抑制细胞毒性T 细胞介导的细胞溶解作用等导致乳癌淋巴结转移更易发生,从而有更高的肿瘤分期与较差预后[9]。同时本研究发现PD-L1 的表达与Her2 的过表达相关,Her2 阳性乳腺癌中的PD-L1 的表达率明显高于Her2 阴性者。对乳腺癌分子亚型的生存分析发现,在Luminal B 型、Her2过表达型、基底样型等各分子亚型乳腺癌中PD-L1高表达与较短的OS 相关[10],且在Her2 阳性乳腺癌中,PD-L1 高表达是一个独立的不良预后指标[11]。这说明在乳腺癌中PD-L1 高表达可能预示不良预后。阻断PD-1/PD-L1 途径的治疗已经成为癌症免疫治疗的焦点,研究报道针对晚期肾细胞癌的临床试验中,联合免疫治疗组较单用靶向组在疗效方面表现出明显的优势[12]。因此关于乳腺癌的免疫治疗研究有广阔的前景。另外,本研究发现乳腺癌原发灶与淋巴结转移灶肿瘤细胞PD-L1 的表达存在不一致。笔者认为这种异质性表明了PD-L1 表达的动态性[13],这可能为研究转移性乳腺癌的抗PD-L1 治疗提供新的方向。
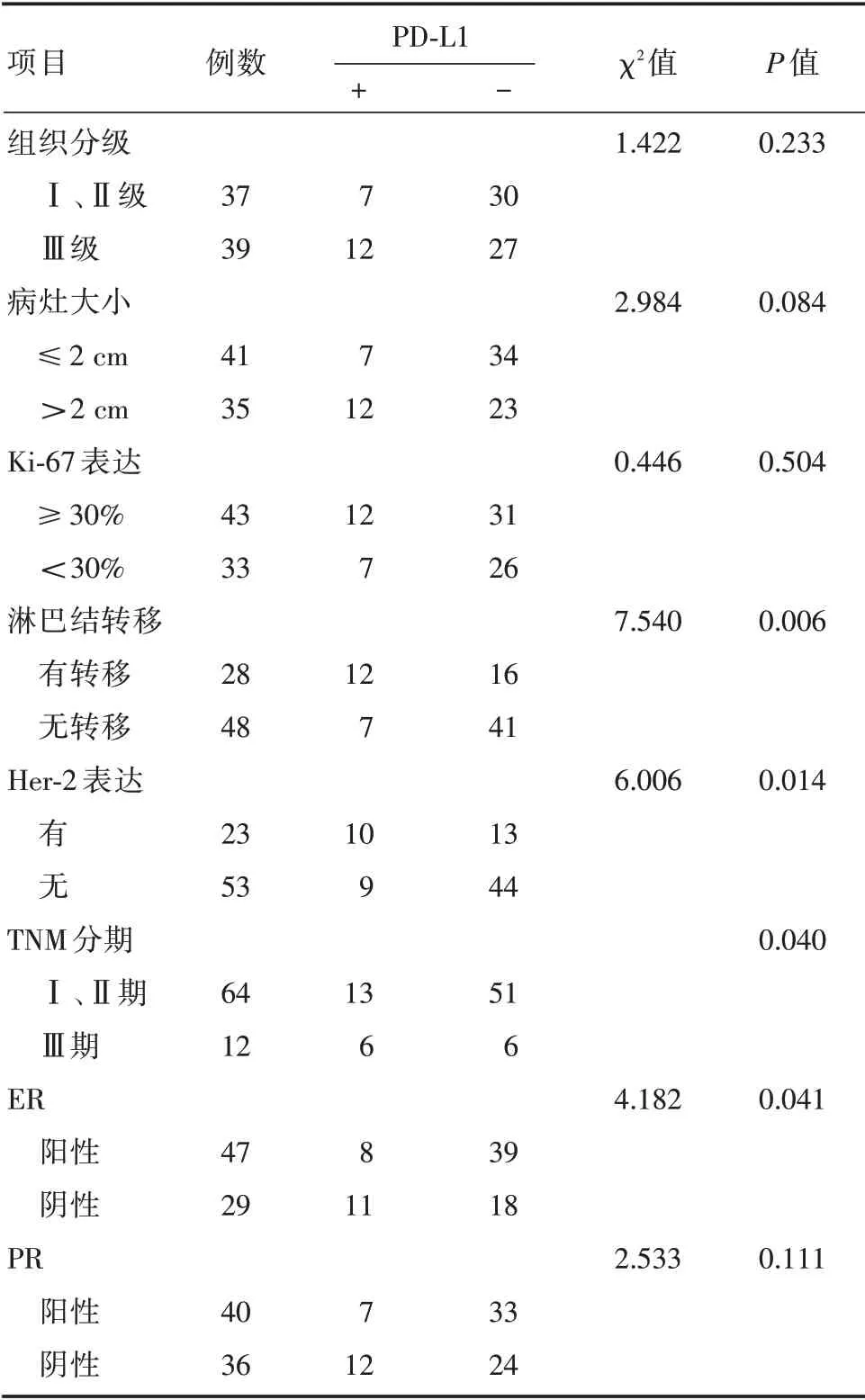
表1 乳腺癌组织中PD-L1 的表达与临床病理特征的关系Tab.1 The relationship between the PD-L1 protein expression rates and clinicopathological features in breast cancer
PD-L1 介导的肿瘤免疫逃避导致肿瘤更易发生转移且预后较差。因此可将PD-L1 做为评判乳腺癌患者预后的指标之一。同时,研究PD-L1 介导的免疫逃避机制及阻断淋巴结转移的方法将成为乳腺癌免疫治疗的新方向。

