重组人乳脂肪球表皮生长因子8蛋白对大鼠缺血性癫痫发作的影响
符传艺 赵杰 符媚媚 蔡仁端 黄良珍 陈建南 赵建农
1海南省人民医院神经外科(海口570311);2中南大学湘雅医院神经外科(长沙410008)
癫痫发作是各类脑血管疾病发生脑缺血后常 见的临床表现及严重并发症,是影响预后的重要危险因素[1-2]。随着监护手段提高,发现脑缺血后癫痫发作主要以非惊厥性癫痫为主要形式[3],多项前期研究[4-6]表明缺血后脑组织的炎性反应导致神经元凋亡是癫痫发作的重要病理机制之一,凋亡神经元分解产物进一步诱发肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)等炎症因子表达,炎症反应加重,形成恶性循环。因此,抑制炎症的发展是控制癫痫发作治疗途径之一,乳脂肪球表皮生长因子8 蛋白(milk fat globule epidermal growth factor 8,MFG-E8)作为一种抑炎因子,广泛存在于脑组织中,由小胶质细胞分泌,能够抑制TNF-α、IL-6 等炎症因子表达,介导小胶质细胞吞噬凋亡神经元[7-8]。但尚未有研究MFG-E8 与脑缺血后非惊厥性癫痫发作的关系。本研究通过建立缺血后非惊厥性癫痫发作的大鼠模型,静脉注射重组人乳脂肪球表皮生长因子8 蛋白(recombinant human milk fat globule epidermal growth factor 8,rhMFG-E8)进行治疗,探讨其在缺血后非惊厥性癫痫发作中的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物健康雄性Wistar 大鼠,体质量(180 ± 20)g,由中南大学实验动物中心提供。大鼠饲养于SPF 级清洁动物实验室,室内相对湿度40% ~60%,温度控制在22 ~25 ℃,12 h/12 h日夜光照条件下饲养。所有实验操作过程均符合《中华人民共和国实验动物管理条例》。
1.1.2 实验试剂rhMFG-E8(广州丽因生物科技有限公司);TUNEL 染色相关试剂(广州丽因生物科技有限公司),TNF-α(美国R&D 公司)和IL-6 ELISA 试剂盒(美国R&D 公司)等。
1.1.3 主要实验仪器脑电图监测仪(深圳迈瑞公司),激光多普勒流量计(Transonic,美国),分光光度计(BioTek,美国),蛋白浓度测定仪(Thermo,芬兰),酶标仪(Thermo,芬兰),蛋白转膜仪(Leica,德国),离心机(Hettich,美国),电子天平(上海天平仪厂),荧光显微镜(Olympus,日本)等。
1.2 方法
1.2.1 大鼠缺血性癫痫模型制作及动物分组将36 只Wistar 大鼠以戊巴比妥(按体质量45 mg/kg)腹腔内注射麻醉满意后,于大鼠头双侧额顶部(分别于前囟前1 mm 及后4 mm,中线旁开3.5 mm)对称性切开头皮、钻4 个孔至皮层,植入4 个不锈钢电极,在横窦与人字缝之间置一参考电极,所有电极均采用连接器固定于头部,备脑电图监测用,电极获取脑电波后即传输至多参数显示仪和数字分析系统。常规适应性饲养2 周,剔除头部切口愈合不良者并递补至36 只后随机分为3 组,假性手术组,仅做颈部皮肤切口并暴露颈部动脉后缝合;缺血性癫痫组和rhMFG-E8 组采用改良Longa 线栓法建立急性脑梗死大鼠模型,大鼠按同样的方法麻醉后仰卧固定于手术台上,采用颈部正中切口,依次暴露并分离右侧颈总动脉、颈外动脉及其分支、颈总动脉分叉处,以血管夹暂时夹闭阻断颈外动脉及其分支上颌动脉及舌动脉。于颈总动脉分叉处近心端做一切口,将前端涂有石蜡的3-0 单股尼龙缝线插入颈总动脉并顺血流方向,经颈内动脉入颅,插入深度约20 mm,至大脑前动脉近端,完全阻断大脑中动脉起始部的血供,注意需短暂夹闭翼腭动脉以防误插。手术过程采用激光多普勒流量计进行皮质脑血流量监测,皮质脑血流量下降70%以上以及术后1 h 监测到癫痫波者则定义为造模成功,缺血性癫痫组给予1 mL 生理盐水静脉注射。rhMFG-E8 组在模型建立成功后,立即按160 μg/kg 静脉注射rhMFG-E8 溶液1 mL[9]。所有大鼠均在术前1 h 开始监测癫痫波,术后24 h断头取脑组织。缺血性癫痫组和rhMFG-E8 组大鼠模型制作过程中切口愈合不良者、皮质脑血流量下降不足70%者以及术后1 h 未监测到癫痫波者等均给予剔除,并依次递补。
1.2.2 指标测定
1.2.2.1 癫痫波监测所有实验动物在缺血前1 h开始进行脑电图监测,直至缺血后24 h。脑电波由电极获取并实时传输至多参数显示仪和数字分析系统。确定脑缺血后非惊厥性癫痫波型按WILLIAMS 等[10]制定的评判标准:(1)脑电图波幅大于背景波幅;(2)持续多棘波,或频率大于1 Hz的棘波或棘慢复合波;(3)出现(1)和(2)波型持续10 s 以上。监测到癫痫波的频率即为该大鼠的实际非惊厥性癫痫发作次数。
1.2.2.2 采用TUNEL 染色法检测各组纹状体区组织中神经元凋亡TUNEL 染色检测凋亡的方法按照试剂盒说明书进行。选取各组大鼠的纹状体脑组织切片,依次用以下试剂洗涤:二甲苯4 min 2 次;无水乙醇3 min 2 次;95%乙醇3 min;75%乙醇3 min;PBS 5 min。取出组织切片,晾干,向组织上方加一滴蛋白酶K溶液,于室温条件孵育15 min,孵育完成后给予PBS 洗涤2 min,反复4 次。继而于10%中性甲醛中固定10 min,反复PBS 洗涤5 min 共3 次。然后将组织切片置于乙醇乙酸混合液中浸泡约7 min,PBS 洗涤5 min,反复3 次。于10%中性甲醛中再次固定10 min。自然晾干,向组织上方加一滴3%的过氧化氢,观察10 min 后PBS洗涤。自然晾干,在组织上方滴加一滴TdT 酶缓冲液,5 min 后PBS 反复洗涤2 次。37 ℃下预热终止液,再把组织切片放置到终止液中20 min,取出后PBS 反复洗涤2 次。轻轻擦拭组织切片,加一滴过氧化物酶标记的抗体在组织上方,20 min 后用PBS 洗涤5 min,反复4 次。轻轻擦拭组织切片,向组织上方加DAB 显色液,根据显色程度确定显色时间,一般控制在30 min 以内。完成显色后置其于无水乙醇2 min,二甲苯2 min,在通风橱中自然晾干,用荧光封片试剂封片。最后于2 h 内在荧光显微镜下观察组织切片。阳性细胞胞核呈绿色,每张切片随机选取区域拍照5 张,细胞数取平均值,以便后续对凋亡细胞进行统计,凋亡指数(apoptotic index)=阳性细胞/总细胞×100%。
1.2.2.3 ELISA 法检测各组大鼠纹状体中TNF-α、IL-6 表达提取大鼠的纹状体脑组织准确称取,加9 倍的4 ℃生理盐水,经研磨搅拌制成10%的组织匀浆,完毕后于冰上静置30 min 以便蛋白充分裂解,将匀浆液于4℃,12 000 r/min 离心15 min×2次,取上清液。按照ELISA 试剂盒说明进行后面实验操作步骤。将匀浆上清液标准品稀释液稀释5 倍备用,从密封袋中取出板条,将稀释好的样品和标准品以100 μL/孔加入,用封板胶纸封住反应孔,37 ℃孵育120 min。洗板4 次,在滤纸上印干。将生物素化抗体工作液以100 μL/孔加入,将反应孔用封板胶纸封住,37.0 ℃孵育60 min。洗板4 次,在滤纸上印干。将酶结合工作液以100 μL/孔加入,封板胶纸密封反应孔,37 ℃孵育30 min。洗板4 次,在滤纸上印干。将显色剂以100 μL/孔加入,37 ℃条件下孵育20 ~30 min。每孔加入50 μL 终止液,将溶液混匀,5 min 内测量波长在450 nm 处的吸光度OD值。
1.3 统计学方法采用SPSS 16.0 统计软件进行数据分析,计量资料采用均数±标准差()表示。多组样本均数的比较如方差不齐时采用Welch 方差分析,组间两两比较采用Games-Howell检验。如多组样本均数的比较方差齐时,则应用单因素方差分析,组间两两比较采用Tukey 检验;设P<0.05 为差异有统计学意义。
2 结果
2.1 rhMFG-E8 可明显减轻缺血性癫痫大鼠的癫痫发作频率所有入选实验的大鼠自缺血前1 h开始进行脑电图监测,直至缺血后24 h,并将脑电图结果描记。实验过程发现,3 组大鼠癫痫发作频率总体有差异(WelchF= 676.91,P<0.05)。3 组两两比较结果:缺血性癫痫组大鼠癫痫发作的频率[(15.6±3.6)次/24 h]较假性手术组[(0.4±0.5)次/24 h]明显升高(P<0.05);而rhMFG-E8 组癫痫发作的频率[(7.8 ± 1.9)次/24 h]较缺血性癫痫组[(15.6±3.6)次/24 h]明显降低(P<0.05),rhMFGE8 明显降低大鼠癫痫的发作频率,差异有统计学意义。
2.2 rhMFG-E8 有效减轻缺血性癫痫大鼠纹状体组织的细胞凋亡采用TUNEL 染色检测了各组大鼠纹状体组织中神经元凋亡水平(图中类圆形绿色小体即为凋亡神经元)。结果显示3 组神经元凋亡水平总体有显著差异(WelchF= 676.91,P<0.05)。假手术组大鼠纹状体中几乎无凋亡神经元(图1);缺血性癫痫组大鼠纹状体中神经元凋亡[(15.28±1.95)%],较假性手术组[(0.40±0.17)%]明显增加(P<0.05)。(图2);而经rhMFG-E8 处理后,大鼠纹状体中神经元凋亡[(9.65 ± 1.17)%]较缺血组降低(图3),差异有统计学意义。

图1 假手术组纹状体凋亡神经元(×200)Fig.1 Apoptotic neurons in striatum of the sham operation group(×200)
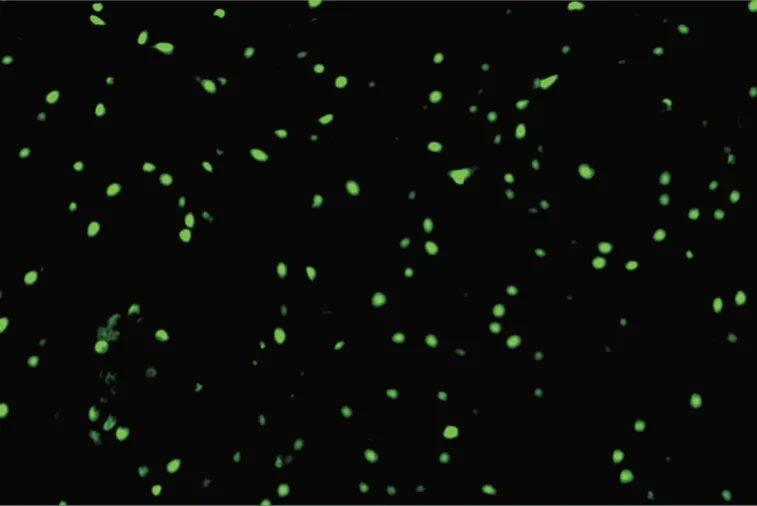
图2 缺血性癫痫组大鼠纹状体凋亡神经元(×200)Fig.2 Apoptotic neurons in striatum of postischemic seizure group(×200)
2.3 rhMFG-E8 有效抑制缺血性癫痫大鼠纹状体组织中TNF-α和IL-6 表达结果显示3 组TNF-α、IL-6 表达总体均有差异(F= 309.22,P<0.05;F=290.87,P<0.05)。与假手术组(195.0±29.5,120.3± 25.7)比较,缺血性癫痫组中纹状体中炎症因子TNF-α、IL-6 表达(590.4 ± 43.0,480.3 ± 49.8)增加(P<0.05);rhMFG-E8 可抑制TNF-α、IL-6(354.6 ±43.5,279.8 ± 29.9)表达,与缺血性癫痫组比较,差异具有统计学意义(P<0.05,图4)。

图3 rhMFG-E8 组纹状体凋亡神经元(×200)Fig.3 Apoptotic neurons in striatum of the rhMFG-E8 group(×200)

图4 各组大鼠纹状体中炎症因子TNF-α、IL-6 表达Fig.4 Expression of TNF-αand IL-6 in striatum of rats in each group
3 讨论
癫痫是脑梗死常见并发症,尤其是非惊厥性癫痫,国内外多项基础及临床研究发现其是急性脑梗死的发生率非常高的并发症,高达7% ~20%[11-13]。缺血后癫痫发作以颞叶、额顶叶皮质、纹状体及边缘系统等部位脑梗死多见,纹状体损害癫痫发作常表现为发作性肌强直伴疼痛、出汗、恐惧感,但不伴意识丧失[14-15]。本研究结果显示假手术组基本无炎症反应和癫痫发作,相对假手术组,缺血性癫痫组缺血后24 h 内非惊厥性癫痫发作频率明显上升,与之相应是纹状体脑组织炎性反应加剧,TNF-α、IL-6 表达显著上升,而rhMFGE8 组TNF-α、IL-6 表达明显下降,炎症发应减轻,随之癫痫发作频率下降,揭示癫痫与炎症呈正相关,该结论也得到相关文献[16]支持。
小胶质细胞是中枢神经系统的一道重要免疫防御系统,脑组织缺血后以小胶质细胞活化为特征的炎症是神经组织炎性损害的关键环节,小胶质细胞被激活并迅速释放炎症因子,在大脑组织和周围血液中的浓度升高,早期研究证明脑组织缺血后的炎性反应加重导致神经元损伤及死亡,大脑电生理网络完整性受破坏,诱发癫痫发作[17]。本研究结果显示在各组之间,随着炎症反应加重,大鼠纹状体急性缺血后神经元凋亡数目显著增加,提示该病理变化与非惊厥性癫痫发作相关,与文献[18-19]报告相符。所以,脑缺血早期通过抑制炎症发生以及避免其级联反应,减少神经元凋亡的途径,可以避免癫痫发作及加重。因此,研究及寻找抑炎因子及机制是防治癫痫的重要研究方向之一。
MFG-E8 是一种分泌性糖蛋白,在中枢神经系统主要由小胶质细胞分泌,在急性脑缺血梗死炎症反应过程中,其能够识别凋亡细胞表面标志物丝氨酸磷脂,介导吞噬细胞及时清除凋亡细胞,避免凋亡细胞分解产物引发炎症因子产生,激发炎症级联反应,导致脑组织继发损伤[20]。MFG-E8能够减轻急性脑梗死后炎症反应,从而减少神经元凋亡,但至今尚未有MFG-E8 与癫痫发作具体机制的研究。
本研究结果显示rhMFG-E8 具有强烈的抑炎作用,相对于缺血癫痫组,rhMFG-E8 组炎症因子TNF-α、IL-6 表达显著下降,同时发现纹状体区神经元凋亡数量明显减少,伴随之是癫痫发作频率显著下降。所以,本研究证实大鼠急性脑缺血后rhMFG-E8 抑制炎性因子TNF-α 和IL-6 分泌,减轻急性脑缺血后炎症反应,减少神经元凋亡,从而减轻或缓解癫痫发作。
通过以上实验结果,笔者证实rhMFG-E8 通过减少或拮抗炎症反应因子,从而阻止神经元凋亡,减轻脑组织损害,减少癫痫发作频率。但本研究观察时间为24 h 以内,虽然在建模成功后便立即静脉给rhMFG-E8 治疗有阳性的结果,但远期疗效尚未清楚,与转化临床运用之间尚有不少距离,且因受实验条件及经费限制,也存在缺乏rhMFG-E8拮抗剂组比较等不足之处,在后续的补充实验研究中需要解决这些问题。

