复方苦参注射液增加肺癌H1299细胞放射敏感度的研究
郑剑霄 郭伟伟 李清娟 郭娅妮 魏球娣 易梦婷 王苏美 李工
广州中医药大学第二附属医院,广东省中医院(广州510120)
肺癌是最常见的恶性肿瘤之一,也是癌症相关死亡的首要疾病[1-2]。肺癌的治疗预后欠佳,患者的5年生存率只有约15%[3-4]。肺癌中约80%为非小细胞肺癌,大部分患者确诊时已发展为中晚期[5]。目前,放疗联合化疗的综合治疗是不可手术非小细胞肺癌的标准治疗[6],尤其适合于体力状态较好,能耐受毒副反应的患者[7]。由于肿瘤细胞对放疗抵抗导致局部治疗失败[8-9],因此,提高肺癌细胞对放射线的敏感性是改善不可手术局部晚期非小细胞肺癌患者预后的重要途径。复方苦参注射液是一种具有广谱抗肿瘤作用的中药制剂[10-11],临床研究发现其具有增强肺癌放射治疗疗效的作用[12],但目前有关复方苦参注射液在肺癌放疗增敏方面的基础研究较少,为此,在细胞水平上进行这方面研究,旨在今后为其应用于临床提供理论依据。
1 材料与方法
1.1 主要试剂复方苦参注射液(国药准字Z14021231),由山西振东制药股份有限公司生产,100 mL 含生药40g ;胰酶(货号:25200-056)、DMEM 培养基(货号:C1195500BT)及胎牛血清(货号:A3160801),购自美国Gibco公司;青霉素-链霉素(货号:SV30010)及PBS缓冲液(货号:SH30256.01),购自美国HyClone 公司;Annexin V-FITC/PI apoptosis Kit-AP101 细胞凋亡检测试剂盒(货号:AP101),购自中国联科生物公司。
1.2 主要仪器5430R 低温高速离心机(德国Eppendorf 公司);FC500 流式细胞仪(美国Beckman公司);Infinite M1000 PRO 多功能酶标仪(奥地利Tecan 公司);IC1000 全自动细胞计数仪(美国Countstar 公司);MultiRad225 放射仪器(美国Faxitron 公司)。
1.3 细胞培养及分组人肺癌H1299 细胞由广东省中医药科学院提供,于饱和湿度的37 ℃、5%CO2细胞培养箱中培养,待细胞融合度达到70%~80%时传代,取对数生长期细胞进行实验。将细胞随机分为空白对照组、单纯放射组、苦参放射组。空白对照组:不给药,不照射;单纯放射组:只照射,不给药;苦参放射组:予一定浓度的复方苦参注射液处理细胞24 h 后照射。
1.4 四甲基偶氮唑盐(MTT)法检测H1299 细胞增殖抑制率取指数生长期细胞接种于96 孔板,每孔200 μL,培养24 h,按2 倍梯度稀释法加入复方苦参注射液,使其终浓度分别为1、2、4、8、16 mg/mL,每个剂量设5 孔,培养细胞24、48、72 h 后,弃上清,PBS 清洗,加MTT 溶液20 μL/孔,继续培养4 h 后,弃上清,加入150 μL DMSO,震荡10 min,测定450 nm 时的吸光度(OD)值,实验重复3 次。按以下公式计算抑制率,拟合后求IC50值和IC20值。细胞增殖抑制率(%)=[对照组OD值-实验组OD值/对照组OD值]×100%。药物作用后,细胞增殖抑制率<20%时,药物对细胞的毒性作用可相对忽略,因此选择复方苦参注射液作用24 h 时的IC20进行试验。取指数生长期细胞随机分为空白对照组、单纯放射组、苦参放射组,X 射线照射剂量分别为2、4 Gy,计算各组的细胞增殖抑制率。实验重复3 次后取均值。
1.5 流式细胞术检测细胞凋亡接种1×105个细胞于60 mm 培养皿中,细胞分组同1.4,X 射线照射剂量为2 Gy,处理后PBS 冲洗待检测细胞,离心后弃上清液,加500 μL Binding Buffer 重悬细胞,并加入5 μL Anneexin V-FITC 和10 μL PI 染色液,混匀后置于室温避光反应5 min,使用流式细胞仪检测。实验重复3 次后取均值。
1.6 细胞克隆形成试验检测细胞存活率取指数生长期细胞接种于培养皿中,细胞分组同1.4,X 射线照射剂量为2 Gy,细胞照射后继续培养10~14 d,倒掉培养基,PBS 冲洗,4%多聚甲醇固定,0.1%结晶紫染色10 min,于荧光显微镜下计数克隆数。克隆形成率=克隆数/细胞接种数×100%,细胞存活率=处理组克隆形成率/对照组克隆形成率。
1.7 统计学方法使用SPSS 21.0 统计软件对数据进行统计学分析,计量资料结果以表示,多组间样本均数比较采用单因素方差分析,组间比较采用t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 复方苦参注射液对H1299 细胞的药物毒性不同浓度复方苦参注射液处理H1299 细胞24、48、72 h 后,各处理组细胞抑制率较对照组增加,差异具有统计学意义(P<0.05)。且随着时间的延长,各处理组的细胞抑制率也逐渐升高,提示复方苦参注射液对H1299 细胞增殖的抑制作用呈现一定的剂量和时间依赖关系。复方苦参注射液处理H1299 细胞24、48、72 h 的IC50分别为14.46、8.51、3.52 mg/mL。复方苦参注射液处理H1299 细胞24、48、72 h 的IC20分别为2.97、0.94、0.42 mg/mL。见表1、图1。
表1 复方苦参注射液对H1299 细胞的抑制作用Tab.1 Inhibition of compound kushen injection on H1299 cells±s
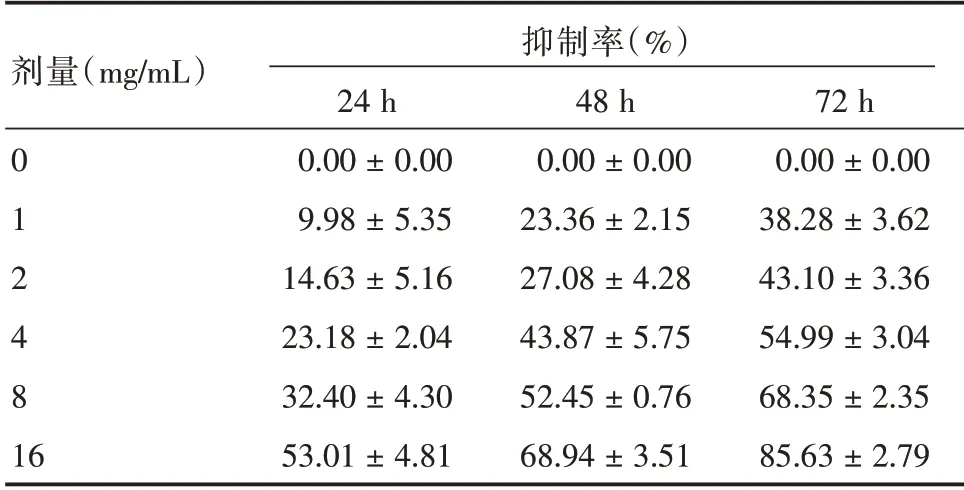
表1 复方苦参注射液对H1299 细胞的抑制作用Tab.1 Inhibition of compound kushen injection on H1299 cells±s
剂量(mg/mL)抑制率(%)0 1 2 481 6 24 h 0.00±0.00 9.98±5.35 14.63±5.16 23.18±2.04 32.40±4.30 53.01±4.81 48 h 0.00±0.00 23.36±2.15 27.08±4.28 43.87±5.75 52.45±0.76 68.94±3.51 72 h 0.00±0.00 38.28±3.62 43.10±3.36 54.99±3.04 68.35±2.35 85.63±2.79
2.2 复方苦参注射液联合放射对H1299细胞增殖水平的影响当增加复方苦参注射液干预后,可明显增强放射线对H1299 细胞增殖的抑制作用,放射剂量2、4 Gy 时的抑制率分别为(33.03±2.49)%、(34.00±1.67)%,高于单纯放射组的(12.73±10.06)%、(15.44±5.34)%,差异具有统计学意义(P<0.05),提示复方苦参注射液联合放射抑制H1299 细胞显示出协同作用。见表2。
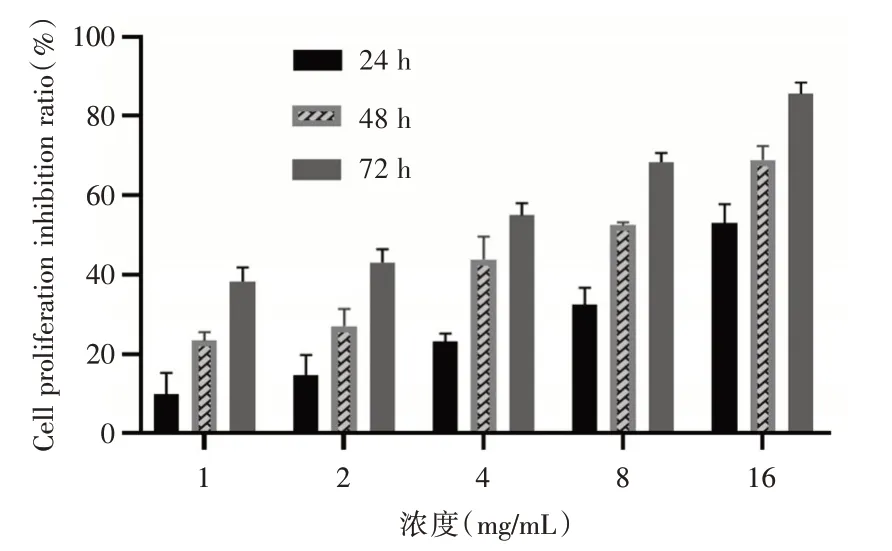
图1 不同浓度复方苦参注射液对H1299 细胞生长的抑制作用Fig.1 Inhibition of compound kushen injection at different concentrations on H1299 cells

表2 复方苦参注射液联合放射对H1299 细胞的抑制作用Tab.2 Inhibition of radiation combined with compound kushen injection on H1299 cells
2.3 复方苦参注射液对H1299 细胞凋亡的影响单纯放射组H1299 细胞的凋亡率(6.4 ± 0.4)%,高于空白对照组的(2.4 ± 0.3)%,差异具有统计学意义(P<0.05),提示放射线诱导H1299 细胞凋亡。苦参放射组H1299 细胞的凋亡率(11.0 ± 0.3)%,较单纯放射组增加,差异具有统计学意义(P<0.05),提示复方苦参注射液能促进放射线诱导H1299 细胞凋亡。见图2。
2.4 复方苦参注射液对放射后H1299 细胞存活率的影响单纯放射组H1299 细胞存活率为(16.3 ±1.5)%,经复方苦参注射液处理后,H1299 细胞存活率减少至(12.0 ± 1.0)%,差异具有统计学意义(P<0.05)。见图3。
3 讨论

图2 各组H1299 细胞凋亡情况比较Fig.2 Comparison of apoptosis of H1299 cells in various groups

图3 各组细胞克隆形成情况Fig.3 Clone formation of cells in various groups
复方苦参注射液是以苦参、白土苓两味中药经现代技术加工制成,氧化生物碱是其主要活性成分。氧化苦参碱通过抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡、抑制端粒酶的活性、抑制肿瘤新生血管的形成等多种途径发挥其抗肿瘤活性[13-14]。本研究采用体外细胞实验检测药物的放射增敏作用具有方便快捷的优势,MTT 法显示当增加复方苦参注射液干预后,可明显增强放射线对H1299细胞增殖的抑制作用,进一步采用经典的克隆形成法也证实了复方苦参注射液对H1299 细胞具有放射增敏作用。
细胞凋亡在放射反应机制中占有重要地位,放射敏感性与肿瘤细胞自发性凋亡水平呈正相关趋势[15-16],肿瘤细胞凋亡率越高,放射敏感性越强[17-19]。对肺癌细胞株的研究也证实肺癌细胞放射敏感性与凋亡率呈正相关[20]。本研究通过流式细胞仪检测,发现苦参放射组肺癌细胞的凋亡率较单纯放射组增加,克隆形成实验结果表明苦参放射组肺癌细胞存活率降低即放射敏感度增高,提示复方苦参注射液通过促进放射线诱导的肺癌细胞凋亡,从而增加肺癌细胞的放射敏感度。
笔者推测复方苦参注射液可通过抑制H1299肺癌细胞增殖,促进肺癌细胞凋亡,从而提高肺癌细胞的放射敏感度。但本研究尚停留在体外细胞实验阶段,且未对复方苦参注射液放射增敏作用的分子机制进行深入分析,未来应该通过动物实验和临床研究进一步探讨复方苦参注射液对肺癌细胞的放射增敏作用。

