NUAK1在鼻咽癌组织中的表达及其对鼻咽癌CNE2、HK1细胞迁移和侵袭能力的影响
苏琪盛 张里谦 黎小红 罗玉珍 覃柳群 丘玉铃 杨峥 莫武宁
广西医科大学第一附属医院检验科(南宁530021)
鼻咽癌(nasopharyngeal carcinoma,NPC)起源 于鼻咽部上皮细胞,是我国最常见的头颈部恶性肿瘤之一,其发病率和病死率在我国南方地区居世界首位[1-2]。鼻咽癌起病隐匿,病情进展迅速,容易发生颈部淋巴结转移和远处转移。目前,放射治疗是鼻咽癌的主要治疗方法,然而晚期患者治疗效果不佳,许多患者治疗后易出现放疗抵抗和发生局部复发,因此鼻咽癌的治疗仍具有挑战性[3-5]。早期诊断可使患者得到更及时和更高效的治疗。为此,筛选鼻咽癌早期诊断的生物标志物,寻找新的药物治疗靶点是当前研究的热点。
NUAK1(NUAK family kinase 1),又名ARK5,作为人腺苷单磷酸(AMP)激活蛋白激酶(AMPK)家族成员之一,是AKT 的下游信号分子[6]。AKT在调节肿瘤细胞生长、增殖,促进细胞转移和侵袭等多种影响到肿瘤发生发展的过程中起着重要作用[7]。据报道,NUAK1 在体内参与多种生理病理过程,如促进细胞增殖,抑制凋亡,调控血管生成等,并与肿瘤的发生发展密切相关[8]。NUAK1 在部分肿瘤如乳腺癌[9]、肝癌[10]、胰腺癌[11]等组织中高表达,并且在肿瘤的转移和侵袭中发挥重要作用。但是,NUAK1 在鼻咽癌组织中的表达情况以及NUAK1 对鼻咽癌细胞生长的影响尚未明确。本研究拟通过实时荧光定量PCR(qRT-PCR)技术和免疫组织化学染色的方法对鼻咽癌组织和鼻咽黏膜慢性炎症组织中NUAK1 mRNA 和蛋白的表达水平进行检测,并对NUAK1 的表达与鼻咽癌临床病理特征之间进行相关性分析。进一步沉默鼻咽癌细胞株CNE2、HK1 中NUAK1 的表达,观察NUAK1 表达下调的CNE2、HK1 细胞株中迁移和侵袭能力的变化,探讨NUAK1 与鼻咽癌发生发展的关系。
1 材料与方法
1.1 材料
1.1.1 组织和细胞用于进行核酸扩增的16 例鼻咽癌和16 例鼻咽黏膜慢性炎组织标本获取自广西医科大学第一附属医院耳鼻喉科。在16 例鼻咽癌患者组织标本中男13 例,女3 例,年龄分布范围为32 ~78 岁,中位年龄51 岁。在16 例鼻咽黏膜慢性炎组织标本中,男10 例,女6 例,年龄分布范围为25 ~77 岁,中位年龄44 岁。
用于本次研究中免疫组织化学染色的组织标本石蜡切片获取自广西医科大学第一附属医院病理科。包含88 例鼻咽癌组织样本及30 例鼻咽黏膜慢性炎样本,在88 例鼻咽癌组织标本石蜡切片中男63 例,女25 例,年龄分布范围为16 ~71 岁,中位年龄47 岁;切片样本病理类型:非角化型未分化性癌77 例,非角化型分化性癌11 例;淋巴结转移:伴有淋巴结转移81 例,无淋巴结转移7 例;根据国际抗癌联盟(Union for International Cancer Control,UICC)2010年制定的鼻咽癌分期法进行分期:Ⅰ和Ⅱ期共计11 例,Ⅲ和Ⅳ期共计77 例;肿瘤病理分期:T1、T2期21 例,T3、T4期67 例。在30 例鼻咽黏膜慢性炎组织标本中男23 例,女7 例,年龄18 ~69 岁,中位年龄44 岁。以上所有患者均未经过放疗和化疗。本研究经广西医科大学第一附属医院伦理道德委员会批准,并取得受试者知情同意。
本次研究以鼻咽癌细胞株CNE2、HK1 为研究对象,这两株细胞株由广西医科大学耳鼻喉实验室赠予本课题组。将CNE2 和HK1 细胞株在含有10%胎牛血清和1%青霉素-链霉素混合溶液的RPMI 1640 培养基中培养,培养条件为37 ℃,5%CO2。
1.1.2 主要实验试剂siRNA-NUAK1(序列:AGAGAGAATCAGGTTACTA)和siRNA CON054 购自上海吉凯基因化学技术有限公司。总RNA 提取试剂RNAiso Plus reagent,反转录试剂盒Prime-ScriptTMRT reagent Kit,荧光定量PCR试剂盒SYBR®Premix Ex TaqTMⅡ均购自日本TaKaRa 公司。抗NUAK1 抗体(ab37641)购于美国abcam 公司,兔鼠通用型SP-9002 试剂盒和DAB 显色液购于北京中杉金桥公司,抗GAPDH 抗体(2118S)和荧光二抗(5151P)购于CST 公司。RPMI 1640 培养基、胰酶消化液购自Gibco 公司,胎牛血清购自LONSERA公司,青霉素-链霉素混合溶液、嘌呤霉素、RIPA蛋白裂解液等购自北京索莱宝公司。Transwell 小室和24 孔板等购自美国Corning 公司。
1.2 实验方法
1.2.1 筛选差异表达基因从oncomine 数据库(https://www.oncomine.org)中获取包含31 例鼻咽癌和10 例正常鼻咽组织的全基因组芯片数据GSE12452(GPL570[HG-U133_Plus_2]Affymetrix Human Genome U133 Plus 2.0 Array)。对全部基因进行差异表达分析,差异表达倍数(Fold Change)≥2 且P<0.05。
1.2.2 qRT-PCR 检测NUAK1 mRNA 表达按照RNAiso Plus reagent 操作说明使用Trizol 法提取组织和细胞中的总RNA,无酶水溶解沉淀。使用反转录试剂盒PrimeScriptTMRT reagent Kit 将mRNA逆转录成cDNA,并按照荧光定量PCR 试剂盒SYBR®Premix Ex TaqTMⅡ说明书进行定量PCR 反应。以GAPDH 作为内参基因,引物购自上海擎科公司,目的基因NUAK1 和内参基因GAPDH 引物序列及扩增片段大小见表1。实验重复3 次。
1.2.3 免疫组织化学方法检测NUAK1 蛋白表达采用免疫组化SP 法,将免疫组化切片常规脱蜡,梯度酒精逐级水化,随后柠檬酸盐缓冲液(pH 6.0)高温高压修复抗原。一抗NUAK1 浓度为1∶100,切片置于4 ℃过夜,按照试剂盒说明书操作。DAB显色后苏木素复染,每张切片均随机选择5 个高倍视野(400×)进行观察。每张切片经过两名研究人员进行评分。

表1 引物序列及扩增片段大小Tab.1 Primer sequence and amplified fragment size
NUAK1 阳性染色主要定位于细胞浆中,呈棕黄色颗粒。在视野下计数100 个细胞,以细胞浆中出现浅黄、棕黄或棕褐色的细小颗粒为阳性细染色为主要判定标准。阳性细胞染色强弱:0 分(无阳性着色)、1 分(浅黄色)、2 分(棕黄色)、3 分(棕褐色)。阳性细胞百分比:1 分(<10%)、2 分(10%~50%)、3 分(50%~75%),4 分(>75%)。两项乘积≥6 分为高表达,≤4 分为低表达。
1.2.4 细胞转染取对数期生长良好的CNE2、HK1 细胞,以转染siRNA-NUAK1 的细胞株为实验组,转染空载片段siRNA CON054 的细胞株为空载组,分别将含有NUAK1 基因片段和空载片段的慢病毒转染至CNE2、HK1细胞株中。转染72 h后,各转染组用含2 μg/mL 嘌呤霉素的培养基筛选稳定细胞株。提取mRNA,进行qRT-PCR 检测siRNANUAK1 干扰效果。
1.2.5 Transwell细胞迁移实验将底部膜含8 μm大小孔隙的小室置于24 孔板上,下室加入500 μL含有10%胎牛血清的RPMI1640 完全培养基。分别将含4×104个实验组和空载组细胞的无血清细胞悬液加入上室,培养24 h 后取出小室,4%多聚甲醇固定细胞30 min,1%结晶紫染液染色20 min。室温下晾干小室,显微镜下随机计数5 个视野的穿膜细胞数。
1.2.6 细胞侵袭实验在小室内加入100 μL 适当浓度的Matrigel,4 h 待稀释后的Matrigel 变成固态后,下室和上室分别加入500 μL 含有10%血清的完全培养基和4×104个实验组和空载组细胞的无血清细胞悬液,培养24 h 后取出小室,固定,结晶紫染色后,在显微镜下随机计数5 个视野穿膜细胞数。
1.3 统计学方法采用SPSS 22.0 软件进行统计分析,计量资料用均数±标准差表示。计数资料之间的比较采用χ2检验,计量资料之间的比较采用两独立样本t检验。P<0.05 为差异具有统计学意义。
2 结果
2.1 NUAK1 在鼻咽癌芯片中高表达在31 例鼻咽癌和10 例正常鼻咽组织的全基因组芯片数据中,NUAK1 在鼻咽癌组织中的表达高于正常鼻咽组织(P<0.05)。见图1。
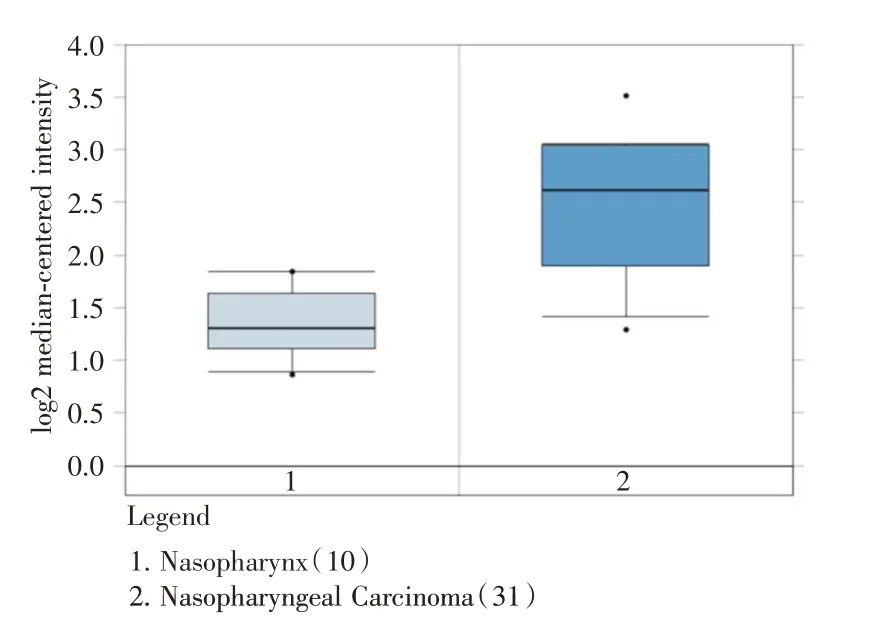
图1 NUAK1 在鼻咽癌和正常鼻咽组织的表达(oncomine数据库)Fig.1 Expression of NUAK1 in nasopharyngeal carcinoma and normal nasopharyngeal tissue(oncomine database)
2.2 NUAK1 mRNA在鼻咽癌组织中的表达qRTPCR 结果显示在16 例鼻咽癌和16 例鼻咽黏膜慢性炎组织中NUAK1 mRNA 的表达水平分别为(2.52 ± 1.61)和(1.31 ± 0.78)。鼻咽癌组织中NUAK1 mRNA 的表达量明显高于鼻咽黏膜慢性炎组织(P<0.05)。见图2。
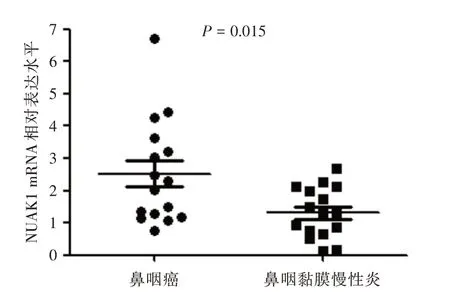
图2 NUAK1 mRNA 在鼻咽癌和鼻咽黏膜慢性炎组织的相对表达水平Fig.2 Relative expression levels of NUAK1 mRNA in nasopharyngeal carcinoma and chronic inflammation of nasopharyngeal mucosa
2.3 NUAK1蛋白在鼻咽癌组织中的表达在88例鼻咽癌及30 例鼻咽黏膜慢性炎组织标本石蜡切片中,免疫组化结果显示NUAK1 蛋白在52 例鼻咽癌组织中高表达,在36 例鼻咽癌组织中低表达;NUAK1 蛋白在8 例鼻咽黏膜慢性炎组织中高表达,在22 例鼻咽黏膜慢性炎组织中低表达。鼻咽癌组织的NUAK1 蛋白表达率明显高于鼻咽黏膜慢性炎组织(P<0.05)。见图3。另外,鼻咽癌中NUAK1 蛋白的表达与淋巴结转移相关(P<0.05),与年龄、性别、T 分期、临床分期等无相关(P>0.05),见表2。

图3 NUAK1 蛋白在鼻咽癌和鼻咽黏膜慢性炎组织中的表达(免疫组化,400×)Fig.3 Expression of NUAK1 protein in nasopharyngeal carcinoma and chronic inflammation of nasopharyngeal mucosa(immunohistochemistry,400×)
2.4 实验组细胞中NUAK1 表达下降应用qRTPCR 检测NUAK1 mRNA 的表达,结果显示:CNE2细胞株实验组和空载组的NUAK1 mRNA 相对表达量分别为(0.17 ± 0.01)、(1.00 ± 0.02),实验组CNE2 细胞NUAK1 mRNA 相对表达量明显低于空载组(P<0.01);HK1 细胞株实验组和空载组的NUAK1 mRNA 相对表达量分别为(0.06 ± 0.01)、(1.00±0.01),实验组HK1 细胞NUAK1 mRNA 相对表达量明显低于空载组(P<0.001),表明siRNANUAK1 CNE2 细胞和HK1 细胞均构建成功。见图4。
2.5 沉默NUAK1 对鼻咽癌细胞株CNE2、HK1 迁移和侵袭能力的影响Transwell 迁移实验结果显示,沉默NUAK1后CNE2、HK1细胞实验组穿膜细胞数分别为(176.40±9.76)、(99.00±7.62)个,CNE2、HK1 细胞空载组穿膜细胞数分别为(233.20 ±6.25)、(186.20 ± 5.91)个。实验组穿膜细胞数明显少于空载组(P<0.05),提示沉默NUAK1 后鼻咽癌细胞CNE2、HK1 迁移能力减弱,见图5。

表2 NUAK1 蛋白表达与鼻咽癌临床病理学指标的关系Tab.2 Relationship between NUAK1 protein expression and clinicopathological indexes of nasopharyngeal carcinoma 例

图4 NUAK1 mRNA 在不同细胞中的相对表达量Fig.4 The relative expression of NUAK1 mRNA in different cells
Transwell 侵袭实验结果显示,沉默NUAK1 后CNE2、HK1 细胞实验组穿膜细胞数分别为(24.20± 2.92)、(54.00 ± 8.62)个,CNE2、HK1 细胞空载组穿膜细胞数分别为(93.00 ± 3.54)、(173.60 ± 9.32)个。实验组穿膜细胞数明显少于空载组(P<0.05),提示沉默NUAK1 后鼻咽癌细胞CNE2、HK1侵袭能力减弱,见图6。

图5 沉默NUAK1 对鼻咽癌细胞CNE2、HK1 迁移能力的影响(24 h,200×)Fig.5 Effect of NUAK1 silencing on CNE2 and HK1 migration of nasopharyngeal carcinoma cells(24 h,200×)

图6 沉默NUAK1 对鼻咽癌细胞CNE2、HK1 侵袭能力的影响(24 h,100×)Fig.6 Effect of NUAK1 silencing on CNE2 and HK1 invasion ability of nasopharyngeal carcinoma cells(24 h,100×)
3 讨论
鼻咽癌的发生发展是一个多阶段、多因子参与的复杂过程,而肿瘤的恶性程度与其浸润转移相关。据报道,AKT 在促进细胞转移和侵袭中起着重要作用[7],AKT/NUAK1 通路是决定肿瘤细胞的浸润和转移的关键肿瘤侵袭相关因子之一[8]。近年来,越来越多的证据表明NUAK1 在肿瘤的转移和侵袭中发挥重要作用。HUANG 等[11]报道NUAK1 蛋白表达在10 对人胰腺癌组织高于相应的相邻正常组织,并且促进了胰腺癌细胞的增殖、迁移和侵袭。CHANG 等[12]研究得出在AKT 的调控下,ARK5 可能通过MMP2、MMP9 的激活增强了乳腺癌MDA-MB-231 细胞的侵袭和转移潜能。CHEN 等[13]研究表明NUAK1 表达与胃癌肿瘤转移和患者生存密切相关,可能通过上皮-间质转换(EMT)改变参与胃癌细胞的迁移和侵袭。众所周知,EMT 指上皮细胞在特定的生理或病理情况下向间质细胞转化的现象,在肿瘤的发生发展中扮演重要的角色。在鼻咽癌中,多种抑癌或促癌的基因或者非编码RNA 已被报道通过EMT 途径参与到鼻咽癌的发生发展之中,如钙网蛋白通过诱导细胞EMT 促进鼻咽癌迁移和侵袭[14]、miR-124则可能通过Akt 信号通路抑制鼻咽癌细胞株EMT,并增加鼻咽癌细胞的放疗敏感性[15]。然而,目前NUAK1 基因对鼻咽癌细胞的生物学功能的影响尚未见报道,NUAK1 在鼻咽癌中的作用是否与EMT相关尚未明确,因此这将是笔者下一步研究的重点。
本研究首先从GEO 数据库中获取了31 例鼻咽癌和10 例正常鼻咽组织的全基因组芯片数据,发现NUAK1 基因在鼻咽癌的表达是正常鼻咽组织的2.18 倍。在侵袭能力较高的头颈部癌症中,NUAK1 已被证实与头颈部癌症的侵袭和淋巴结转移密切相关[16]。LIU 等[17]也用免疫组化方法验证了NUAK1 蛋白在鼻咽癌中高表达,并且高NUAK1表达与鼻咽癌的预后不良相关。进一步收集人鼻咽癌和鼻咽黏膜慢性炎组织,通过qRT-PCR 技术发现NUAK1 mRNA 在鼻咽癌中高表达,免疫组化方法验证了NUAK1 蛋白在鼻咽癌中的表达高于鼻咽黏膜慢性炎,并且NUAK1 蛋白的表达与鼻咽癌淋巴结的转移相关。笔者推测NUAK1 是鼻咽癌侵袭转移的关键因子,可能作为淋巴结转移的靶向治疗。
肿瘤细胞迁移、侵袭能力是肿瘤浸润、转移和复发的重要因素,是许多恶性肿瘤患者死亡的主要原因。为了更好地了解NUAK1 基因可能在鼻咽癌侵袭转移中发挥的作用,本研究设计了siRNA-NUAK1,沉默NUAK1 在鼻咽癌细胞株CNE2、HK1 的表达,发现NUAK1 表达下调的CNE2、HK1细胞株中迁移和侵袭能力均下调,说明NUAK1 基因在鼻咽癌的浸润转移中发挥正向调控作用。然而,NUAK1 如何影响鼻咽癌细胞的迁移与侵袭的机制尚未明确。肿瘤细胞的EMT 使其获得侵袭和迁移能力,激活肿瘤细胞EMT 发生的分子机制是目前研究肿瘤转移的热点[18-19]。近年来的研究表明在胃癌、头颈部癌症中,NUAK1 诱导EMT 有利于肿瘤细胞的侵袭转移[13,15]。因此,笔者推测NUAK1 与EMT 在鼻咽癌的浸润转移中也存在一定的关系,这有待进一步实验证实。
综上所述,本研究发现NUAK1 基因在鼻咽癌中表达上调,并且与淋巴结转移密切相关。通过siRNA 技术干扰NUAK1 的表达可以显著抑制鼻咽癌细胞的迁移和侵袭能力,提示NUAK1 可能是一种与鼻咽癌浸润转移有关的分子标志物,但NUAK1 对抑制鼻咽癌进展的分子机制及其临床应用价值尚未明确,有待后续深入研究。

