SOCS1过表达的树突细胞对慢性阻塞性肺疾病小鼠肺组织中Th17及Treg相关细胞因子的影响
刘茂茂 郑相如 欧阳瑶
遵义医科大学附属医院呼吸一科(贵州遵义563000)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种发病机制尚不明确且严重危害人类健康的慢性呼吸系统疾病,其具有高患病率、高致残率、高病死率[1]。许多研究表明患有自身免疫性疾病的患者合并COPD 的概率增高,免疫的紊乱也许会进一步加重COPD 病程[2],此揭示COPD 也许是自身免疫性疾病中的一种[3]。
辅助性T细胞和树突细胞(dendritic cells,DCs)是参与COPD 的重要免疫细胞。Th17 分泌IL-22、IL-21、IL-17 及影响IL-23 等细胞因子加入到炎症和自身免疫疾病的发生发展中[4]。Treg 通过分泌IL-10 和TGF-β 等抗炎及抑制性细胞因子参与并维持免疫稳态及耐受[5]。据报道,COPD 气道放大的炎症反应与Th17 及Treg 异常反应有关,Th17/Treg 的失衡及相关细胞因子参与了COPD 发病机制[6]。本课题组前期研究发现Th17/Treg 失衡及DCs 在COPD 发病中扮演重要角色[7]。DCs 能捕获、递呈抗原到初始的T 细胞,其对特异性免疫应答起到一个很关键的作用[8]。细胞因子信号转导抑制因子(suppressors of cytokine signaling,SOCS)蛋白能参与到负性调节酪氨酸激酶信号转导及转录激活因子(janus kinase-signal transducers and activators of transcription,JAK-STAT)信号传导途径中,主要传导细胞因子转导信号,参与免疫调节,其中SOCS1 能影响DCs 分化及功能[9]。报道示过表达SOCS1 使DCs 偏向imDCs,减低T 细胞的活性,呈现免疫耐受,从而参与自身免疫性疾病[6],但COPD 中尚未报道。鉴于Th17 及Treg 在COPD中的作用及DC-SOCS1 对T 细胞的影响,因此,本研究拟通过DC-SOCS1 干预COPD 模型小鼠,阐明肺组织中IL-17,IL-23,IL-10 和TGF-β 变化,希望为COPD 的防治提供新思路及策略。
1 材料与方法
1.1 实验动物及和主要试剂C57BL/6 小鼠,6 ~8 周,80 只[第三军医大学的动物实验中心提供,小鼠许可证号:SCXK(渝)2017-0001]。胎牛血清(FBS)、RPMI 1640 培养基(Gibco 公司),小鼠白细胞介素-17(IL-17)、白细胞介素-23(IL-23)、白细胞介素-10(IL-10)、转化生长因子β(TGF-β)ELISA kit(北京丽科创欣生物科技有限公司),GMCSF、IL-4(PEPROTECH 公司),一抗为兔来源的SOCS1(Abcam 公司),二抗为羊抗兔IgG(sigma 公司),质粒小量抽提试剂盒(Promega 公司),DH5α感受态(TaKaRa 公司)。
1.2 小鼠骨髓源性DCs的提取及培养处死小鼠,分离去除股骨和胫骨的骨骺端,用PBS对骨髓冲洗,用离心机1 000 r/min 离心5 min,丢弃上清液体,再次用PBS 混匀底部细胞沉淀,用混匀的细胞液同淋巴细胞分离液一起离心(2 000 r/min 20 min),抽出骨髓基质细胞层部分,PBS 洗3 次。对细胞进行接种培养并于第7天加LPS(100 ng/μL)诱导成熟。
1.3 扫描电镜观察LPS 诱导成熟的DCs对铺片培养的细胞进行PBS 漂洗,先后用戊二醛、锇酸4 ℃固定,以醋酸异戊酯脱水、取样。真空喷镀法对样品进行导电处理,镜下观察。
1.4 SOCS1 慢病毒及空载慢病毒的构建及感染骨髓源性imDCs原代分离培养DC,第5 天行慢病毒感染。取出4 ℃保存的病毒,离心20 s。据预实验确认MOI=100 进行试验,慢病毒用量=MOI×细胞数目/慢病毒滴度,吸取病毒液加入细胞,并加5 μg/mL 的Polybrene 助转染剂。混匀后将24 孔板放在37 ℃度培养箱中孵育。24 h 更换培养基。感染4 h 后,荧光显微镜观察荧光表达。
1.5 Western blot 分析DC-SOCS1 表达效果BCA法蛋白定量按照1:50 比例稀释样品液,加BCA工作液,37 ℃孵箱孵育30 min,酶标仪在562 nm 波长处测定待测样品液浓度,蛋白变性后-20 ℃保存。SDS-PAGE 电泳:配胶及灌胶、上样、转膜,封闭,孵育一抗过夜(内参一抗稀释浓度1∶1 000,DC-SOCS1 一抗稀释浓度1∶500)。孵育二抗1.5 h(1∶1 000)清洗,显色。
1.6 COPD 造模及DCs 回输48 只雄性6 ~8 周龄体质量20 ~25 g 的C57BL/6 小鼠予以随机分组,每组各6 只共8 组。A:正常空气对照组;B:生理盐水回输组(烟熏第1 天);C:早期低剂量DCSOCS1 回输组(烟熏第1 天);D:早期高剂量DCSOCS1 回输组(烟熏第1 天);E:imDCs 1×106回输组(烟熏第1 天);F:低剂量DC-SOCS1 回输组(烟熏第7 天);G:高剂量DC-SOCS1 回输组(烟熏第7 天);H:imDCs 1×106回输组(烟熏第7 天),以上回输均以0.1 mL/10 g 进行回输。置于12 ~12 h 昼夜交替动物房,小鼠适应性喂养1 周后进行实验(低剂量:1 × 106高剂量:2 × 106)。以28 d 烟熏法COPD 模型小鼠[10]制模型,将小鼠放在自制的烟熏箱(45 cm × 30 cm × 30 cm)中,使它们人为被动地吸烟,每次3 支,每次1 h,每天4 次,每周7 d,烟熏28 d。对照组则于空气中正常饲养。余7 组进行上述差异化处理。
1.7 肺组织标本的处理及HE 染色建模28 d 后,通过腹腔注射7%的水合氯醛(5 mL/kg)麻醉小鼠,用冰PBS 洗净获取的新鲜肺组织,左上叶肺组织用于HE 染色:切片烘烤、脱腊、染色、封片、镜检。
1.8 ELISA 测肺组织中IL-17、IL-23、IL-10 和TGF-β收集肺组织匀浆上清液,ELISA 检测肺组织中IL-17、IL-23、IL-10 和TGF-β的水平做标准曲线(IL-17、IL-23:240、160、80、40、20 μg/mL;IL-10:600、400、200、100、50 μg/mL;TGF-β:180、120、60、30、15 μg/mL)、加入待测样品、温育、洗涤、酶标试剂、洗涤、显示、终止、450 nm 波长测OD值。
1.9 统计学方法运用GraphPad Prism 6、SPSS 18.0 分析所得的实验数据。运用Kolmogorov-Smirnov 方法检验计量资料的分布正态性。结果显示,本实验的计量资料都符合正态分布,用表示,多组间的比较使用单因素方差分析。以析因设计资料的方差分析实验中回输细胞类型及回输时间对细胞因子的作用。以LSD-t、Dunnett-t检验均数间多重比较。P<0.05 表示差异存在统计学意义。
2 结果
2.1 培养及鉴定小鼠骨髓源性DCs从小鼠股骨及胫骨中冲洗提取骨髓源性DCs。于含GM-CSF、IL-4 的培养基中培养,诱导前体细胞向imDCs 分化,于第7 天加LPS 成熟刺激24 h,用扫描电镜观察,镜下见树枝状突起不规则的典型DCs 形态特征(图1)。这表明骨髓源性DCs 的成功提取、培养及鉴定,且经LPS 刺激后能正常成熟。
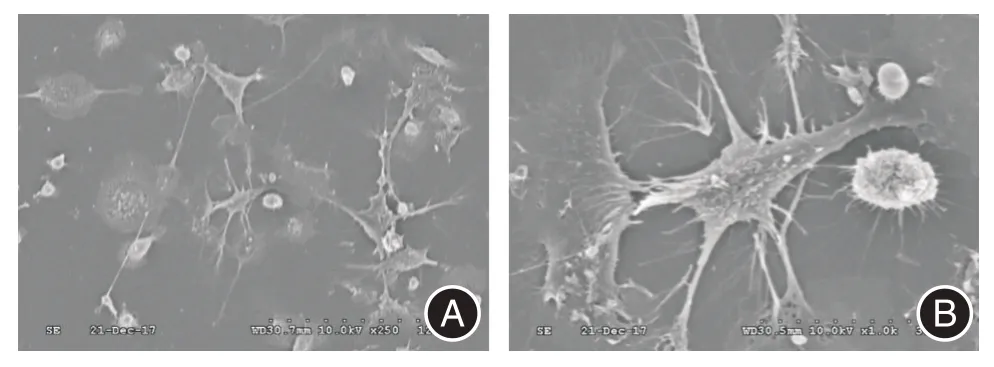
图1 扫描电镜:LPS 诱导成熟的DCsFig.1 Scanning electron microscope:LPS-induced mature DCs
2.2 构建DC-SOCS1 模型荧光显微镜观察荧光表达,图2中绿色荧光表示载有过表达SOCS1 的imDCs 及空转慢病毒的imDCs。
使用WB 测定SOCS1 的表达情况,结果显示:SOCS1 在DC-SOCS1 中的表达(43.77 ± 3.73)较DCs-Lv-GFP(17.29 ± 4.47)和imDCs 组(18.88 ±3.22)明显增加,且均具有统计学意义(P<0.01,见图3)。

图2 过表达SOCS1 的imDCs 及空转慢病毒的imDCs(×100)Fig.2 Lentiviral transfection into bone marrow-derived imDCs(×100)
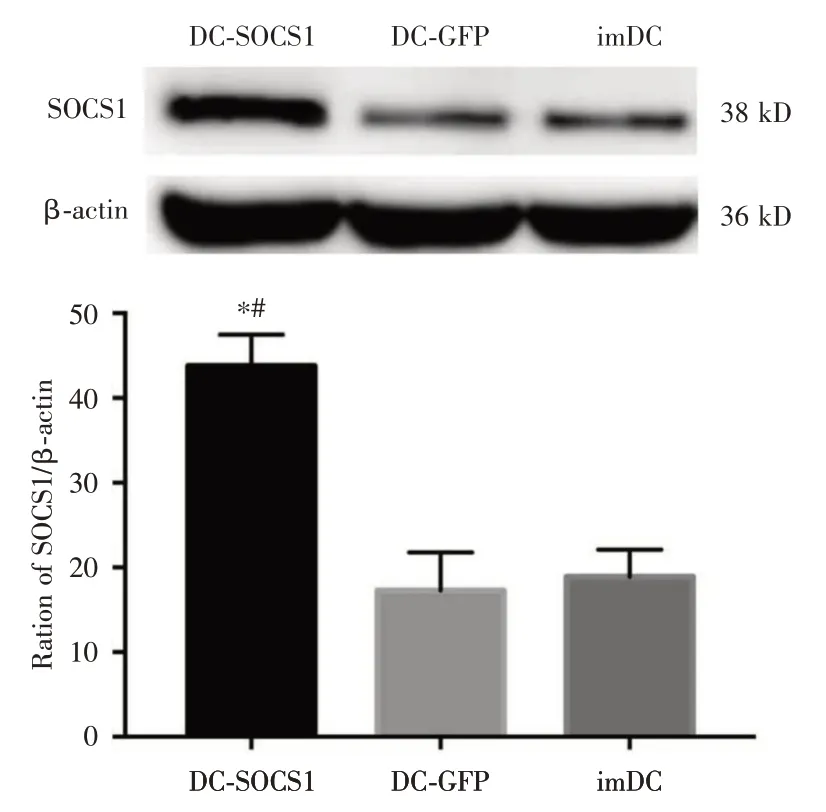
图3 Western blot 测DC-SOCS1 中SOCS1 表达水平Fig.3 Expression level of SOCS1 in DC-SOCS1 detected by Western blot
2.3 烟熏28 d 后小鼠肺组织病理变化特征本研究采用28 d 烟熏法构建COPD 模型,将空气对照组和回输生理盐水组肺组织进行HE 染色。如图4A示,空气对照组小鼠肺组织的肺泡结构清晰,肺泡壁完整,无断裂、融合,其间仅见少许浸润的炎性细胞。COPD 烟熏模型组(图4B)肺组织中可见大量炎性细胞浸润,肺泡壁结构破坏,断裂,相邻肺泡腔相互融合扩大,构成典型肺气肿征象,此烟熏小鼠模型具有COPD 典型的病理学特征,包括肺实质炎症和肺气肿。
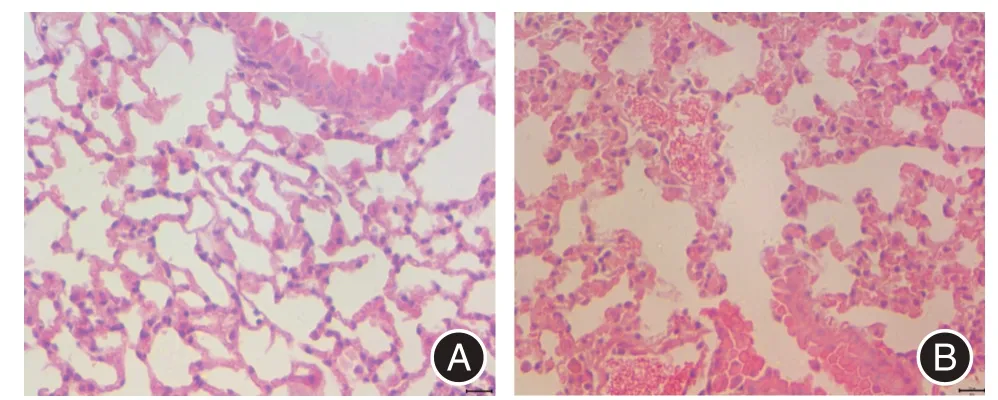
图4 COPD 小鼠模型肺组织的HE 染色(×400)Fig.4 HE staining of lung tissue in COPD mice(×400)
2.4 过表达SOCS1的DCs干预COPD小鼠后肺组织Th17相关细胞因子IL-17及IL-23表达减少烟熏第1 天回输后,小鼠肺组织IL-17 及IL-23 表达水平在生理盐水组、imDCs 组、低剂量DC-SOCS1 组(1 × 106)和高剂量DC-SOCS1 组(2 × 106)间的差异具有统计学意义(P<0.05)。和生理盐水组比,IL-17 及IL-23 在肺组织的表达水平在其他三组均显著降低。析因设计方差分析显示,各组小鼠肺组织中IL-17 及IL-23 的表达水平存在差异。DC-SOCS1 组 和imDCs 组 比,IL-17 及IL-23 表 达水平降低(P<0.05),且DC-SOCS1(2 × 106)组较DC-SOCS1(1 × 106)组降低更显著(P<0.05);烟熏早期(第1 天)较第7 天降低(P<0.05);此外,烟熏后不同回输的分组和时间共同起作用,本研究发现IL-17、IL-23 最低水平时是发生在回输DC-SOCS1(2×106)第1 天后。见表1、2。
表1 IL-17 在COPD 小鼠肺组织中的表达(n=6)Tab.1 Expression of IL-17 in lung tissue of COPD mice±s
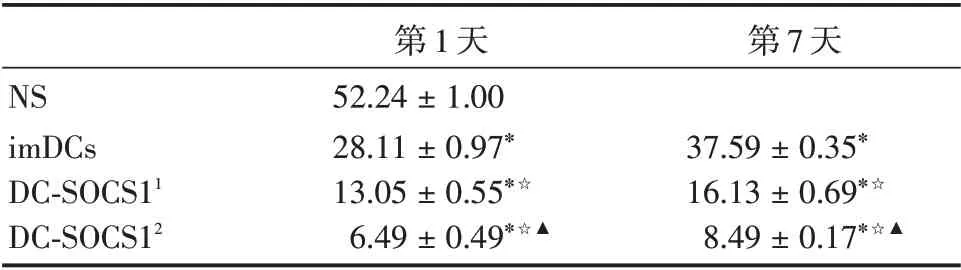
表1 IL-17 在COPD 小鼠肺组织中的表达(n=6)Tab.1 Expression of IL-17 in lung tissue of COPD mice±s
注:与NS 组比较,*P <0.05 ;与同imDCs 组比较,☆P <0.05 ;与同DC-SOCS11 组比较,▲P <0.05;DC-SOCS11 代表1× 106 DCSOCS1;DC-SOCS12代表2×106 DC-SOCS1
第7 天NS imDCs DC-SOCS11 DC-SOCS12第1 天52.24±1.00 28.11±0.97*13.05±0.55*☆6.49±0.49*☆▲37.59±0.35*16.13±0.69*☆8.49±0.17*☆▲
表2 COPD 小鼠模型肺组织中IL-23 的表达(n=6)Tab.2 Expression of IL-23 in lung tissue of COPD mice±s

表2 COPD 小鼠模型肺组织中IL-23 的表达(n=6)Tab.2 Expression of IL-23 in lung tissue of COPD mice±s
注:与NS 组比较,*P <0.05 ;与imDCs 组比较,☆P <0.05 ;与同DC-SOCS11 组 比 较,▲P <0.05;DC-SOCS11 代 表1× 106 DCSOCS1;DC-SOCS12代表2×106 DC-SOCS1
第7 天NS imDCs DC-SOCS11 DC-SOCS12第1 天224.1±1.1 176.3±4.4*139.9±1.4*☆92.2±2.2*☆▲195.4±0.9*152.3±1.1*☆126.3±1.1*☆▲
2.5 过表达SOCS1的DCs干预COPD小鼠后肺组织Treg 相关细胞因子IL-10 及TGF-β表达增加烟熏第1 天回输后,小鼠肺组织IL-10 及TGF-β表达水平在生理盐水组、imDCs 组、低剂量DC-SOCS1组(1×106)和高剂量DC-SOCS1 组(2×106)间的差异具有统计学意义(P<0.05)。和生理盐水组比,余三组中IL-10 和TGF-β在小鼠肺组织中均显著增加。析因设计方差分析示,各组小鼠肺组织IL-10及TGF-β存在差异。DC-SOCS1 组IL-10 和TGF-β的表达水平较imDCs 组增加(P<0.05),且高剂量DC-SOCS1(2 × 106)组较低剂量DC-SOCS1(1 ×106)组IL-10 及TGF-β水平增加更明显(P<0.05);烟熏早期(第1 天)较第7 天增加(P<0.05)。其中,TGF-β在烟熏后不同回输的分组和时间共同起作用,即第1 天回输DC-SOCS1(2 × 106)后水平最高,而对于IL-10 不存在交互作用。见表3、4。
表3 IL-10 在COPD 小鼠肺组织中的表达(n=6)Tab.3 Expression of IL-10 in lung tissue of COPD mice±s
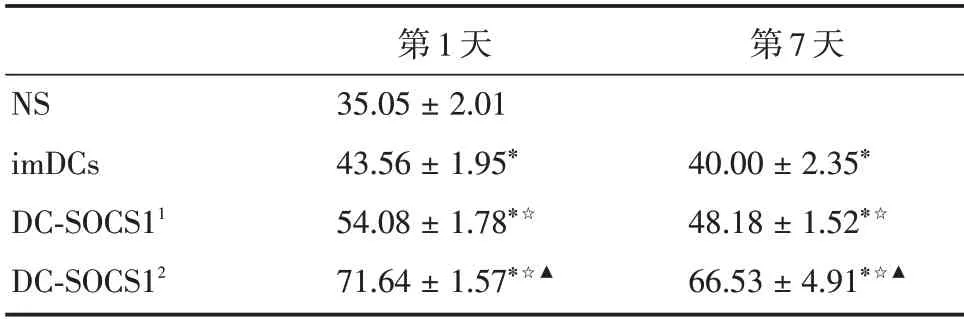
表3 IL-10 在COPD 小鼠肺组织中的表达(n=6)Tab.3 Expression of IL-10 in lung tissue of COPD mice±s
注:与NS 组比较,*P <0.05 ;与同imDCs 组比较,☆P <0.05 ;与同DC-SOCS11 组比较,▲P <0.05;DC-SOCS11 代表1× 106 DCSOCS1;DC-SOCS12代表2×106 DC-SOCS1
第7 天NS imDCs DC-SOCS11 DC-SOCS12第1 天35.05±2.01 43.56±1.95*54.08±1.78*☆71.64±1.57*☆▲40.00±2.35*48.18±1.52*☆66.53±4.91*☆▲
表4 COPD 小鼠模型肺组织中TGF-β 的表达(n=6)Tab.4 Expression of TGF-β in lung tissues of COPD mice±s
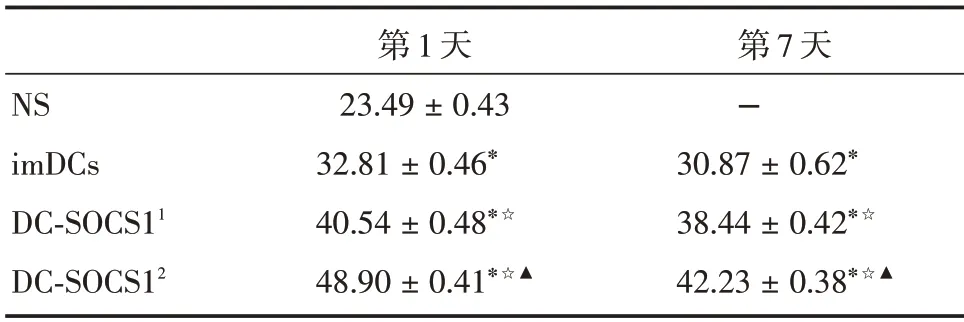
表4 COPD 小鼠模型肺组织中TGF-β 的表达(n=6)Tab.4 Expression of TGF-β in lung tissues of COPD mice±s
注:与NS 组比较,*P <0.05 ;与同imDCs 组比较,☆P <0.05 ;与同DC-SOCS11 组比较,▲P <0.05;DC-SOCS11 代表1× 106 DCSOCS1;DC-SOCS12代表2×106 DC-SOCS1
NS imDCs DC-SOCS11 DC-SOCS12第1 天23.49±0.43 32.81±0.46*40.54±0.48*☆48.90±0.41*☆▲第7 天-30.87±0.62*38.44±0.42*☆42.23±0.38*☆▲
3 讨论
Th17 具强烈的促炎活性,可招募巨噬细胞和中性粒细胞,产生IL-17 放大炎症反应,促进炎性疾病的发展,也可通过IL-23 促进自身分泌IL-17,维持及放大其功能,在许多炎症及自身免疫性疾病中发挥重要作用[11]。研究发现Th17 相关细胞因子在COPD 模型中是增加的,且与疾病的严重程度及FEV1%呈正相关[12]。本实验用DC-SOCS1 及imDC 对COPD 小鼠进行干预,通过ELISA 测Th17相关细胞因子IL-17 及IL-23 的变化。与对照组比,imDCs、低剂量DC-SOCS1(1 × 106)和高剂量DC-SOCS1(2 × 106)回输后均能减少COPD 小鼠肺组织IL-17 和IL-23 的表达,其中DC-SOCS1 效果显著,且在本实验中与浓度及时间有关。鉴于Th17及其相关细胞因子在COPD 中的促炎作用,推测DC-SOCS1 干预后可能通过减少Th17 相关细胞因子的表达,减轻COPD 的肺部炎症反应,从而减轻或延缓COPD 的病情进展。当然,这有待本课题组进一步的肺组织病理结果证实。
Treg 通过细胞间的直接接触或间接分泌细胞因子,主要是IL-10 和TGF-β等抑制T 细胞的增殖分化,从而在免疫耐受及机体稳态中发挥重要作用。有报道示免疫微环境改变刺激细胞因子产生,引起Th17/Treg 的失衡并参与COPD 的发生发展,且Treg 及其细胞因子IL-10 和TGF-β是减少的[13]。在本实验中经DC-SOCS1 或imDC 干预后IL-10 及TGF-β表达增加,且DC-SOCS1效果较imDC显著,并与时间及浓度有关。推测其可能通过增加Treg 相关细胞因子IL-10 及TGF-β的表达,增强机体的抗炎或诱导免疫耐受的能力,延缓COPD 的病情。
研究发现原花青素减轻支气管哮喘的气道炎症是通过抑制imDC 的成熟及诱导免疫耐受实现[14]。本实验发现DC-SOCS1 的干预效果均优于imDC,结合抗原刺激DC 成熟及SOCS1 对imDC抑制成熟作用,推测可能是imDC 回输入体后经体内抗原等刺激,逐渐成熟,其诱导免疫耐受的能力减弱或消失,而过表达SOCS1 能持续抑制imDC 成熟,使DC-SOCS1 倾向于imDC 从而诱导免疫耐受所致。此外,本实验中亦发现,DC-SOCS1 的干预效果可能与浓度及时间有关,即早期高浓度对Th17及Treg 相关细胞因子的影响更明显,推测其可能原因为高浓度下越早干预,越能及时抑制imDC 的成熟并较好地诱导免疫耐受所致。
DC-SOCS1 对T 细胞增殖分化及功能的影响,在肿瘤、移植物抗宿主病及自身免疫性疾病中已被广泛研究,但在COPD 中尚未报道,本实验以DC-SOCS1 干 预COPD 小 鼠 模 型,发 现COPD 小 鼠肺组织中Th17 相关细胞因子IL17 及IL-23 是减少的,而Treg 相关细胞因子IL-10 及TGF-β是增加的,可能为COPD 的干细胞防治提供新思路。当然,本实验有局限性,如仅从细胞因子层面反映了DC-SOCS1 对COPD 小鼠的影响,缺乏各组肺组织病理改变予以证实,且缺乏其具体的作用机制,这也是本课题组正在进行的实验,以期找到延缓或改善COPD 病情的新策略。

