黄芩素对糖尿病大鼠胰岛功能的影响及其机制探讨
近年来,中国的糖尿病患病率不断攀升,截至2013年,中国成年人糖尿病患病率已达10.4%[1],即我国有1.4亿糖尿病病人,位居全球第一,且仍有63%的糖尿病病人未得到诊断,严重危害人类健康。糖尿病不断进展的重要原因是胰岛β细胞功能进行性减退,而β细胞凋亡是导致2型糖尿病β细胞功能减退的重要原因[2],因此抑制β细胞过度凋亡,成为治疗糖尿病的关键要素。黄芩素是黄芩中含量最高的黄酮类化合物之一,其具备很强的抗氧化作用[3]。而胰岛β细胞容易受到氧化应激攻击而发生凋亡,目前有关黄芩素的降糖、改善胰岛功能的作用鲜有报道。本研究通过制备2型糖尿病大鼠模型,采用黄芩素干预治疗,通过检测大鼠外周血血糖、胰岛素、胰腺组织膜脂过氧化产物丙二醛(malondialdehyde,MDA)及抗氧化物超氧化物歧化酶 (superoxide dismutase,SOD)、凋亡蛋白的表达变化,观察黄芩素对2 型糖尿病大鼠的治疗效果,并初步探讨其可能的作用机制。
1 材料与方法
1.1 实验动物 6周龄SPF级雄性Wistar 大鼠30只,体质量180~250 g,购至上海斯莱克实验动物有限责任公司[许可证号码SCXK(沪)2012-0002]。通过厦门大学附属福州第二医院动物伦理委员会审核(审批号2016-021)。
1.2 试剂及仪器 黄芩素(上海图赫实业有限公司); 链脲佐菌素(streptozotocin,STZ,美国Sigma 公司);MDA检测试剂盒 (山西澳瑞鑫生物科技有限公司);胰岛素检测试剂盒和SOD检测试剂盒(天津易捷康科技发展有限公司);血糖仪及试纸(美国雅培公司,FreeStyle Optium Neo H);相关抗体cleaved Caspase-3、β-actin(美国CST公司)。仪器:TGL-16M低温高速离心机(常州金坛良友仪器有限公司),科华酶标仪ST-360(济南来宝医疗器械有限公司),DYY-6C型电泳仪(南京普阳科学仪器研究所)。
1.3 模型制备及分组 6周龄雄性Wistar 大鼠30只,适应性喂养1周后,采用随机数字表法随机抽出10只作为正常对照组(NC组),余下20只为造模组。NC组普通饲料喂养,与造模组同步腹腔注射相应剂量的0.1 mol/L柠檬酸盐缓冲液。
造模组高脂饲料喂养4周后,腹腔注射STZ(25 mg/kg)2 次,间隔1周;1周后检测空腹血糖 (fasting blood glucose,FBG),当FBG≥7.8 mmol/L时,模型构建成功,最终成模率为100%[4]。将已造模成功的20只大鼠再按随机数字表法随机分为两组,糖尿病模型组(DM组)和黄芩素组(BAI组),每组10只。开始给药,每日09:00~10:00灌胃给药1次,灌胃期间每4周断尾测定血糖1次,连续灌胃8周。BAI组给予黄芩素250 mg/kg灌胃;NC组及DM组用相同容量的生理盐水灌胃。
1.4 样品收集 末次给药后,麻醉大鼠,腹主动脉采血10 mL,采用注射麻醉法处死大鼠。留取全血,离心15 min后分离血清备用。分离胰腺,液氮速冻,而后转至-80 ℃冰箱冻存。
1.5 FBG及空腹胰岛素(FINS)检测 FBG浓度采用血糖仪测定;采用ELISA法测定血清FINS。
1.6 胰腺组织中MDA及SOD检测 取胰腺组织(1 g 左右)剪碎,研磨制成10%胰腺组织匀浆,离心,取上清液冷冻保存。分别按试剂盒说明书测定 MDA和SOD含量。
1.7 Western 印迹法检测cleaved Caspase-3的表达 取大鼠胰腺组织蛋白1 g左右,加入RIPA裂解液,分离胰腺组织蛋白,二喹啉甲酸(BCA)法测定蛋白浓度,取等量蛋白电泳,同时PVDF膜印迹,室温下封闭后,加入 cleaved Caspase-3一抗溶液,及标准内参β-actin,4 ℃孵育过夜,而后再加入HRP-山羊抗兔IgG二抗溶液,室温孵育1 h,电化学发光显色,Bio-Rad凝胶成像系统成像,Quantity-One测灰度值并分析。实验重复4次,取平均值。

2 结 果
2.1 各组大鼠FBG、FINS水平比较(见表1) 与NC组比较,DM组FBG水平升高(P<0.05),而FINS水平降低(P<0.05);与DM组比较,BAI组的FBG水平降低(P<0.05),而FINS水平升高(P<0.05)。

表1 各组大鼠FBG、FINS水平比较(±s)
与NC组比较, 1)P<0.05;与DM组比较,2)P<0.05
2.2 各组大鼠胰腺SOD活性和MDA含量比较(见表 2) 与NC组比较,DM组SOD活性明显下降(P<0.05),MDA含量明显升高(P<0.05);与DM组比较,BAI组SOD活性明显升高(P<0.05),MDA含量明显降低(P<0.05)。

表2 各组大鼠胰腺SOD 活性和MDA含量比较(±s)
与NC组比较, 1)P<0.05;与DM组比较,2)P<0.05
2.3 各组大鼠胰腺组织凋亡蛋白cleaved Caspase-3蛋白表达比较(见图 1、表 3) 与NC组比较,DM组cleaved Caspase-3表达升高(P<0.05),而BAI组给予黄芩素治疗8周后,cleaved Caspase-3表达显著下降(P<0.05)。
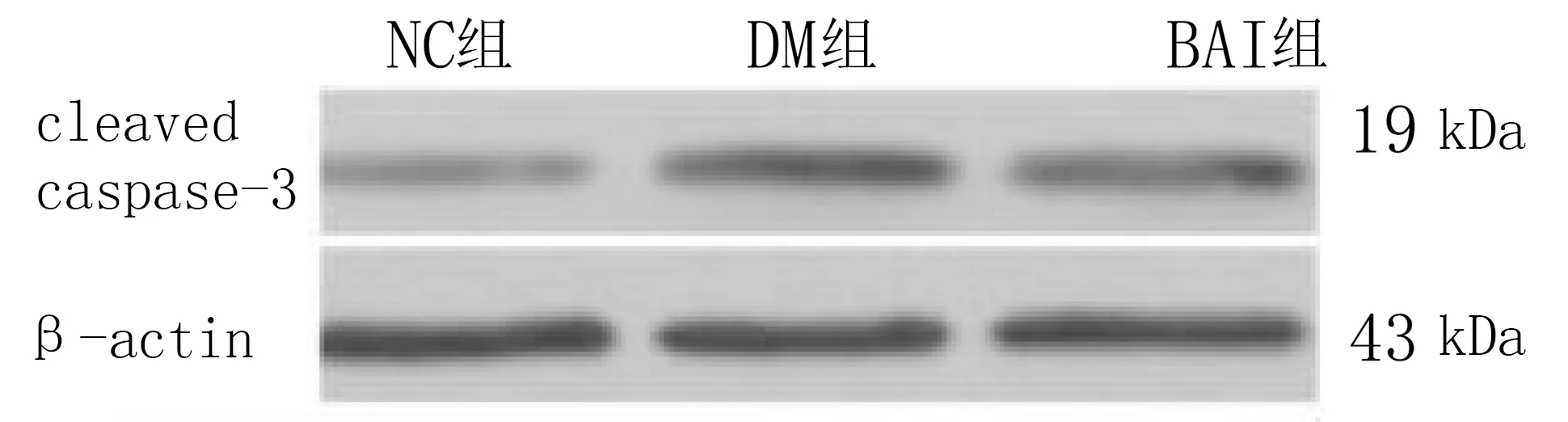
图1 各组大鼠 cleaved Caspase-3蛋白电泳图

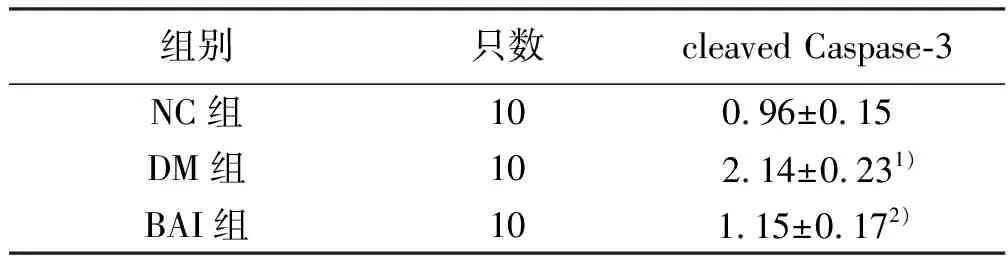
组别只数cleaved Caspase-3NC组100.96±0.15 DM组102.14±0.231)BAI组101.15±0.172)
与NC组比较, 1)P<0.05;与DM组比较,2)P<0.05
3 讨 论
黄芩是著名的传统中药,黄芩素是黄芩中含量最高的黄酮类化合物之一,其具备抗炎、抗氧化、清除氧自由基及抗肿瘤等作用[5],其中以抗氧化作用尤为突出。黄芩素分子结构内含有3个羟基,因而它们具有一定的自由基清除活性。研究发现黄芩素对羟自由基、超氧阴离子( O2-)及烷过氧自由基有较强的清除作用[4]。
有研究表明,糖尿病的发生发展与氧化应激有密切的关系[6]。胰岛β细胞对活性氧自由基(reactive oxygen species,ROS)的变化非常敏感,而胰腺抗氧化物水平比较低(包括过氧化氢酶、谷胱甘肽过氧化物酶和超氧化物歧化酶),因此,胰岛β细胞容易受到氧化应激攻击而出现损伤[7]。糖尿病持续的高血糖可致使胰腺组织产生大量ROS,而其抗氧化酶活性下降,胰腺组织氧化应激增强。MDA是膜脂过氧化重要的产物之一,膜脂过氧化的程度可通过MDA了解[8]。本研究中,DM组大鼠胰腺MDA显著高于NC组大鼠,而SOD活性显著下降,说明糖尿病大鼠胰腺组织中ROS生成增多,而抗氧化防御系统能力降低,胰腺组织受到氧化应激攻击而损伤,从而影响胰岛分泌功能。给予糖尿病大鼠黄芩素治疗后,糖尿病大鼠血糖显著下降,胰岛素分泌增加,同时胰腺组织中MDA减少,SOD活性增加,说明黄芩素可抑制糖尿病大鼠胰腺组织中氧化应激,改善胰岛β细胞的分泌功能,在一定程度上缓解了糖尿病大鼠的糖尿病症状。
在2型糖尿病高糖、高脂的状态下,大量 ROS产生,不可避免地出现胰岛β细胞的凋亡,引起胰岛β细胞崩解。ROS可导致胰岛β细胞线粒体膜的损伤,使其通透性增高,细胞色素C被释放到细胞质中,激发胰岛β细胞凋亡,从而导致靶组织损伤[9]。细胞凋亡主要有两条通路: ①线粒体所介导的凋亡途径(线粒体通路),也被称为细胞凋亡的内源途径,如Bcl-2/Bax 凋亡途径;②死亡受体通路,也被称为细胞凋亡的外在途径,主要通过细胞外信号激活细胞内的凋亡酶,包括Fas/Fasl 信号途径和TNFR/TNF信号途径。 两条通路最终都激活Caspase-8、Caspase-9等凋亡启动者,从而引起Caspase级联反应[10-11],进而使细胞内重要的结构蛋白和功能分子断裂,引起细胞凋亡。已有的研究表明,Caspase-3 是细胞凋亡通路中一个重要蛋白酶,同时也是凋亡发生的标志酶[11]。在细胞凋亡中,Caspase-3是主要执行者,其活化时会被剪切生成活性片段cleaved Caspase-3,而后发挥蛋白水解酶作用而促进细胞凋亡,因此可以通过测定cleaved Caspase-3 大致反映细胞凋亡情况[12]。 本研究中,糖尿病大鼠胰腺的 cleaved Caspase-3蛋白表达明显增强,而在给予黄芩素处理后可显著抑制Caspase-3蛋白的表达,cleaved Caspase 3蛋白表达下降,提示黄芩素有降低胰岛β细胞凋亡的作用。
综上所述,黄芩素能降低糖尿病大鼠的血糖,并改善胰腺β细胞的胰岛素分泌功能,其可能的机制是增强胰腺抗氧化的防御,减少氧化应激,最终抑制了cleaved Caspase-3的表达,从而使得β细胞凋亡减少。然而,黄芩素对胰腺β细胞的确切作用机制尚需进一步研究。

