刺参“腐皮综合征”拮抗菌CN101 发酵条件的优化
■王 颖 李雅华 咸洪泉
(青岛农业大学生命科学学院 农业微生物实验室,山东青岛266109)
刺参“腐皮综合征”是一种重要的刺参病害[1-2]。该病具有发病急、发病率高和死亡率高的特点。幼参和成参均可被感染,其中幼参的发病率和死亡率均明显高于成参,死亡率高达90%以上[3]。将“腐皮综合征”拮抗菌制成微生态制剂应用是一种有效的刺参“腐皮综合征”防控手段。而微生态制剂的开发必须首先解决拮抗菌发酵培养的问题,因为不同的拮抗菌菌种所适宜的培养发酵条件不同,因此研究优化“腐皮综合征”拮抗菌高效发酵条件,对刺参“腐皮综合征”病害的防控具有重要意义,可为拮抗菌微生态制剂的开发和微生物发酵饲料的研制奠定基础,为将来拮抗菌微生态制剂和微生物发酵饲料的应用提供科学依据。
刺参“腐皮综合征”是由海水中的灿烂弧菌、假交替单胞菌等病原菌侵入、感染引起的一种刺参重要病害[4]。目前用于防治刺参病害的方法主要有使用抗生素[5]、免疫增强剂[6]、微生态制剂[7]等。抗生素的使用不仅造成了环境的污染,也使细菌产生了抗性,为控制抗性细菌需进一步增加抗生素的投放量[8],形成了恶性循环。免疫增强剂是通过添加一些多糖[9](如壳聚糖、海藻硫酸多糖等)或植物源物质(如党参[10]、甘草酸[11]等)对刺参肠道组织消化酶、蛋白酶等的影响,增强刺参自身的免疫力,从而达到防病的目的。微生态制剂是可直接使用的活菌制剂,制剂中的有益微生物不但可以改善水质,可能还含有其它活性物质,能够帮助刺参的伤口愈合,并能够抑制致病的病原菌感染,具有防治病害发生的作用[12]。有益微生物的使用是刺参“腐皮综合征”病害防控的重要措施和发展趋势。
拮抗菌CN101 是本实验室筛选的对病原菌灿烂弧菌和假交替单胞菌有强拮抗作用、应用安全的一株芽孢杆菌[13],对刺参“腐皮综合征”有良好的防治效果,可用于微生态制剂的开发和微生物发酵饲料的研制,以防治刺参“腐皮综合征”病害。而将该菌株用于制备微生物饲料添加剂的基础和关键是明确拮抗菌CN101的最适发酵条件,以便于实现拮抗菌CN101的大规模发酵培养。因此,本研究在实验室前期研究的基础上,对拮抗菌CN101 的生产发酵条件进行探究,为防控刺参“腐皮综合征”病害和微生物饲料添加剂的研制提供科学依据。
1 材料与方法
1.1 供试菌株
拮抗菌CN101(Bacillus.sp),分离自刺参养殖池底泥,由青岛农业大学农业应用微生物实验室保存。
1.2 培养基
LB培养基:胰蛋白胨10 g、酵母粉5 g、NaCl 10 g、蒸馏水1 000 ml,pH值7.0。
BS 培养基:参考张璐等的发酵培养基[14],乳糖20 g、牛肉膏15 g、K2HPO3·3H2O 0.75 g、MgSO40.75 g、蒸馏水1 000 ml,pH值自然。
Luo 培养基:参考骆艺文的优化培养基[7],葡萄糖10 g、豆饼粉10 g、NaCl 10 g、蒸馏水1 000 ml,pH 值7.5。
2116 培养基:酵母粉1 g、蛋白胨5 g、人工海水1 000 ml,pH值7.5。
人工海水配方:NaCl 28.15 g、MgSO4·7H2O 6.92 g、MgCl2·6H2O 5.51 g、CaCl2·7H2O 0.3 g、KCl 0.67 g、蒸馏水定容至1 000 ml。
li 培 养 基:MgSO4·7H2O 0.2 g、NaH2PO41 g、Na2HPO41 g、葡萄糖10 g、NaCl 5 g、MnSO40.48 g、豆饼粉2 g、玉米粉2 g、蒸馏水1 000 ml,pH值7.0。
1.3 种子液的制备
拮抗菌CN101平板划线至LB固体培养基,挑单菌落接种至100 ml LB 液体培养基中,28 ℃、140 r/min摇床培养24 h,备用。
1.4 细菌数量测定方法
拮抗菌细菌数量以OD600值的大小表示,利用752型紫外可见光分光光度计采用比浊法进行测定。以灭菌的相应培养基调零,将培养一定时间的发酵液样品用灭菌的相应培养基稀释至OD600值的大小在0.2~0.8 之间,测定稀释样品的OD600值。细菌生物量=稀释样品的OD600值×样品的稀释倍数。
1.5 培养基优化
1.5.1 基础培养基的筛选
将种子液以1%的比例接种到装有100 ml不同培养基的250 ml 三角瓶中,28 ℃、140 r/min 培养,每24 h取样测定OD600值一次,测至72 h,三次重复。
1.5.2 培养基成分优化
碳源优化,分别用蔗糖、葡萄糖、可溶性淀粉、玉米粉等量替换乳糖作为基础培养基的碳源,其它组分不变,测定不同碳源对拮抗菌数量的影响。
氮源优化,分别用豆饼粉、蛋白胨、(NH4)2SO4、KNO3、NH4NO3作为氮源等量替换牛肉膏,其它组分不变,测定不同氮源对拮抗菌数量的影响。
无机盐优化,分别用A组MgSO4+MnSO4+K2HPO4、B 组MgSO4+MnSO4+NaCl、C 组K2HPO4+MnSO4+NaCl、D 组K2HPO4+MgSO4、E 组K2HPO4+MgSO4+ NaCl、F 组K2HPO4+MnSO4组合作为无机盐(总量均为1.5 g/l,各组分之间的比例为1:1),其它组分不变,测定不同无机盐组合对拮抗菌数量的影响。
正交试验:用Spss 20进行三因素三水平L9(34)正交试验设计(见表1),确定一组最优培养基配方。
1.6 发酵条件优化
温度对发酵的影响,将种子液接种到装有100 ml培养基的250 ml 三角瓶中,分别置于15、20、25、30、35 ℃全温振荡培养箱中,140 r/min 振荡培养,每24 h测定一次细菌数量,测至72 h;三次重复。
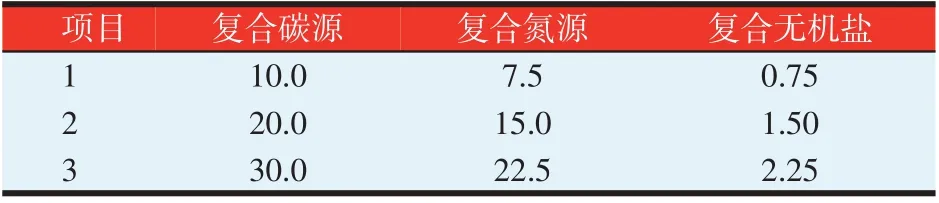
表1 正交试验设计(g/l)
初始pH 值对发酵的影响,分别调节优化培养基的初始pH值为6、7、7.5、8、9,在25 ℃、140 r/min 条件下振荡培养,检测不同pH值和培养时间的细菌数量;三次重复。
接种量对发酵的影响,分别按照1%、3%、5%、7%、9%的接种量,将种子液接种到装有100 ml 优化培养基的250 ml三角瓶中,在25 ℃、140 r/min条件下振荡培养,检测不同接种量和培养时间的细菌数量;三次重复。
装瓶量对发酵的影响,250 ml三角瓶中分别装入25、50、75、100、125 ml的优化培养基,以1%的接种量接种种子液,在25 ℃、140 r/min 条件下振荡培养,检测不同装瓶量和培养时间的细菌数量;三次重复。
1.7 分析方法
试验数据用GraphPad Prism7.00软件进行统计和方差分析。方差分析采用显著水平为P<0.05 的多重比较检验法。
2 结果
2.1 培养基成分优化结果
2.1.1 基础发酵培养基的筛选
本研究在前期研究的基础上,选取5种较适宜的培养基进行基础发酵培养基的筛选,检测了不同培养基中拮抗菌CN101的生长情况(图1)。
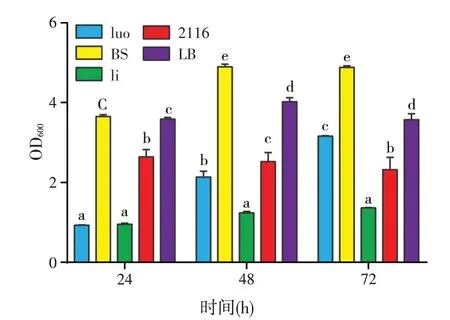
图1 不同基础培养基发酵对菌体生长的影响
结果显示,24 h时BS培养基和LB培养基的培养效果均较好,且两者之间无显著差异;48 h和72 h时,BS培养基的培养效果明显优于LB培养基,说明BS培养基更适于拮抗菌的培养。因此,本试验以BS 培养基作为基础发酵培养基进行培养基成分和发酵条件的优化。
2.1.2 培养基成分的优化
以BS 培养基为基础培养基,测定了淀粉、蔗糖、乳糖、葡萄糖、玉米粉5 种碳源对拮抗菌生长的影响(图2)。不同碳源对拮抗菌的生长有不同程度的影响,供试的碳源中乳糖、蔗糖、葡萄糖较有利于拮抗菌的生长,而淀粉和玉米粉不利于拮抗菌的生长;24 h时培养基中添加蔗糖的菌体数量显著高于添加乳糖、葡萄糖;48 h 和72 h 时,培养基中添加乳糖的菌体数量显著高于添加其他碳源的。培养基中菌体数量在24 h和48 h时蔗糖显著高于葡萄糖,72 h时差异不显著;说明以蔗糖为碳源有利于拮抗菌的快速生长繁殖,以乳糖为碳源有利于获得更高的拮抗菌数量。

图2 不同碳源发酵对菌体生长的影响
因此,综合考虑生长速率、生物产量和原料成本的问题,进一步检测了乳糖和蔗糖的不同配比对拮抗菌生长的影响(图3)。结果表明以乳糖和蔗糖为复合碳源时乳糖与蔗糖比例为3:1时,拮抗菌生长速率、生物产量与以乳糖为单一碳源时无显著性差异,但有利于降低拮抗菌发酵生产的原料成本。所以拮抗菌发酵适宜的碳源为乳糖和蔗糖组成的复合碳源,乳糖与蔗糖的比例为3:1。
以乳糖和蔗糖复合碳源作为基础培养基的碳源,测定了不同氮源对拮抗菌生长的影响,结果表明不同氮源对拮抗菌的生长有一定影响(图4)。有机氮源有利于拮抗菌的生长;其中在24 h和48 h时,含有机氮源豆饼粉的发酵培养基的拮抗菌菌体量最高,与其他氮源相比差异显著。72 h 时蛋白胨作为氮源的培养基拮抗菌菌体量最高,并且显著高于豆饼粉。为获得较高的产量和降低成本,进一步检测了不同配比蛋白胨和豆饼粉对拮抗菌生长的影响,结果显示当复合氮源蛋白胨与豆饼粉比例为1:2 时,更适宜拮抗菌的生长(图5)。

图3 不同碳源比例发酵对菌体生长的影响

图4 不同氮源发酵对菌体生长的影响

图5 不同氮源比例发酵对菌体生长的影响
以优选的复合碳源、复合氮源作为基础培养基的碳源和氮源,探讨了不同无机盐组合对拮抗菌生长的影响(见图6)。图6结果显示24 h和48 h均以B组无机盐组合MgSO4+MnSO4+ NaCl组合的菌体量最大、培养效果最好,故选择了B组合为最佳的无机盐组合。
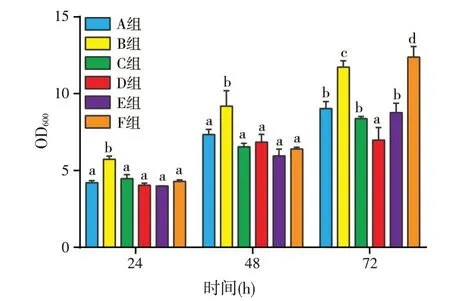
图6 不同无机盐发酵对菌体生长的影响
培养基中复合碳源、复合氮源和复合无机盐含量对拮抗菌生长的影响正交试验结果见表2。由表2可知,复合氮源含量为影响CN101 生长的主要因素,复合碳源含量为次要因素,复合无机盐含量对CN101的生长影响最小。

表2 正交试验结果统计
发酵培养基成分优化获得的较优培养基配方(A组)与正交试验获得的培养基较优培养基配方(B组)进行比较,发现其无机盐水平不同,以此为依据设计的验证试验结果如图7所示:24 h和48 h时两处理组间差异均不显著,即较高水平的无机盐含量对拮抗菌的生物量影响较小;该结果也同时验证了本研究正交试验中获得的培养基成分对拮抗菌生物量的影响作用的结果:复合氮源为主要影响因子,复合碳源次之,复合无机盐的影响最小。
因此,考虑到节约生产成本,本试验最终确定的培养基配方为:乳糖15 g、蔗糖5 g、蛋白胨2.5 g、豆饼粉5 g、MgSO40.25 g、MnSO40.25 g、NaCl 0.25 g、蒸馏水1 000 ml。
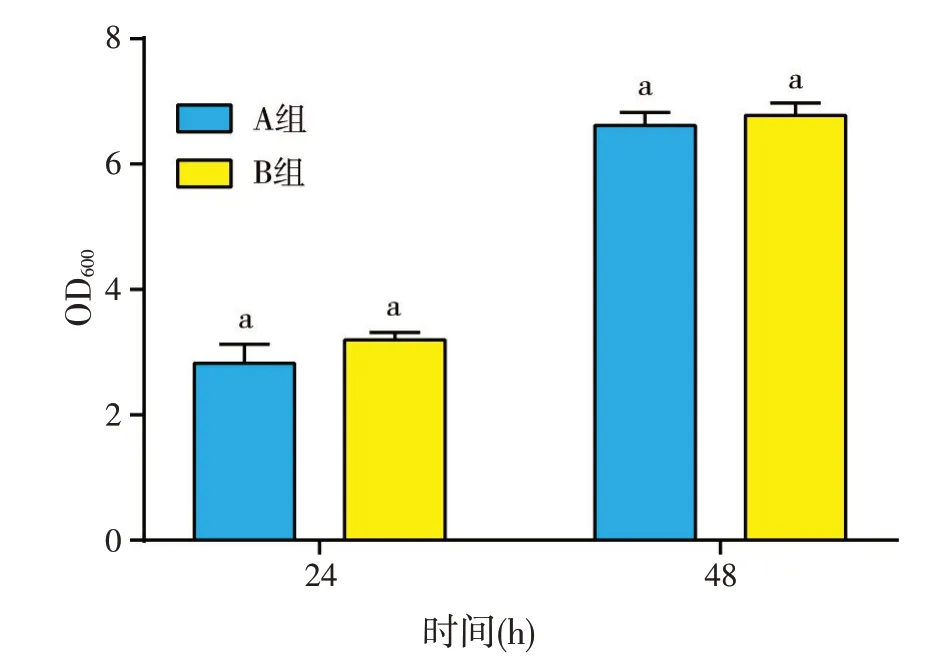
图7 CN101正交试验结果验证
2.2 发酵条件的优化
温度试验结果(图8)表明,拮抗菌在15~35 ℃范围内均可生长,以25 ℃生长最快,其次是20 ℃。因此,拮抗菌的最适生长温度为25 ℃。
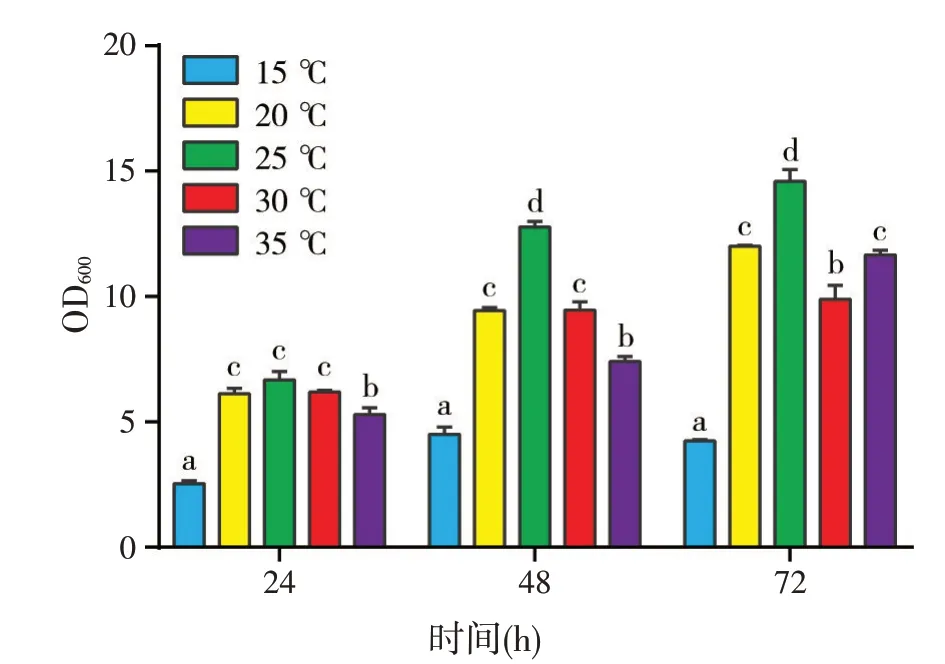
图8 不同发酵温度对菌体生长的影响
拮抗菌在pH值6~9范围内生长状况良好(图9),虽然不同初始pH值条件下拮抗菌数量差异达到显著水平,但不同pH 值处理的OD 值差异并不大;综合考虑拮抗菌将来应用的环境条件和驯化因素,为使拮抗菌更好的适应海参生长环境,发挥生长潜能,初始pH值以7.5为最佳。
不同的接种量对拮抗菌培养具有一定的影响(图10),虽然培养至48 h和72 h时不同接种量处理的拮抗菌数量差异达到显著水平,但不同接种量处理的OD 值差异并不大,因此为节约生产成本,以1%的接种量为宜。
不同的装瓶量对拮抗菌生长的影响极大(图11),装瓶量越高越不利于拮抗菌的生长繁殖,说明该菌株是一株好氧菌,培养过程中应充分保障氧气的供给量,摇瓶振荡培养时培养基的装液量应以10%~20%为宜。
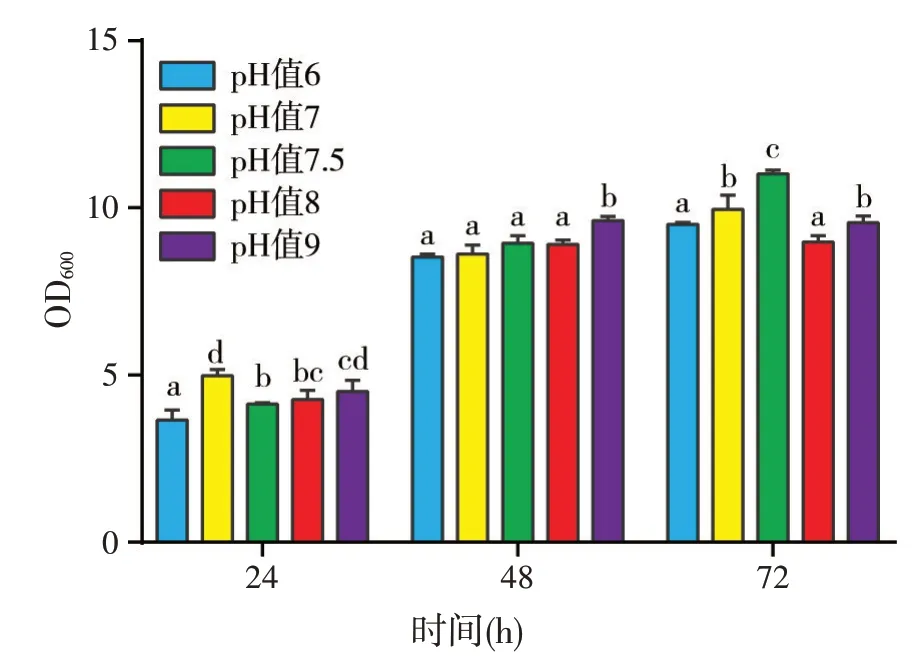
图9 不同初始pH值发酵对菌体生长的影响

图10 不同接种量发酵对菌体生长的影响

图11 不同装瓶量发酵对菌体生长的影响
综上所述,本试验最终确定的发酵条件为接种量1%、装瓶量10%~20%、温度25 ℃、培养基初始pH 值为7.5。
将发酵条件优化前(OD600约为5)、优化后(OD600约为20~30)的结果进行对比,拮抗菌CN101 的菌体量提高了约4~6倍。
3 讨论
目前微生物饲料在禽类和反刍类动物饲料中应用较广泛,效果显著[15],以拮抗菌、益生菌等有益微生物开发的微生物饲料添加剂应用于刺参养殖呈现出良好的应用前景。
益生菌促进刺参生长、提高刺参抗病性一般是通过抑制病原菌、调节肠道内微生态环境、增强消化酶、蛋白酶、淀粉酶活性等改善健康状况、刺激胃部发育和促进酶分泌等机制发挥作用[16-17]。国内外关于刺参养殖的拮抗菌研究,主要包括微生物发酵饲料[18]、免疫增强剂[6]、微生态制剂[7]等,大多数拮抗菌来源于刺参肠道内部或海洋细菌,这些拮抗菌对海水环境具有良好的适应性。
本研究通过单因素控制变量法和正交试验,对分离自刺参养殖池底泥的拮抗菌株CN101 的发酵条件进行优化,确定了最佳的培养基配方为乳糖15 g、蔗糖5 g、蛋白胨2.5 g、豆饼粉5 g、MgSO40.25 g、MnSO40.25 g、NaCl 0.25 g。这与张璐等[14]、董春光[19]的研究不一致,可能是不同菌株对营养要素、营养水平的需求不同所致。同时,本研究结果表明无机氮源不利于CN101菌株的生长,这与曹雪梅等[20]研究的海洋细菌GM-1-1菌株相似。拮抗菌CN101在20~30 ℃、pH值7~9范围内生长良好,而海参生长的最适pH值在7.5~8.5 之间、适宜温度范围为15~23 ℃[21],说明海参生长的温度、pH 值环境也是拮抗菌CN101 较适宜生长的条件,且拮抗菌CN101适宜生长的温度、pH值环境条件范围更宽;拮抗菌能够在海参养殖环境中较好的生长繁殖,这有利于拮抗菌发挥其生防潜能。不同细菌菌株适宜的发酵条件不同[22-23],研究不同有益细菌的最佳发酵条件是开发相应细菌菌剂的基础。拮抗菌CN101 的最佳发酵条件为接种量1%、装瓶量10%~20%、温度25 ℃、初始pH值为7.5,该研究结果为拮抗菌CN101发酵培养提供了科学依据,也为利用CN101菌株研发微生物饲料添加剂奠定了基础。
4 结论
①拮抗菌CN101的最佳发酵培养基配方为乳糖15 g、蔗糖5 g、蛋白胨5 g、豆饼粉10 g、MgSO40.25 g、MnSO40.25 g、NaCl 0.25 g、蒸馏水1 000 ml。
②拮抗菌CN101的最佳发酵条件为接种量1%、装瓶量10%~20%、温度25 ℃、初始pH值为7.5。

