一株同时降解玉米赤霉烯酮和黄曲霉毒素B1的谷氨酸棒状杆菌及其降解特性研究
■唐 彧 张琼琼 郭永鹏 郑雅文 赵丽红
(动物营养学国家重点实验室中国农业大学动物科技学院,北京100193)
霉菌毒素是霉菌生长过程中所产生的有毒次级 代谢产物,其具有致突变性、致畸性和细胞毒性,对动物和人类健康有极大危害,并可造成严重的经济损失。其中,危害较大的两种霉菌毒素为黄曲霉毒素B1(Aflatoxin B1,AFB1)与玉米赤霉烯酮(Zearalenone,ZEN)。黄曲霉毒素毒性最强且分布最广,具有高致病性和较强致癌性,可直接或间接影响人的食品安全。ZEN具有较强的生殖毒性,可造成动物急慢性中毒,并通过食物链严重威胁人类身体健康。研发粮食与饲料中霉菌毒素的脱毒技术,对于改善动物生产性能、提高动物产品品质、保障食品安全有着重要意义[1-3]。
当前,对于霉菌毒素的脱毒方法有物理、化学及生物法。其中物理法包括原料稀释法、高温处理法等;化学法有碱处理、氧化处理等;生物法有酶降解法和微生物脱毒法。物理与化学法对霉菌毒素的降解效率较低且可能降低饲料营养价值,生物脱毒法可生成无毒或低毒降解产物,且多为专一性降解,不会破坏饲料中其他营养物质,是霉菌毒素脱毒的重要方法[4-5]。国内外关于霉菌毒素的生物降解已有诸多研究。Samuel 等[6]分离出一株假单胞菌(Pseudomonas),通过对其降解能力及降解产物的研究,发现该菌株在液体培养基中对0.2 μg/ml 的ZEN 降解率达到90%以上,且其降解产物无毒。Cho等[7]分离出一株枯草芽孢杆菌(Bacillus subtilis),其在液体培养基中对1 mg/kg ZEN的降解率高达99%,在固体培养基中对0.25 mg/kg ZEN 的降解率可达95%。Harkai 等[8]对124 株链霉菌(Streptomyces)降解AFB1和ZEN 的能力进行了研究,发现其中1 株链霉菌对AFB1降解率为88%,2 株链霉菌对ZEN降解率几乎可达100%。
现今已知的有效降解菌株多用于降解单一毒素,关于同时降解多种霉菌毒素的菌株鲜有报道。但实际上谷物中往往是多种霉菌毒素联合污染,其联合污染使得霉菌毒素间可能出现联合毒性作用,从而导致毒性更强[9-10]。因此,相比只降解单一毒素的菌株,筛选可同时降解多种霉菌毒素的菌株将具有更好的应用前景。
1 材料与方法
1.1 材料
1.1.1 样品
采集自北京市郊的土壤、鸡肠道食糜、驴肠道食糜等多个来源的混合样本。
1.1.2 主要试剂和仪器
玉米赤霉烯酮与黄曲霉毒素B1、0.22 μm滤膜(Millipore)、细菌基因组DNA小量提取试剂盒(庄盟生物)、琼脂糖凝胶DNA回收试剂盒(Tiangen)、革兰氏染液试剂盒(Aobox)、PCR仪T-100(Bio-Rad)、高效液相色谱RF-20A(Shimadeu),凝胶成像分析系统Universal HoodⅡ(Bio-Rad),高速冷冻离心机3K15(Sigma),电泳系统Powerpac(Bio-Rad),pH 计seven Compact(Meetlertoledo),恒温震荡培养箱HZQ-X100(苏州培英)。
1.1.3 培养基
LB培养基:胰蛋白胨10.0 g,酵母提取物5.0 g,氯化钠10.0 g,蒸馏水1 000 ml,调pH 值至7.0。121 ℃下蒸汽灭菌20 min。固体培养基中添加琼脂粉15 g。
1.2 菌株的富集、分离与筛选
称取2.5 g 样品放入装有25 ml PBS 溶液的三角瓶中,摇瓶后静置。取1 ml上清液,加入9 ml PBS,梯度稀释至1×10-7。每个梯度各取100 μl 涂布于LB 固体培养基上,同时设置3 个平行,置于37 ℃恒温培养箱中培养48 h后分离单株并编号。
将分离所得菌株分别接种于5 ml LB液体培养基中,37 ℃、180 r/min 培养24 h,得到各菌株发酵液。取分离后不同菌株的发酵液各980 μl,分别加入20 μl ZEN 或AFB1储备液,使ZEN、AFB1终浓度分别为2、0.4 μg/ml,置于37 ℃、180 r/min 恒温摇床中振荡培养,反应72 h。同时以未接种且含有相同ZEN或AFB1浓度的LB培养基为对照。
1.3 菌株对ZEN与AFB1降解率测定
取待测样品,加入等体积甲醇,震荡混合后静置以充分浸提。于4 ℃、12 000 r/min条件下离心3 min,取其上清液过0.22 μm 滤膜,采用高效液相色谱(HPLC)检测。对照组做同样处理。
检测条件:采用Eclipse Plus C18 液相色谱柱(150 mm×4.6 mm,5 μm,Agilent);检测AFB1时,流动相为45%甲醇+55%水(V/V),检测器的激发波长为360 nm,发射波长为440 nm;检测ZEN 时,流动相采用46%乙腈+46%水+8%甲醇(V/V),检测器的激发波长为274 nm,发射波长为440 nm;检测二者时,流速均为1.0 ml/min,进样量均为20 μl,柱温均为35 ℃。
采用下列公式计算ZEN和AFB1降解率:

所有数据均重复三次取平均值,并以“平均值±标准误差”绘图。
1.4 菌株鉴定
1.4.1 形态学鉴定
采用平板划线法将降解菌接种于LB 固体培养基,37 ℃培养48 h后观察菌落形态;将分离纯化的菌株406进行革兰氏染色,于光学显微镜下观察菌体形态,对菌株进行初步鉴定。
1.4.2 分子生物学鉴定
采用细菌DNA提取试剂盒提取406菌株DNA,以此为模板扩增其16S rDNA序列。采用引物为通用引物,上游引物为27F(5'-AGAGTTTGATCCTGGCTCAG-3'),下游引物为1492R(5'-GGTTACCTTGTTACGACTT-3'),50 μl反应体系中含有模板1 μl,引物27F和1492R(10 μmol/l)各2 μl,2×Premix-Taq 25 μl,ddH2O 20 μl。PCR 反应条件:95 ℃预变性5 min;95 ℃变形30 s,53 ℃复性30 s,72 ℃延伸90 s,30个循环后于72 ℃延伸10 min。通过1%(M/V)琼脂糖凝胶电泳检测扩增结果。利用凝胶成像分析系统Universal HoodⅡ检测电泳结果,采用无菌手术刀切割目标条带,通过琼脂糖凝胶DNA回收试剂盒进行目的片段的回收,并送至上海生工生物工程技术有限公司测序。将测序结果提交至GenBank核酸序列数据库中,利用BLAST程序搜索同源序列,以Clustal X软件进行多重序列比对,再用MEGA 4.0软件构建系统发育树[11-12]。
1.5 菌株406中ZEN与AFB1降解物质的定位、定性
1.5.1 发酵液、上清液及菌悬液的制备
将菌株406 于LB 液体培养基中37 ℃、180 r/min培养24 h,得到发酵液。取发酵液10 ml 于4 ℃、12 000 r/min条件下离心20 min,上清液过0.22 μm滤膜,获得无细胞上清液,于4 ℃保存备用;下层菌体细胞用PBS 溶液重新悬浮,4 ℃、12 000 r/min 离心10 min,重复3次,冲洗3次后用PBS溶液重新悬浮至10 ml,振荡混匀,即为菌悬液。
1.5.2 降解ZEN或AFB1的物质来源定位
将上述所得的发酵液、上清液及菌悬液各980 μl,向其中分别加入20 μl霉菌毒素,使ZEN、AFB1终浓度分别为2、0.4 μg/ml。将反应体系置于37 ℃、180 r/min恒温摇床上孵育,以上试验均设置3 个重复,分别于12、24、36、48、72 h和96 h取样,用高效液相色谱检测各毒素残留量,以推测降解ZEN 与AFB1的活性物质位于发酵液、上清液还是菌悬液。
1.5.3 降解物质的定性
根据上述试验结果,取10 ml发酵上清液,分别给予以下处理:95 ℃水浴10 min 后冷却至室温;煮沸10 min后冷却至室温;加入0.1 g胰蛋白酶(即10 mg/ml胰蛋白酶)充分溶解并混匀;加入十二烷基硫酸钠0.5 g(即5% SDS)充分溶解并混匀。取处理后的样品分别与ZEN 或AFB1共培养,每个样品做3 个重复,于37 ℃、180 r/min 条件下进行降解试验,设置空白对照,72 h后用高效液相色谱检测各毒素残留量。
1.6 分离所得菌株对ZEN和AFB1的降解条件优化
1.6.1 温度对406降解菌降解效果影响
向980 μl 上清液中分别加入20 μl 霉菌毒素,使ZEN、AFB1终浓度分别为2、0.4 μg/ml;以pH值与上清液相同的LB 培养基为空白对照,分别在37、47、57、67 ℃和77 ℃的水浴锅中孵育,72 h 后取样,采用HPLC检测霉菌毒素残留量。
1.6.2 pH值对406降解菌降解效果影响
以5 mol/l NaOH 或5 mol/l HCl 分别调节上清液的初始pH值为5.0、6.0、7.0、8.0、9.0,向980 μl调节pH值后的上清液中加入20 μl霉菌毒素,使ZEN、AFB1终浓度分别为2、0.4 μg/ml;以相同pH值的LB培养基为空白对照,置于37 ℃,180 r/min恒温摇床中孵育,72 h后取样,采用HPLC检测霉菌毒素的残留量。
2 结果
2.1 ZEN与AFB1降解菌的筛选鉴定
从多个不同来源的混合样本中经分离纯化获得279 株不同菌株,筛选后获得9 株可同时降解ZEN 和AFB1的菌株,其中菌株406对两种霉菌毒素的降解能力最强,其发酵液对ZEN 和AFB1的降解率分别为50%和54%,选择此菌株进行进一步研究。

图1 筛选所得的9株菌株对ZEN和AFB1的降解率
2.2 菌株鉴定
2.2.1 形态学鉴定
在LB 固体培养基上菌株的生长情况如图2a 所示,菌落呈淡黄色圆形,直径1 mm左右,中间隆起,表面湿润光滑有光泽,边缘整齐且成半透明状。通过革兰氏染色在光学显微镜下观察,菌体形态如图2b 所示,该菌株为革兰氏阳性菌,形态呈短杆状,有时微弯曲,两端钝圆,不分枝,单个或成八字排列。
2.2.2 分子生物学鉴定
经PCR 扩增后,菌株406 的16S rDNA 片段长度约为1 177 bp,在GenBank 的序列登录号/注册号为lcl|Query_166539,经过BLAST比对发现该菌株与谷氨酸棒状杆菌的同源性达到99%。使用Clustal X(版本号)与MEGA-X(版本号)构建系统发育树,结果如图3所示。结合形态学特征与BLAST比对,可以确定菌株406属于谷氨酸棒状杆菌(Corynebacterium glutamate)。
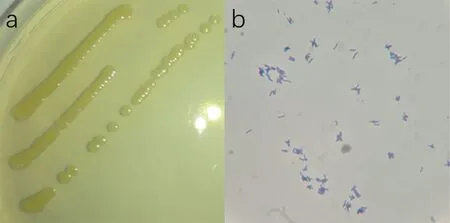
图2 菌株形态图
2.3 谷氨酸棒状杆菌406降解ZEN与AFB1的活性物质定位
谷氨酸棒状杆菌406 中发酵液、上清液及菌悬液对ZEN 或AFB1的降解率随时间变化情况如图4、图5 所示。菌株406 的发酵液、上清液及菌悬液分别与ZEN 共培养96 h 后,对该毒素的降解率分别为54%、50%、13%(图4)。菌株406 的发酵液、上清液及菌悬液分别与AFB1共培养96 h 后,对该毒素的降解率分别为52%、58%、16%(图5)。由此可推断菌株406 降解ZEN 与AFB1的活性物质存在于上清液,表明菌株406 降解ZEN 和AFB1不是依赖菌体的吸附作用,而是由胞外的活性物质主导的生物降解作用。

图3 以16S rDNA序列为基础的降解菌406系统发育树
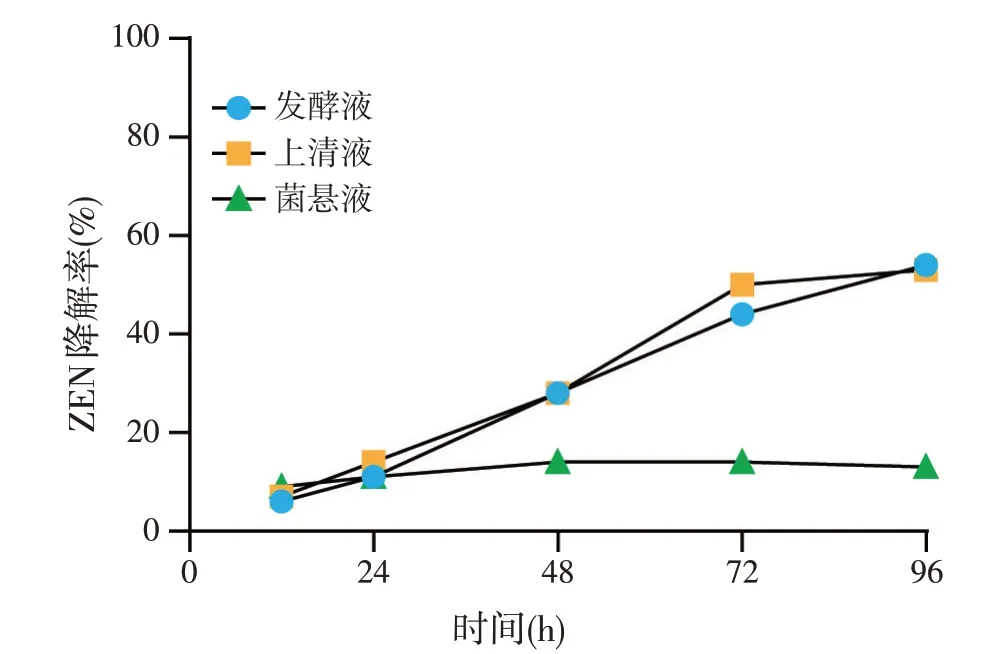
图4 谷氨酸棒状杆菌406菌液组分对ZEN降解率的影响

图5 谷氨酸棒状杆菌406菌液组分对AFB1降解率的影响
2.4 谷氨酸棒状杆菌406降解ZEN与AFB1的胞外物质定性
为了进一步判断谷氨酸棒状杆菌406 降解ZEN与AFB1的胞外物质的性质,给予菌株406上清液四种不同的处理,并考察处理后的上清液对ZEN 与AFB1的降解效果。经过高效液相色谱法检测发现(图6),经95 ℃水浴10 min 和煮沸10 min 处理的上清液对ZEN和AFB1的降解能力小幅提高;经5% SDS处理的上清液对ZEN 和AFB1的降解能力显著降低;经胰蛋白酶处理的上清液对ZEN和AFB1的降解能力影响不明显。热处理通常可以破坏DNA、维生素和大部分蛋白(酶)的空间结构,但菌株406上清液中的降解活性物质对热的耐受能力较强,较短时间热处理并未对其造成明显影响;SDS 作为变性剂,能破坏蛋白的空间结构,经5% SDS 处理,上清液对ZEN 和AFB1的降解能力显著降低,因此可以初步推断菌株406分泌的降解活性物质是蛋白类。
2.5 谷氨酸棒状杆菌406降解ZEN与AFB1的温度和pH值条件
2.5.1 pH值对谷氨酸棒状杆菌406降解效果的影响
如图所示(图7),谷氨酸棒状杆菌406的上清液在37~77 ℃之间对ZEN与AFB1均有较好降解效果,降解率均为40%以上;该菌株的最佳降解温度为67 ℃,此时其对ZEN与AFB1的降解率分别为89%、85%。
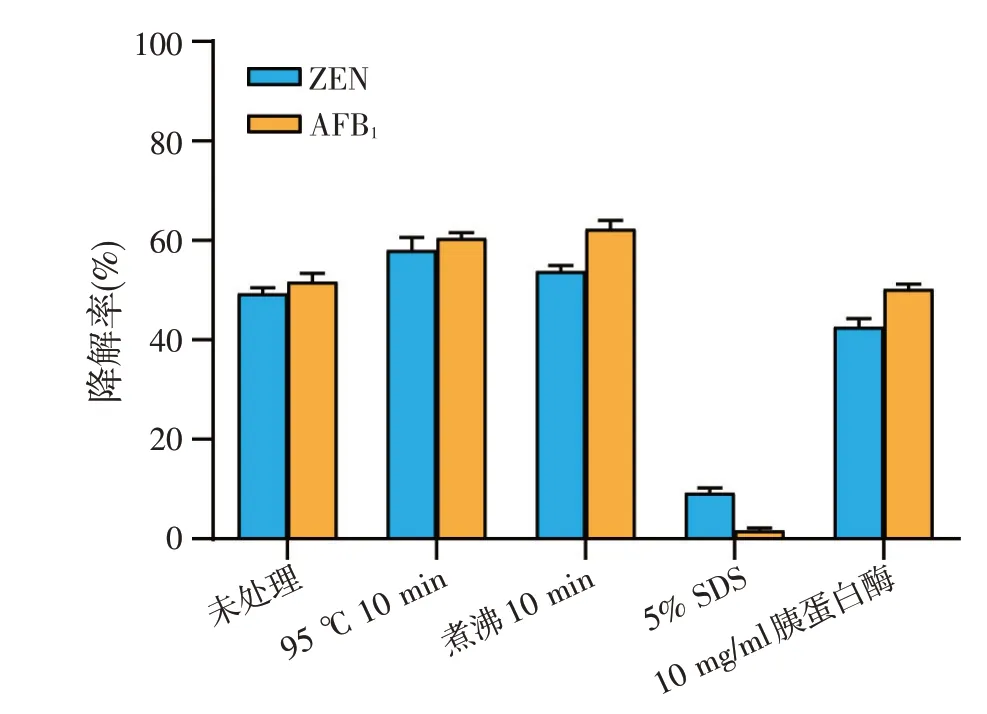
图6 热、SDS、胰蛋白酶处理对谷氨酸棒状杆菌406上清液降解ZEN和AFB1的影响
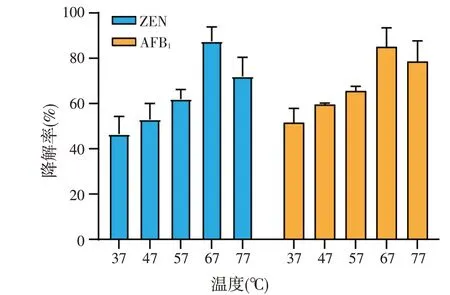
图7 温度对谷氨酸棒状杆菌406上清液降解ZEN和AFB1的影响
2.5.2 pH 值对谷氨酸棒状杆菌406 菌株降解毒素效果的影响(见图8)
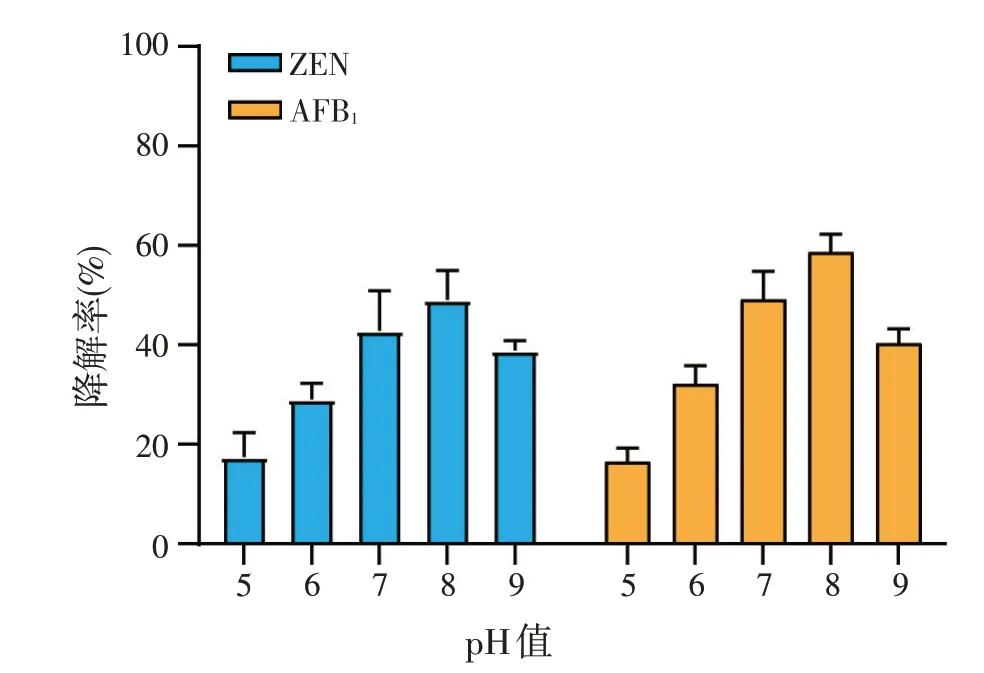
图8 pH值对谷氨酸棒状杆菌406上清液降解率ZEN和AFB1的影响
由图8可知,该菌株上清液中的降解活性物质在pH 值5~9 范围内均可发挥降解作用,在pH 值7~8 时的降解效果最好,此时ZEN 与AFB1的降解率分别为51%、58%;随着pH 值升高或降低,降解率也逐渐降低,但是pH值升高对降解率的影响小于pH值降低对降解率的影响,由此可推测该菌适宜在中性或微碱性环境中生长。
3 讨论
霉菌毒素分布广、毒性强、物理化学方法去毒效果不理想已成为保障饲料安全的限制因素,因此筛选和发掘可高效降解霉菌毒素的微生物已成为当今研究热点。但是目前已报道的菌株多致力于降解单一毒素,在应对霉菌毒素联合污染时有一定局限性。本研究筛选出一株可同时降解ZEN和AFB1两种霉菌毒素的菌株406,经过16S rDNA鉴定确定为谷氨酸棒状杆菌(Corynebacterium glutamate),这是首次发现谷氨酸棒状杆菌可同时降解ZEN和AFB1。谷氨酸棒状杆菌已应用于微生物发酵领域,其可利用葡萄糖、乙酸等为唯一碳源,产生氨基酸、有机酸、维生素等[13],也可用于降解有毒酚类芳香族化合物(阿魏酸、香草醛、苯酚、间苯二酚等)[14]。ZEN 中含有一个双酚基团,AFB1是一种多芳香族化合物,谷氨酸棒状杆菌406降解这两种毒素的方式很可能与降解酚类芳香族化合物的方式相似。
将毒素分别与发酵液、菌悬液、上清液共培养,发现上清液即胞外物质对ZEN和AFB1表现出较强的降解活性,且其降解能力强于菌悬液和发酵液。在Shu等[15]筛选到的维氏杆菌DY3108、Guan 等[17]筛选到的橙色黏球菌及Sangare 等[16]筛选到的铜绿假单胞菌N17-1中。谷氨酸棒状杆菌406对两种霉菌毒素的作用是由胞外活性物质发挥的降解作用,而不是基于细胞壁的吸附作用。
将谷氨酸棒状杆菌406 的上清液于95 ℃水浴10 min 或煮沸10 min 后,发现其对ZEN 和AFB1的降解能力有所提高,表明谷氨酸棒状杆菌406有较好的热稳定性,这使该菌株在实际生产中具有潜在的应用价值。在其他AFB1降解菌中也观察到了类似现象,Sangare 等[16]曾报道对铜绿假单胞菌N17-1 的无细胞上清液进行沸水浴10 min处理,在热活化作用的刺激下其对AFB1的降解活性提高了3.49%。Wang 等[18]发现煮沸10 min后镰刀菌WCQ3361的代谢产物仍保持99.4% AFB1降解活性。经SDS处理后,上清液对两种霉菌毒素的降解能力几乎完全被破坏,表明谷氨酸棒状杆菌406 的胞外物质对SDS 处理敏感,在橙色黏球菌ANSM068、维氏杆菌DY3108等其他黄曲霉毒素降解菌中也发现了类似结果[15,17],Guan 等[17]推测有蛋白质或酶参与了AFB1的生物降解,并通过色谱法、离子交换柱层析等方法证实其降解活性组分为蛋白质。由此推测可能有蛋白类或酶类物质参与两种毒素的降解。但是经胰蛋白酶处理,谷氨酸棒状杆菌406的上清液对两种毒素的降解能力仅略有降低,这与上述推测的有蛋白类或酶类物质参与反应不符。Cuccioloni 等[19]的研究通过分析AFB1与胰蛋白酶之间相互作用的动力学和热力学参数,发现AFB1可与胰蛋白酶发生可逆结合,从而使胰蛋白酶催化反应的能力降低。初步推测由于AFB1与胰蛋白酶进行结合,导致胰蛋白酶催化反应能力降低,从而限制胰蛋白酶与菌株406上清液中活性物质作用,对其降解能力没有显著性影响。
通过对降解条件的优化确定谷氨酸棒状杆菌406的上清液对ZEN 与AFB1的最佳降解pH 值为8、最佳降解温度为67 ℃。酶促反应体系中,酶在最适pH值或最适温度下活性最高,菌株406的上清液在对ZEN和AFB1的降解中表现出这一特性,结合SDS 对上清液的处理结果,进一步推测降解活性物质为一种细菌所产胞外酶。此外,值得注意的是谷氨酸棒状杆菌406 对两种霉菌毒素在37 ℃仍具有50%以上的降解率,可用于实际生产中两种毒素污染饲料和粮食的生物脱毒。
4 结论
目前,有关于生物降解多种霉菌毒素的研究还很少,本研究筛选出的谷氨酸棒状杆菌406可同时降解ZEN 和AFB1两种霉菌毒素,为食品和饲料中两种毒素的生物降解提供了新的菌种资源。

