糖醇的HPLC-ELSD法测定及其热稳定性研究
牛立沙, 张连富, 孙清瑞, 李 婧
(江南大学 食品学院,江苏 无锡 214122)
关键字:糖醇;HPLC-ELSD;定量检测;热稳定性
近年来随着流行性肥胖和糖尿病发病率的增加,人们开始关注摄入高热量甜味剂带来的健康问题,对低热食品的需求量不断增加。糖醇作为甜味剂替代物加入食品中,可以减少热量的摄入。食品工业为迎合消费者的需求,开始生产以糖醇作为甜味剂替代物的低热食品[1-2]。
目前常见的糖醇有赤藓糖醇、木糖醇、山梨醇、麦芽糖醇、甘露醇等[3]。无糖食品是指用糖替代物代替蔗糖和淀粉糖的一类食品,其中,糖醇(木糖醇、山梨糖醇、麦芽糖醇、甘露糖醇等)就是一种糖替代物[4]。糖醇作为低热甜味剂可用于焙烤食品(无糖饼干、无糖糕点、无糖面包、无糖月饼等)中。因此,糖醇的定量测定及热稳定性研究,对无糖食品行业的发展具有十分重要的意义。
目前,检测食品中糖醇的方法有高效液相色谱-示差折光检测器法[5-16]、高效液相-脉冲检测器法[17]、毛细管电泳法[18-19]、气相色谱法[20-22]、气质联用法[23]、液质联用法[24-26]、高效液相色谱-蒸发光散射检测器法[27-36]等。示差折光检测器是通用型检测器但对外部环境要求较高,且不能用于梯度洗脱;脉冲检测器法检测糖醇虽然灵敏、快速,但糖醇会在电极表面发生氧化还原反应,影响测定准确性;毛细管电泳法成本低、操作较为简便,但重现性差;气相色谱法检测前需对糖醇进行衍生化,样品处理复杂;质谱检测器检测糖醇,虽然灵敏度高,但样品前处理过程复杂;而蒸发光散射检测器法具有样品处理简单、基线稳定、检出限低、可用于梯度洗脱等优点。采用高效液相-蒸发光散射检测器同时测定4种糖醇(赤藓糖醇、木糖醇、山梨醇、麦芽糖醇)及对其进行热稳定性研究,尚未见文献报道。
1 仪器及试剂
1.1 试剂
赤藓糖醇、木糖醇、山梨醇、麦芽糖醇(纯度99%):美国Sigma公司产品;乙腈 (ACN):美国Tedia公司产品;三氟乙酸:国药集团化学试剂有限公司产品;超纯水:实验室自制。
1.2 仪器
Waters 600E高效液相色谱、Waters 2424蒸发光散射检测器:美国Waters公司产品;Tskgel Amide80(2.0 mm×150 mm,3 μm):东曹公司产品;ME204E电子天平:梅特勒-托利多仪器(上海)有限公司产品;KQ-500DE超声振荡器:昆山市超声仪有限公司产品;Smart-S30超纯水机:上海和泰仪器有限公司产品;台式干燥箱:上海跃进医疗器械有限公司产品。
2 方 法
2.1 色谱条件
色谱柱:Amide 80(2.0 mm ×150 mm,3 μm);流量:0.2 mL/min;柱温:33 ℃;进样量:20 μL。 流动相梯度条件如表1所示。

表1 梯度洗脱程序Table 1 Gradient elution program
2.2 检测器ELSD条件
漂移管温度:50℃;载气流量:2.5 L/min。
2.3 标准溶液的配制
精确称取赤藓糖醇、木糖醇、山梨醇、麦芽糖醇各0.250 0 g于小烧杯中,加超纯水溶解,转移至1 000 mL容量瓶中,定容,用0.22 μm微孔滤膜过滤用作糖醇的单标。
精确称取赤藓糖醇、木糖醇、山梨醇、麦芽糖醇各0.500 0 g于同一小烧杯中,加超纯水溶解,转移至1 000 mL容量瓶中,定容,制成1.0 mg/mL的混合糖醇储备液。
2.4 样品热处理
精确称取20组赤藓糖醇、木糖醇、山梨醇、麦芽糖醇各0.100 0 g的混合样品,置于玻璃管中。在180、190、200、210 ℃ 4 种温度下,分别加热 10、20、30、40、50 min;将加热后的样品用乙腈-水(V(乙醇)∶V(水)=75∶25)溶剂溶解,转移至 10 mL 的容量瓶中定容,用0.22 μm微孔滤膜过滤,滤液待液相分析。
3 结果与讨论
3.1 色谱条件的选择
选择乙腈和水作流动相。试验发现,流动相中乙腈比例上升时,峰形、分离度比较好,但保留时间变大后组分峰宽加大。在保证峰形、分离度较好的情况下,适当减少乙腈比例,可以缩短分离时间,达到高效分析的目的[33]。当采用表1所示的流动梯度进行洗脱时,4种糖醇的分离效果较好,如图1所示。
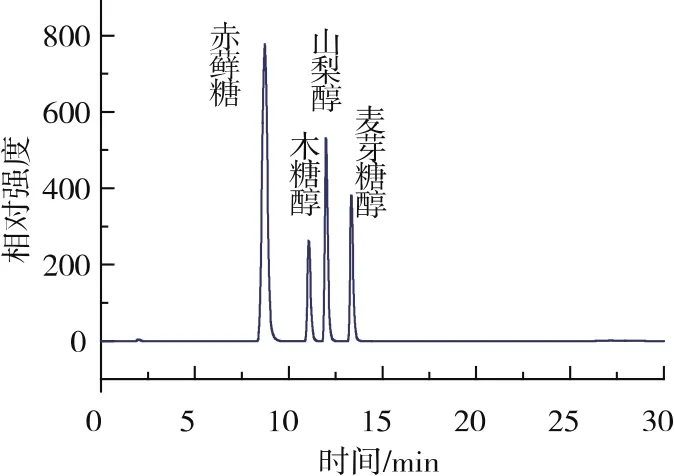
图1 糖醇分离色谱图Fig.1 Separation chromatogram of sugar alcohols
3.2 检测器条件的选择
漂移管温度和载气流速的选择会影响检测器(ELSD)的信噪比。漂移管温度升高时,流动相蒸发比例增加,信噪比上升;但温度过高,会引起部分糖醇发生汽化,导致信号响应值变小[33]。当漂移管温度为50℃,载气流速为2.5 L/min时,信噪比较佳。
3.3 柱温的选择
柱温越高,出峰时间越早,分离度越高,峰形越好,如图2所示,但温度越高,柱子的寿命越短。综合考虑,当柱子的温度为33℃时较好。
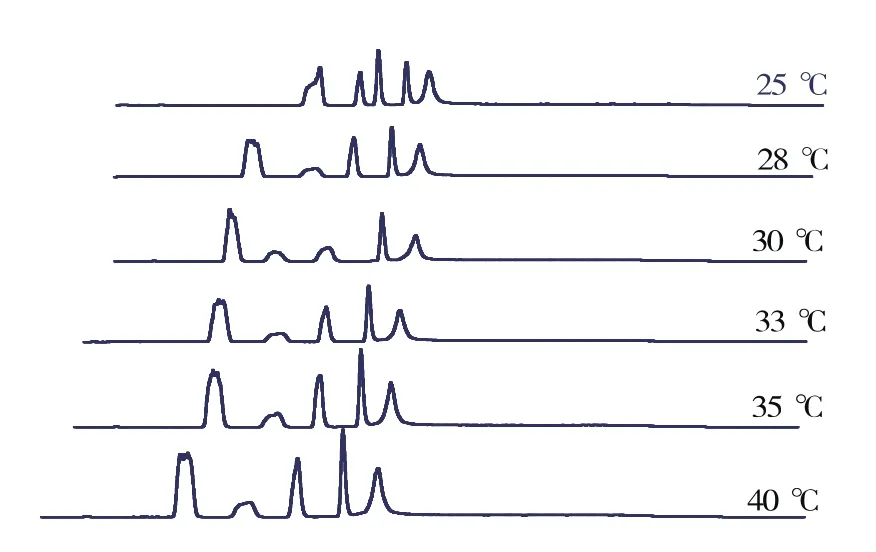
图2 柱温优化图Fig.2 Optimization of column temperature
3.4 溶剂体系的选择
当溶剂体系为水、乙腈体积分数50%、60%、75%,它们对峰形的影响较大,如图3所示。从峰形上考虑,当乙腈体积分数为75%时较佳。

图3 溶剂体系优化图Fig.3 Optimization of solvent system
3.5 线性回归方程、相关系数、检出限和精密度
将混合糖醇标准储备液质量浓度依次稀释为0.5、0.25、0.125、0.06、0.03 mg/mL,按照优化的色谱条件进样测定,根据测得的峰面积的对数与对应的糖醇质量的对数进行线性回归和相关性系数的计算;以进样量20 μL基线噪音的10倍为最低定量限计算;以糖醇混合标准液0.25 mg/mL为测定样品,重复测定6次,用峰面积的大小计算精密度,用相对标准偏差RSD表示(见表2)。由表2知,赤藓糖醇、木糖醇、山梨醇、麦芽糖醇的线性范围为25~1000 μg/mL, 检 测 限 分 别 为 14.1、33.0、19.5、15.3 μg/mL,相关系数都在0.999以上,标准偏差都在3%以内,因此采用本方法测定的结果准确可靠。
3.6 糖醇的热稳定性
将热处理后的糖醇进行定量测定,热稳定性结果如图4所示。由图4可知,随着温度的升高和加热时间的增加,赤藓糖醇、木糖醇、山梨醇、麦芽糖醇的热稳定性均下降,这是因为糖醇在高温下发生了热分解。
在180℃下加热50 min后,赤藓糖醇、木糖醇、山梨醇、麦芽糖醇的残留率分别为80.3%、81.1%、79.5%、75.4%;在190℃下加热50 min后,赤藓糖醇、木糖醇、山梨醇、麦芽糖醇的残留率分别为75.3%、76.8%、70.8%、68.8%;在 200℃下加热 50 min后,赤藓糖醇、木糖醇、山梨醇、麦芽糖醇的残留率分别为71.0%、72.3%、64.8%、62.9%;在 210℃下加热50 min后,赤藓糖醇、木糖醇、山梨醇、麦芽糖醇的残留率分别为64.4%、66.3%、59.9%、57.3%。
在 180、190、200、210 ℃下,木糖醇和赤藓糖醇的稳定性较好,山梨醇次之,麦芽糖醇最差.因此,根据热稳定性的大小可优先选择赤藓糖醇和木糖醇作为糖替代物。
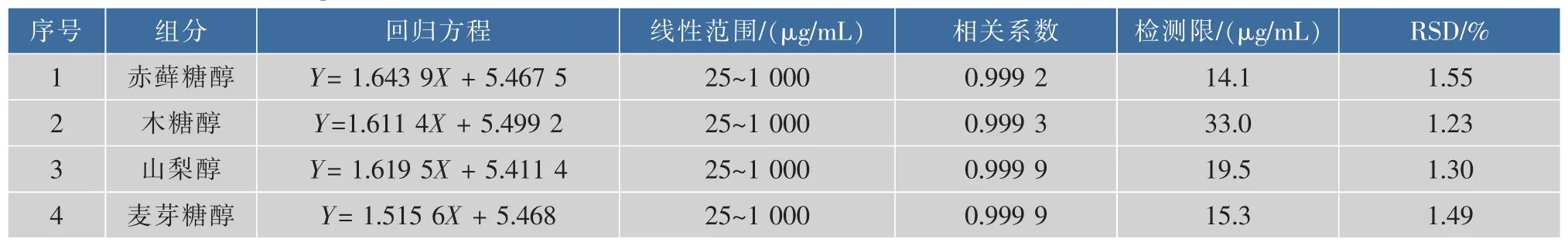
表2 糖醇的线性回归方程,相关系数,线性范围,定量检测限及相对标准偏差Table 2 Linear regression equation,correlation coefficient,linear range,quantitative detection limit and relative standard deviation of sugar alcohols
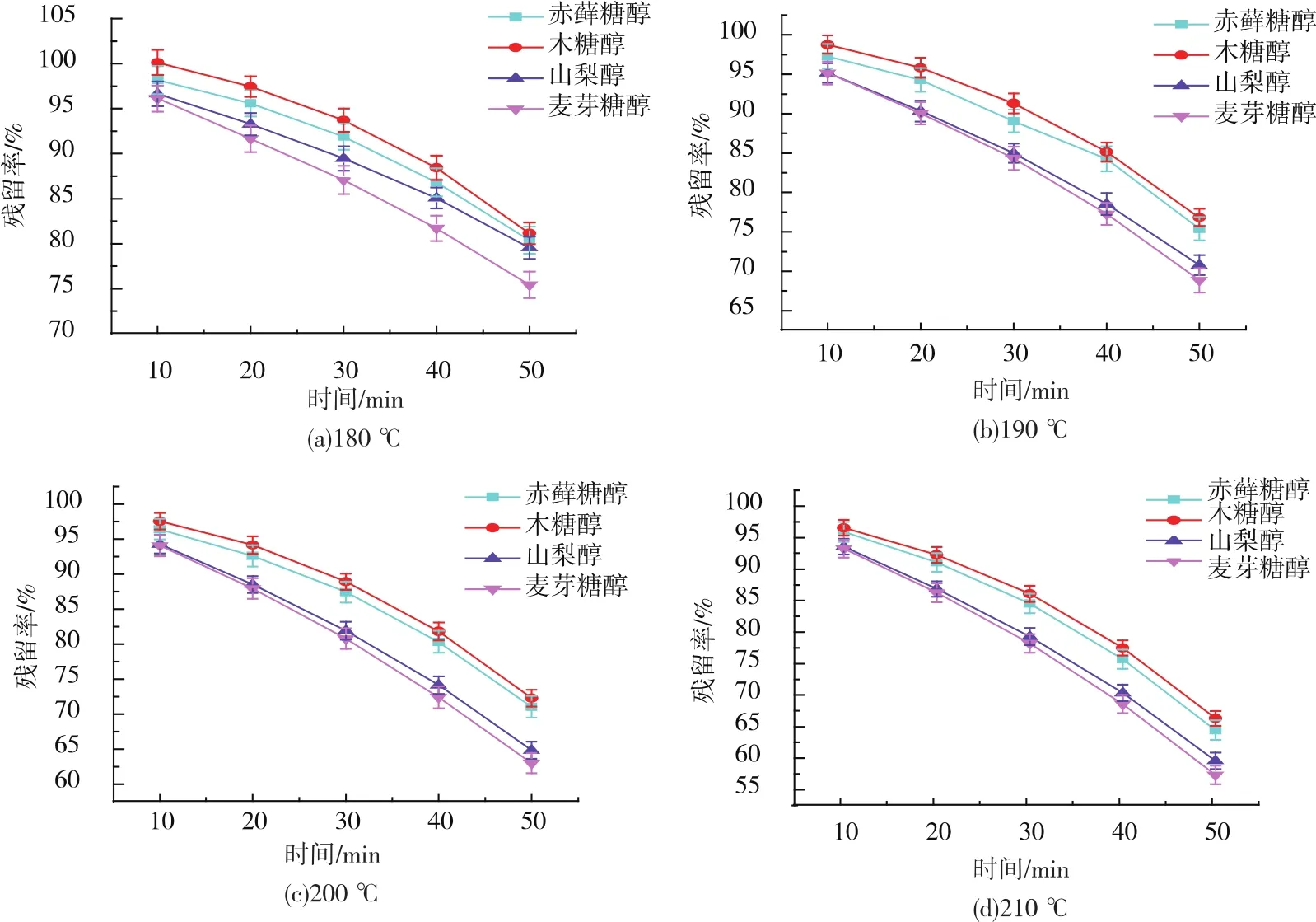
图4 糖醇的热稳定性Fig.4 Thermal stability of sugar alcohols
4 结语
采用高效液相-蒸发光散射检测器法同时测定了赤藓糖醇、木糖醇、山梨醇、麦芽糖醇。较佳的分析条件为:流动相梯度为0~10 min,流动相中乙腈体积分数90%~38%,10~20 min,乙腈体积分数保持38%,20~21 min, 乙腈体积分数 38%~90%,21~36 min,乙腈体积分数保持90%,柱温33℃,溶剂体系为V(水)∶V(乙腈)=25∶75,漂移管温度为 50 ℃,载气流速为2.5 L/min。此方法基线稳定、分离效果良好、结果准确、样品处理简单。
同时,对赤藓糖醇、木糖醇、山梨醇、麦芽糖醇进行了热稳定性研究。在180、190、200、210℃温度条件下,随着温度的升高和加热时间的增加,赤藓糖醇、木糖醇、山梨醇、麦芽糖醇的热稳定性均下降。木糖醇和赤藓糖醇的热稳定性较好,山梨醇次之,麦芽糖醇最差。这为糖醇在食品热加工中的应用提供一定的理论依据。
作者仅测定了单一糖醇的热稳定性,对其在食品体系中的热稳定性,有待深入研究。

