植物乳杆菌FB-T9抑制变异链球菌及其生物膜形成的研究
张秋香, 黄 银, 姚沛琳, 张 灏, 陈 卫
(江南大学 食品学院,江苏 无锡 214122)
龋病是由细菌引起的慢性感染性疾病,是一个连续矿化和脱矿化交替变化的过程[1]。牙齿表面的牙菌斑[2]是龋病发生的始动因子,它是一种典型的生物膜,是由细菌分泌的物质和细菌之间相互作用而形成的。变异链球菌(Streptococcus mutans)是公认的人类口腔中最主要的致龋细菌[3],它能高效利用蔗糖代谢产生乳酸,破坏牙体组织;并且具有很强的粘附能力和产多糖能力,会促进牙齿表面致龋性生物膜的进一步形成和发展[4]。此外12岁儿童恒牙龋齿的患病率为28.9%,而中年人龋齿患病率为88.1%,老年人龋齿患病率为98.4%,龋病总体状况不容乐观[5]。
现阶段防治儿童龋病的常见方法[6]有氟化物的应用、糖代替品的使用、养成正确的刷牙方法和频率、定期口腔保健和儿童龋病风险性评估等。但含氟牙膏摄入过量时会导致氟斑牙,糖替代品的使用要求父母具有较强的识别观念,机械去除牙菌斑的方法需考虑到儿童的接受性,定期口腔保健及风险评估对家庭经济状况的要求较高,因此寻找一种简单有效的龋病防治手段很有必要。近些年来,许多专家学者发现多种益生菌能通过抑制致病菌定殖、调节粘膜免疫等机制对牙周病、口臭以及口腔念珠菌病等口腔疾病的治疗发挥作用[7]。口腔益生菌能竞争性抑制口腔致病菌粘附和定殖,尤其可以减少唾液中变异链球菌的数量[8]。为降低龋病的发病率,适用于口腔健康的益生菌需要具备的首要生物特性是能够抑制变异链球菌的生长和生物膜的形成,并能在口腔黏膜和牙面粘附增殖[9],对溶菌酶也具有一定的耐受力[10]。
作者通过抑制致龋细菌生长和抑制致龋菌生物膜形成两个指标筛选得到性能良好的乳酸菌,探究待测菌株的菌株特性,及其对唾液包裹的羟磷灰石的粘附性和对溶菌酶的耐受性,以期得到能有效预防龋齿的优良乳酸菌。
1 材料与方法
1.1 实验材料
1.1.1 样品唾液、牙菌斑和口腔粘膜:无锡朝阳口腔医院提供;粪便样品:取自江苏如皋和广西巴马长寿村老人,样品收集后置于体积分数30%甘油中-80℃保存。白菜叶、青菜叶等菜叶样品:市售,采集后,进行乳酸菌的分离和筛选。
1.1.2 菌种变异链球菌ATCC25175(Streptococcus mutans):中国普通微生物菌种保藏管理中心提供。
1.1.3 培养基和主要试剂
1)MRS[11]:葡萄糖 20.0 g,蛋白胨 10.0 g,牛肉膏10.0 g,酵母粉5.0 g,三水合乙酸钠5.0 g,柠檬酸氢二铵2.0 g,七水合磷酸氢二钾2.0 g,七水合硫酸镁0.2 g,四水合硫酸锰 0.05 g,吐温-80 1.0 mL,蒸馏水 1 000 mL,pH 6.2± 0.2,0.1 MPa灭菌 20 min。用于乳酸菌的筛选和培养;
2)TSB[11]:胰蛋白胨 17.0 g,大豆蛋白胨 3.0 g,酵母浸膏6.0 g,葡萄糖2.5 g,氯化钠5.0 g,磷酸氢二钾 2.5 g,蒸馏水 1 000 mL,pH 7.2 ± 0.2,0.1 MPa灭菌20 min。用于变异链球菌的培养增殖。
1.1.4 主要试剂碳酸钙,醋酸氯己定溶液(洗必泰),羟磷灰石,结晶紫,丙酮,无水乙醇,二甲苯,硝酸钾,乙酸乙酯,氯仿,溶菌酶:中国医药集团上海化学试剂公司产品;CFSE荧光染料:Invitrogen公司产品;PI染料:Sigma公司产品。
1.1.5 主要仪器UV-1800紫外可见分光光度计:岛津企业管理有限公司产品;D-78532 Tuttlingen冷冻离心机:德国RUMA-ZENTRIFUGEN公司产品;LSM710激光共聚焦显微镜:德国蔡司公司产品;MMLTISKAN GO酶标仪:Thermo公司产品;M5荧光酶标仪:Molecular Devices公司产品。
1.2 实验方法
1.2.1 乳酸菌的分离利用添加有15 g/L CaCO3的MRS培养基从样品中筛选乳酸菌[12],供后续实验备用。
1.2.2 拮抗S.mutans乳酸菌的筛选通过牛津杯琼脂扩散实验从得到的乳酸菌中筛选对变异链球菌具有拮抗作用的乳酸菌,具体实验方法参考姚沛琳[11]。将质量分数0.02%醋酸氯己定溶液稀释3倍后作为阳性对照。
1.2.3 抑制S.mutans生物膜形成乳酸菌的筛选选取抑菌效果良好的乳酸菌进一步筛选出能抑制S.mutans生物膜形成的菌株。生物膜标本的制备、荧光染料的配制及染色主要依据Khan[13]等人的方法进行;通过专业软件处理得到生物膜厚度,并计算生物膜中活菌面积和死菌面积。生物膜中细菌量的变化用细菌总面积减少率来表示,即细菌总面积减少率(%)=(实验组-对照组)/对照组,通过比较形成的生物膜中的菌体面积减少率初步判定待测乳酸菌对变异链球菌的生物膜形成抑制与否[11]。
1.2.4 菌体性质的测定
1)待测菌株自聚和共聚能力的测定 乳酸菌和变异链球菌均过夜培养12 h,3 000 r/min离心15 min后弃上清收集菌体,重悬于PBS中,调节均浓度为108CFU/mL。根据菌体单独培养和混合培养时菌液上层吸光值分别判断菌株的自聚和共聚能力,计算公式为:自凝集率其中At表示在2、4、16 h吸光值,A0表示t=0时刻的吸光值;交互凝集率其中Ax表示乳酸菌的吸光值,Ay表示变异链球菌的吸光值,Amix表示混合样品的吸光值。
2)待测菌株自身生物膜形成能力测定 待测菌株自身生物膜形成能力的测定参考Wen[14]等人的方法进行。实验方法稍有改动:染色后用乙醇-丙酮混合液显色,显色后于酶标仪600 nm处测定吸光度。
3)待测菌株表面疏水性和表面酸碱电荷测定 以二甲苯为疏水性有机溶剂测定待测菌株表面疏水性;选择乙酸乙酯作为路易斯碱,氯仿作为路易斯酸,测定待测菌株表面酸碱电荷。乳酸菌表面疏水性和表面酸碱电荷的测定参考Samot.J[15]等人所描述的方法。将乳酸菌过夜培养12 h后,离心收集菌体,重悬于pH 6.2的0.1 mol/L KNO3中,在600 nm下调吸光度为0.6,记为A0;将1 mL有机溶剂加入到3 mL菌液中,在室温下先预培养10 min,之后振荡2 min,再在室温下培养20 min,测定水相在600 nm下的吸光度,记为A1,计算公式:

菌体表面酸碱电荷的测定同上,将有机溶剂替换为乙酸乙酯和氯仿。
1.2.5 菌株综合性质分析对菌株性质的测定结果采用主成分分析法[16](Principal Component Analysis,PCA)进行分析,从中得到综合性能优良的菌株进行后续实验。
1.2.6 目的菌株的鉴定将分析得到的性质良好的菌株进行16S rDNA分子生物鉴定[17],将其基因组进行提取、PCR之后由测序公司测序,所得序列在NCBI上采用BLAST程序在GenBank基因库中与已有的16S rDNA序列进行相似性比较分析。
1.2.7 植物乳杆菌FB-T9不同时期介导对变异链球菌生物膜形成的影响作者选择在S.mutans生物膜形成前期的0、6 h和12 h以及生物膜形成初期(24 h)和成熟后期(48 h)加入乳酸菌菌悬液进行介导,利用激光共聚焦显微镜(CLSM)对生物膜进行扫描拍照,判断FB-T9介导对变异链球菌生物膜形成的影响。生物膜模型的建立和生物膜结构的观察参考Lynch[18]等人的方法,并稍作改动。将S.mutans过夜培养12 h后,调节菌浓度为105CFU/mL,取1 mL菌液和3 mL蔗糖质量分数为0.25%的TSB液体培养基于直径6 cm的玻璃培养皿中,将18 mm×18 mm规格的无菌盖玻片作为生物膜形成载体置于培养皿中,在培养时间为第0、6、12 h时分别加入200 μL乳酸菌菌悬液,静置培养24 h后取出玻璃片,染色、观察。而在S.mutans24 h(或48 h)生物膜形成后介导的操作如下:在12 h(或24 h)更换3 mL新鲜TSB培养基,形成24 h(或48 h)S.mutans生物膜,去除培养皿中培养基,PBS洗涤玻片2次,去除表面浮游细菌,加入4 mL乳酸菌菌悬液,静置培养24 h后,取出玻璃片,染色、观察。
1.2.8 植物乳杆菌FB-T9对唾液包裹的羟磷灰石的粘附能力测定健康志愿者唾液的收集与处理以及唾液包被的羟基磷灰石(S-HA)的制备、待测乳酸菌的培养、荧光染色及菌体的粘附参考赵红萍[19]等人的方法,在荧光酶标仪上以激发波长492 nm、发射波长517 nm测定各孔的荧光值,扣除阴性对照组的荧光值,即为粘附菌的荧光值。细菌粘附率=粘附菌的荧光值/总荧光值×100%,其中总荧光值是只含有标记的菌液、未加入羟基磷灰石测定的荧光值;阴性对照是只含有羟基磷灰石和PBS测定的荧光值。
1.2.9 植物乳杆菌FB-T9对溶菌酶的耐受能力的分析采用分光光度法考察FB-T9对溶菌酶的耐受情况。在96孔培养板中加入MRS培养基,再分别添加不同质量浓度的溶菌酶溶液使得终质量浓度分别为0.2~3.0 mg/mL。将乳酸菌培养物以体积分数5%的接种量接种到96孔培养板中,37℃培养24 h,测定A600nm,即根据FB-T9的生长情况判断FB-T9对溶菌酶的耐受性。对照组只添加等体积的108CFU/mL乳酸菌培养物,溶菌酶溶液的量用等体积无菌水替代。
2 结果与讨论
2.1 拮抗S.mutans乳酸菌的筛选
通过选择性MRS培养基从样品中筛选出乳酸菌,然后利用牛津杯琼脂扩散法筛选对变异链球菌具有抑制作用的菌株,抑菌结果如表1所示。

表1 乳酸菌对变异链球菌生长的抑制Table 1 Inhibition of LAB strains on the growth of S.mutans

续表1
根据抑菌实验的结果,选择抑菌效果良好(抑菌圈在15 mm及以上)的菌株5D-3、PC-T4、LP-11、FB-T9、LPZ-14、381、430、438、7-1-18、12-22、13-15、24-35共12株菌进行后续的筛菌实验。
2.2 抑制S.mutans生物膜形成乳酸菌的筛选
在0 h将待测菌株与变异链球菌一起培养24 h,使用共聚焦激光扫描显微镜观察生物膜结构,并计算各自的菌体总面积相对于空白组的减少率,结果如表2所示。
表2 不同菌株对变异链球菌生物膜形成的影响(±s)Table 2 Effect of LAB on S.mutans biofilm formation(±s)
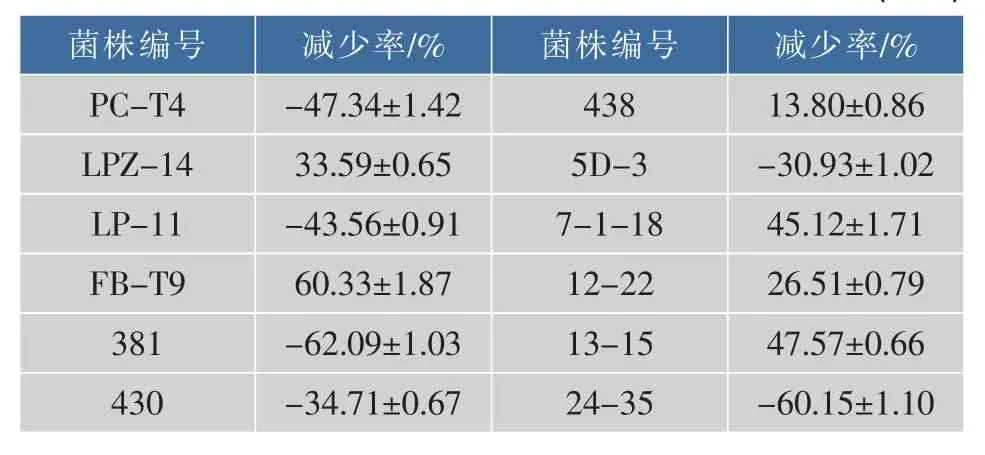
表2 不同菌株对变异链球菌生物膜形成的影响(±s)Table 2 Effect of LAB on S.mutans biofilm formation(±s)
菌株编号减少率/%P C-T 4菌株编号-4 7.3 4±1.4 2 4 3 8 L P Z-1 4-3 0.9 3±1.0 2 3 3.5 9±0.6 5 5 D-3-4 3.5 6±0.9 1 7-1-1 8 4 5.1 2±1.7 1 6 0.3 3±1.8 7 F B-T 9 1 2-2 2减少率/%2 6.5 1±0.7 9 L P-1 1 3 8 1-6 2.0 9±1.0 3 1 3-1 5 4 7.5 7±0.6 6 4 3 0-3 4.7 1±0.6 7 2 4-3 5 1 3.8 0±0.8 6-6 0.1 5±1.1 0
有些乳酸菌如LPZ-14、FB-T9等对变异链球菌的生物膜的形成有抑制作用,而PC-T4、5D-3等则起到促进作用。这种情况与姚沛琳[11]的测定结果具有相似性。具有防治龋病能力的益生菌,需要在抑制变异链球菌的同时能抑制其生物膜的形成。
2.3 待测菌株菌体性质测定
2.3.1 待测菌株自聚能力的测定菌体的自聚能力与其黏附宿主细胞的能力有一定相关性,具有较强自凝集能力的菌株,定殖能力更好[20]。待测菌株的自聚能力过低说明该菌株在口腔中的生长繁殖能力较弱,不利于在口腔环境中的定殖;但薛龙[21]等人指出高自聚能力是一些口腔致病菌引起口腔疾病的一个重要原因,所以综合而言初期自聚力较高而后期自聚力不强的菌株可能更具作为口腔益生菌的潜能。从表3的实验结果中可以看出,初期(4 h)待测菌株的自聚能力强弱不同(8.31%~35.09%),而此自聚结果整体偏低,可能原因是测定时间的不同和菌株的差异性。

表3 不同时间点待测菌株的自聚能力Table 3 Auto-aggregation ability of LAB at different time %
2.3.2 待测菌株共聚能力的测定益生菌与致病菌的共聚能力也是益生菌发挥益生功能的一个重要方面。如果益生菌能够与口腔中浮游的致病菌发生共聚,随着唾液的吞咽、口腔清理等行为,有助于减少口腔中浮游的致病菌数量,从而减少致病菌在口腔中的定殖。
由表4的实验结果可以看出,2 h时待测菌株的共聚能力较低,可能原因是初期的待测菌株主要发挥增殖作用和抑菌作用,而4 h的共聚能力明显增大,说明待测菌株开始与变异链球菌发生相互凝集作用,且交互凝集率在7.3%~22.5%。菌株381、12-22、FB-T9、LPZ-14具有较为良好的共聚能力,说明它们在口腔环境中可能具备促进浮游变异链球菌排除口腔的能力。

表4 不同时间下待测菌的共聚能力Table 4 Coagregation ability of LAB at different time %
2.3.3 待测菌株自身生物膜形成能力测定TORLAKOVIC[22]等人的研究表明除了变异链球菌,包括乳酸菌属和双歧杆菌属在内的菌种也可能与早期龋损的发展有关,作为益生菌菌株自身生物膜的形成至关重要。为了保证它们作为益生菌在口腔环境中不会促进口腔生物膜的形成,其自身生物膜形成能力尽可能越低越好。由图1的实验结果可以看出,相比于主要致龋菌S.mutans形成生物膜的能力,待测菌株自身生物膜形成能力普遍较低,其中菌株 381、430、FB-T9和 LPZ-14自身形成生物膜的能力相对低下,表明它们在口腔中作用时可能不会促进生物膜的形成。

图1 待测菌株自身生物膜形成能力Fig.1 Biofilm formation ability of LAB
2.3.4 待测菌株表面疏水性测定菌株的表面疏水性越高,对上皮细胞的粘附性越好[23]。由图2显示的实验结果可以看出菌株 PC-T4、FB-T9、438、13-15和24-35具有较高的疏水性,可能对口腔上皮细胞的粘附力强,更有利于有益菌株在口腔内的定殖。
2.3.5 待测菌株表面酸碱电荷测定菌体的表面性质,如表面疏水性和表面酸碱电荷与菌株之间及与宿主之间的非特异性粘附有关[24],菌体表面具有较低的酸电荷和较高的碱电荷不会促进生物膜的形成,反而能抑制其形成。由表5显示的结果可以看出待测菌株FB-T9和438具有较理想的酸碱电荷性质,这与它们能有效抑制变异链球菌生物膜形成量的结果保持一致。

图2 待测菌株的表面疏水性Fig.2 Surface hydrophobicity of LAB

表5 待测菌株的表面酸碱电荷Table 5 Acid and alkali charge of the surface of LAB %
2.4 菌株性质综合分析
利用PCA分析方法来评价乳酸菌的菌株特性与抑制S.mutans生物膜形成的能力,从而筛选出具有潜在抑制S.mutans生物膜形成作用的乳酸菌。由因子载荷图 3(a)可知,主要分成 4 个主成分:(1)第一主成分(PC1)在模型中的贡献率为35.62%,特征是疏水性、酸电荷和碱电荷;第二主成分(PC2)在模型中的贡献率为22.28%,特征是自聚能力;第三主成分(PC3)在模型中的贡献率为16.24%,特征是自身生物膜形成能力;第四主成分(PC4)在模型中的贡献率为13.66%,特征是共聚能力。因子评分图3(b)和图3(c)展示了潜在乳酸菌的分布。从因子评分图3(b)上可以看出,在主成分1和主成分2上综合得分高的有3株菌,分别为PC-T4、13-15和FBT9;从因子评分图3(c)上可以看出,在主成分3和主成分4上综合得分高的有两株菌,分别为FB-T9和LPZ-14。综合看来,菌株FB-T9表现出较高的综合能力。结合筛菌结果,在抑菌作用和抑制变异链球菌生物膜形成性质上表现良好的菌株为FB-T9。
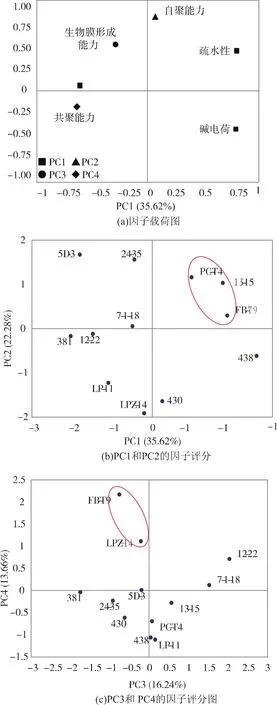
图3 主成分分析乳酸菌菌株特性Fig. 3 Graphical representation of the principal component analysis of LAB properties
2.5 目的菌株的鉴定
基于16S rDNA基因两端的保守序列,对菌株FB-T9进行分子鉴定,结果表明菌株FB-T9的16S rDNA序列与植物乳杆菌序列具有100%的同源性,可以初步判定菌株FB-T9为植物乳杆菌。
2.6 植物乳杆菌FB-T9介导对变异链球菌生物膜形成的影响
根据唐子圣[25]等人的研究结果,变异链球菌早期生物膜经过24 h已经基本形成,形成规律具体如下:0 h细菌开始粘附;6 h细菌开始定殖,是生物膜典型结构形成的关键时期;到12 h,早期生物膜开始形成;24 h时早期生物膜已经基本形成;而到48 h,变异链球菌生物膜已经成熟。
为考察植物乳杆菌FB-T9的介导时间对变异链球菌生物膜的影响,在0、6、12 h时分别在变异链球菌培养液中加入FB-T9,随后培养至24 h,通过激光共聚焦显微镜观察变异链球菌的生物膜结构。随着培养时间的增加,从 24 h(图 4(a))到 48 h(图4(b)),阴性对照组中S.mutans生物膜的荧光强度和面积增大,结构逐渐变得致密,生物膜的形成量也逐渐增大。在0 h(图4(c))加入FB-T9介导培养至24 h后,荧光强度极低,说明FB-T9严重抑制了S.mutans的粘附;在 6 h(图 4(d))介导后培养至 24 h,能看到零散的橘色荧光,死菌较多,说明前6 hS.mutans开始粘附,但之后由于FB-T9的加入,抑制了S.mutans的定殖;而在 12 h(图 4(e))介导时,由于S.mutans已成功定殖,菌体荧光面积逐渐增大,但呈现出分散的橘色荧光,说明S.mutans的生长和生物膜的形成受到了抑制。

图4 激光共聚焦显微镜下的生物膜结构图Fig.4 CLSM images of biofilm structure
为考察S.mutans生物膜形成后FB-T9的抑制作用,在24 h时加入FB-T9介导,培养到48 h观察生物膜结构。可以看到在24 h(图4(f))介导时由于S.mutans生物膜已经基本形成,呈现出小面积的团状结构,且相对于12 h(图4(e))介导后的生物膜结构致密,但对比24 h阴性对照(图4(a)),绿色荧光面积很少,主要呈现出橘色荧光,说明FB-T9对生物膜中的菌体有明显抑制作用,但在结构上没有明显的破坏作用;而在48 h时介导,由于S.mutans生物膜已经成熟,生物膜呈现致密的团块状结构,菌落聚集融合,但是相较于48 h的阴性对照 (图4(b)),除了生物膜中的死菌面积明显增大以外,生物膜结构没有显著变化,说明在S.mutans生物膜成熟以后FB-T9的介导效果并不理想。从而可推断,植物乳杆菌FB-T9在S.mutans生物膜形成前期的介导效果较好,能显著抑制变异链球菌的粘附和定殖,对其生物膜结构的形成表现出明显的抑制作用,且对于减少各时期生物膜中的活菌面积有显著效果。
2.7 植物乳杆菌FB-T9对唾液包裹的羟磷灰石粘附能力的测定
人类牙齿的主要成分为羟磷灰石,体外利用SHA模拟人口腔牙齿,考察植物乳杆菌FB-T9对牙面的粘附能力。实验结果显示:植物乳杆菌FB-T9对S-HA的粘附率为32.93%,显著低于变异链球菌对S-HA的粘附率 (P<0.05)。这表明植物乳杆菌FB-T9对牙面的粘附性相对较低,不会在牙齿表面大量聚集,对牙齿酸蚀威胁的可能性较小。
2.8 植物乳杆菌FB-T9对溶菌酶的耐受能力的分析
实验结果显示:在0~1.2 mg/mL质量浓度下的溶菌酶基本不影响植物乳杆菌FB-T9的生长,但是当溶菌酶质量浓度高达1.4 mg/mL时,菌体生长吸光值发生突然变小,可能原因是在植物乳杆菌FBT9的对溶菌酶耐受的临界质量浓度介于1.2~1.4 mg/mL之间,即植物乳杆菌FB-T9对溶菌酶的最高耐受质量浓度为1.2 mg/mL[26]。作者的实验结果远远高出人口腔唾液中溶菌酶质量浓度(0~57 μg/mL),这说明该菌株具备在口腔环境中存活的能力。

图5 植物乳杆菌FB-T9在不同质量浓度溶菌酶下培养24 h的生长情况Fig.5 Growth of L.plantarum FB-T9 at 24 h in different concentrations of lysozyme
3 结 语
从健康人的粪便中分离得到一株对变异链球菌的生长及生物膜形成具有抑制效果的植物乳杆菌FB-T9。L.plantarumFB-T9的早期介导能显著抑制S.mutans的粘附和定殖,进而抑制生物膜形成,且能有效减少生物膜中的活菌面积。此外,该菌对牙面表现出较低的粘附率,并在远高于口腔溶菌酶浓度的条件下,表现出良好的耐受性,说明FBT9具备作为口腔益生菌的潜能。由于L.plantarumFB-T9在《可用于食品的菌种》名单之列,可以作为安全益生菌株添加于食品中,以咀嚼片或奶片的形式作为日常口腔益生菌产品在预防儿童和成人口腔龋齿上发挥作用。

