醋酸高产菌株的筛选及高酸度苹果醋的酿造
李 欢 , 毛 健 *,3,4, 刘双平 ,3,4, 周志磊
(1.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;2.江南大学 食品学院,江苏 无锡214122;3.国家黄酒工程技术研究中心,浙江 绍兴 312000;4.江南大学(如皋)食品生物技术研究所,江苏 如皋226500)
苹果醋是将苹果或浓缩果汁作为主要原料,经过酒精发酵和醋酸发酵而成的一种营养丰富、风味优良的酸味饮品。一般粮食醋中钾、锌等微量元素不足,而苹果醋不仅可以补充这些微量元素,而且还含有较多维生素、多糖、氨基酸等物质,有机酸分布及风味口感均比酿造食醋好[1-2]。但市面上的苹果醋多以食醋调配制成,口感以苦涩为主,刺激性强,难获得消费者青睐;少数发酵苹果醋采用果汁发酵,但其营养物质损失较大,产量低成本高。随着人们对苹果醋食疗保健作用的认识,以及对高酸度醋功能研究的深入,工业化生产高效、低成本的液态高酸度苹果醋具有非常大的潜在市场。研究高酸度苹果醋的工艺开发不仅可以解决苹果滞销的经济问题,还可以提高原料利用率、满足果醋市场日益增大的需求量[3]。
在果醋生产中,醋酸菌是决定醋酸产量和质量的主要菌株。国内厂家常用AS1.41和沪酿1.01生产液态粮食醋[4],但这些菌株在果醋酿造中的适用性不强;虽然国内外对菌株选育研究较多,但产酸能力和稳定性不高,且目前用于高酸度果醋酿造的专用菌株并未明确。同时,发酵工艺对高酸度苹果醋的生产也至关重要,现阶段对高酸度发酵醋的研究集中在粮食醋(总酸质量浓度70~100 g/L),多采用传统固态发酵方法,生产成本高、产品质量不稳定[5-6]。而对果醋研究多为实验室摇瓶试验,总酸质量浓度在50~80 g/L左右,对高酸度苹果醋(总酸质量浓度>100 g/L)的酿造工艺,尤其是利用发酵罐生产液态高酸度苹果醋的报道较少。
作者通过筛选高产醋酸菌株和苹果醋发酵罐试验,得到一株高产醋酸的巴氏醋杆菌CYD159,并对苹果醋流加发酵的生产工艺参数进行了优化,最终可得到120 g/L的高酸度苹果醋,缩短了生产周期,在提高醋酸产量的前提下降低了生产成本,为高酸度苹果醋大规模生产提供理论支持和技术依据,具有广阔的研究前景。
1 材料与方法
1.1 实验材料
1.1.1 原料 酿造苹果酒:作者所在实验室自制;浓缩苹果汁:市售。
1.1.2 菌株 醋酸菌分别筛选于镇江醋厂醋酸发酵液与四川醋厂醋酸发酵醅。
1.1.3 主要试剂 葡萄糖、酵母膏、蛋白胨、琼脂粉、硫酸铵、磷酸氢二钾、磷酸二氢钾、硫酸镁、无水乙醇、柠檬酸、三氯乙酸、磷酸、亚硫酸钠:购自国药集团。
1.1.4 主要仪器 立式高压蒸汽灭菌锅:上海博迅实业有限公司产品;隔水式恒温培养箱:上海森信实验仪器有限公司产品;恒温摇床:上海合恒仪器设备有限公司产品;7230G可见分光光度计:上海佑科仪器仪表有限公司产品;冷冻离心机:德国eppendorf公司产品;FA2004N电子分析天平:梅特勒-托利多爱仪器(上海)有限公司产品;超净工作台:苏州富泰洁净系统有限公司产品;BioFlo 110型发酵罐:美国New Brunswick Scientific公司产品。
1.2 培养基
YPD液体培养基:酵母粉10 g/L,鱼粉蛋白胨20 g/L,葡萄糖20 g/L,pH自然,0.1 MPa灭菌 15 min。
增殖培养基:已灭菌的YPD液体培养基与苹果酒按体积比3∶2比例混合备用。
筛选培养基:酵母提取物10 g/L,鱼粉蛋白胨20 g/L,葡萄糖20 g/L,琼脂20 g/L,碳酸钙20 g/L按比例溶于1 L水中,0.1 MPa灭菌15 min后冷却至室温,每100 mL培养基使用前加入3 mL无水乙醇。
一级种子培养基:酵母提取物20 g/L,蛋白胨20 g/L,葡萄糖20 g/L,pH自然,0.1 MPa灭菌 15 min后冷却至室温,每100 mL培养基中加入3 mL无水乙醇。
二级种子培养基:即增殖培养基。
发酵培养基:酵母提取物30 g/L,葡萄糖20 g/L,磷酸二氢钾1 g/L,硫酸镁1 g/L,起始装液量为1 L,0.1 MPa与发酵罐一起灭菌15 min,冷却备用。
1.3 实验方法
1.3.1 高产醋酸菌株的筛选
1)平板初筛将醋酸发酵液和增殖培养基按体积比1∶1混合,测定总酸质量浓度。当总酸增加较为明显后,用无菌水将增殖培养液无菌倍比稀释,涂布于筛选培养基上,30℃恒温培养48 h。取菌落形态明显、生长速度快的单菌落进行划线分离,至平板上出现产透明圈、形态一致的单菌落。选取生长迅速,透明圈大的单菌落接入种子培养基中[7]。
2)定性实验[8]醋酸形成的钠盐或钙盐溶液,与三氯化铁共热时会生成红褐色沉淀,空白原液无沉淀。取种子培养基中的菌液,6000 r/min、4℃下离心20 min,取5 mL除去菌体的上清液于试管中,以1 mol/L氢氧化钠中和至pH 7.0,煮沸后加入质量分数5%的FeCl3溶液3滴,形成红褐色沉淀者说明有醋酸产生,对应菌株为产醋酸菌株。
3)高产醋酸菌株复筛将分离所得的菌株接种于100 mL种子培养基中,恒温摇床培养,培养条件30℃、200 r/min,发酵72 h后取样测定总酸质量浓度。
4)苹果醋发酵实验将复筛得到的产酸量较高的菌株和传统酿醋工业中常用菌株沪酿1.01进行苹果醋发酵,对比菌株在苹果醋发酵过程中的产酸速率和生长情况。
1.3.2 菌种鉴定
1)菌种形态观察将复筛得到的菌株在筛选平板培养基上活化24 h,选取长势好、菌落饱满、形态明显的菌落,观察生长状态及菌落特征。
2)16S rDNA鉴定用细菌基因组DNA提取试剂盒提取该菌DNA,并将所得DNA产物通过PCR扩增。具体操作及通用引物参照陈洋等[9]人的鉴定方法。将所得PCR产物送至南京金斯瑞生物科技有限公司测序。
1.3.3 高酸度苹果醋酿造实验
1)乙醇体积分数优化实验高酸度醋酸发酵一般不能使用一次性加料至最大发酵体积的方法,因为一次性发酵容易引起菌种老化,发酵时间延长,产量下降等问题[10],所以采取流加方法,又称分批补料发酵,往发酵罐中先加入一定原料发酵一段时间,然后逐渐补入酒醪直到酸度不再上升从而结束发酵。乙醇是醋酸发酵的底物,并为醋酸菌生长代谢提供能量[9],初始乙醇体积分数及发酵过程中乙醇体积分数对醋酸发酵影响较大。
初始乙醇体积分数的优化:用苹果酒调整醋酸发酵的初始乙醇体积分数分别为1%、3%、5%、7%、9%、11%,测定培养0 h和24 h的A600nm值和总酸质量浓度,计算增长量。
发酵过程中乙醇体积分数的优化:按1.3.1的方法将种子液接种至1 L发酵培养基中,流加苹果酒调整发酵罐内的初始乙醇体积分数,其他条件相同。当发酵罐内乙醇体积分数为0时,一次性补加苹果酒,使发酵过程中的乙醇体积分数分别维持在1%、3%、5%、7%、9%,发酵至第 48 h结束,测定发酵液的最终总酸和乙醇体积分数[12-13]。
2)分割取醋对苹果醋发酵的影响分割取醋是指酒醪加入醋酸发酵罐后,第一次发酵接入体积分数10%醋酸菌种子,发酵成熟后放出1/2或1/3料液,再加入同量的成熟酒醪或酒精继续发酵而不再接入醋酸菌。这种方法有效的降低了醋酸菌种的制作频次和醋酸菌的变异几率,减少了醋酸发酵的迟滞期,从而降低液态食醋的成本,为企业带来了一定的经济效益[14]。分割发酵工艺已广泛应用于酒精醋[15]、食醋[16]和其他发酵产物如柠檬酸[17]、糖化酶[18]、丁醇[19]等,但在苹果醋生产中报道较少。
作者以发酵液总酸变化为指标,绘制苹果醋的产酸曲线,探究分割时间和分割次数对高酸度苹果醋酿造的影响。
1.4 测定方法
酒精度、pH、总糖等基本理化指标的测定参照GB/T 15038-2006《葡萄酒、果酒通用分析方法》。
菌体浓度:使用分光光度计测定波长600 nm处的吸光值,用A600nm表示菌体浓度。
总酸测定[9](以乙酸计):取适量发酵液超声5 min除去二氧化碳后,经8000 r/min离心5 min,取上清液1 mL,加入50 mL无二氧化碳的蒸馏水,用已标定的0.1 mol/L NaOH溶液滴定,直至pH 8.20为终点。计算公式如下。
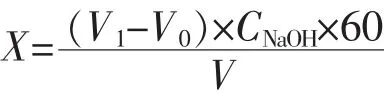
式中:X为总酸质量浓度(以乙酸计),g/L;V1为测定样品时,消耗NaOH溶液的体积,mL;V0为空白试验时,消耗NaOH溶液的体积,mL;V为测定样品的体积,mL;CNaOH为氢氧化钠标准滴定溶液的浓度,mol/L;60为醋酸的相对分子质量,g/mol。
2 结果与分析
2.1 高产醋酸菌株的筛选
2.1.1 平板初筛结果 在筛选平板上,产酸的菌能利用培养基中的乙醇产生乙酸,产物乙酸与碳酸钙反应,因此产酸菌株周围会产生较清晰的透明圈。以透明圈直径与菌落直径之比(U值)大小为标准[4],从镇江恒顺醋厂发酵液和四川醋厂的醋酸发酵醅中初筛得到了20株产酸菌株,其初筛结果如表1所示。
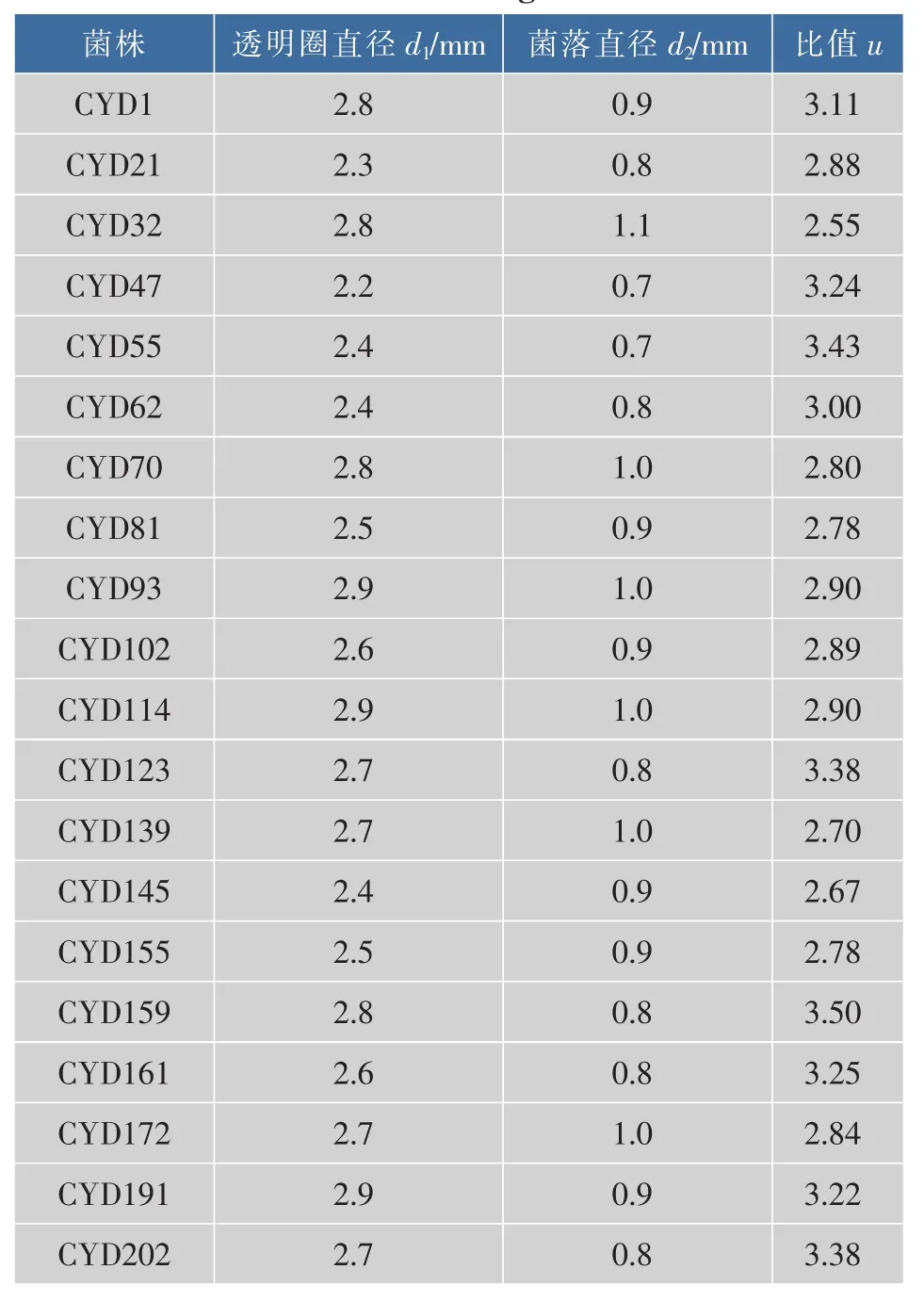
表1 菌株的初筛结果Table1 Initial screening results of strain
在初筛培养基上30℃恒温培养48 h后,菌株CYD93、CYD114、CYD191透明圈最大,说明这 3株菌生长能力旺盛,能够利用乙醇作为碳源迅速繁殖生长。根据透明圈与菌落大小的比值,发现菌株CYD1、CYD47、CYD55、CYD123、CYD161、CYD159、CYD191、CYD202比值均大于3,初步判断这几株菌分解利用乙醇的能力相对较强。
2.1.2 醋酸定性实验结果 产酸定性试验结果如图2所示,按表1顺序从左至右依次排开,只有菌株CYD21、CYD47、CYD93所对应的试管底部未生成红褐色沉淀,其他17株所对应的试管受热后均产生了红褐色沉淀,由此证明 CYD21、CYD47、CYD93不是醋酸菌,其余17株菌均为产醋酸的菌株。
2.1.3 产醋酸菌株复筛结果比较 初筛后对17株产醋酸的菌株进行摇瓶实验,结果见图2,种子培养基的初始酸质量浓度均为3.2 g/L左右,经过72 h恒温摇床培养后,只有CYD55、CYD159和CYD202的产酸量达到了20 g/L以上,分别为21.20、24.83、20.99 g/L。其次是CYD155、CYD139的产酸量在7 g/L左右,其余菌株均低于6 g/L,因此选取CYD55、CYD159和CYD2023株菌株作为后续实验菌株。

图1 醋酸定性实验结果Fig.1 Qualitative results of acetic acid
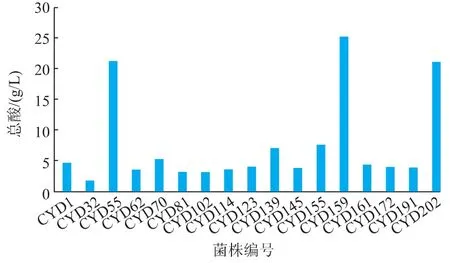
图2 不同菌株产酸量结果Fig.2 Acid yield of different bacteria
2.1.4 苹果醋发酵性能实验 将产酸量较高的3株菌和沪酿1.01进行苹果醋发酵实验,控制发酵条件相同,测定了4株菌的生物量变化情况和产酸曲线。从图3(a)中看出,生长速度由高到低分别是沪酿 1.01、CYD159、CYD55、CYD202, 但沪酿 1.01 的生长能力最强,在整个发酵过程中,其A600nm远高于其他3株菌,说明该菌株可以较快适应环境并较快利用乙醇,积累醋酸。从产酸曲线中可以看出,沪酿1.01比其他3株菌起酵快,在20 h时已达到最高酸度, 而 CYD55、CYD159、CYD202分别在发酵 40 h、40 h和36 h时达到最高酸度。但CYD159较其他3株菌的产酸能力明显高,苹果醋发酵过程中总酸质量浓度高达65.6 g/L,其他3株菌的酸质量浓度均低于60 g/L。通过4株菌的发酵特性对比,沪酿1.01在苹果醋发酵过程中菌浓度最高但产酸能力较低,并不是酿造高酸度苹果醋的最适菌株;CYD159则显现出较好的发酵特性,起酵速度略低于沪酿1.01,但发酵过程中醋酸积累多,可以作为后续实验菌株。
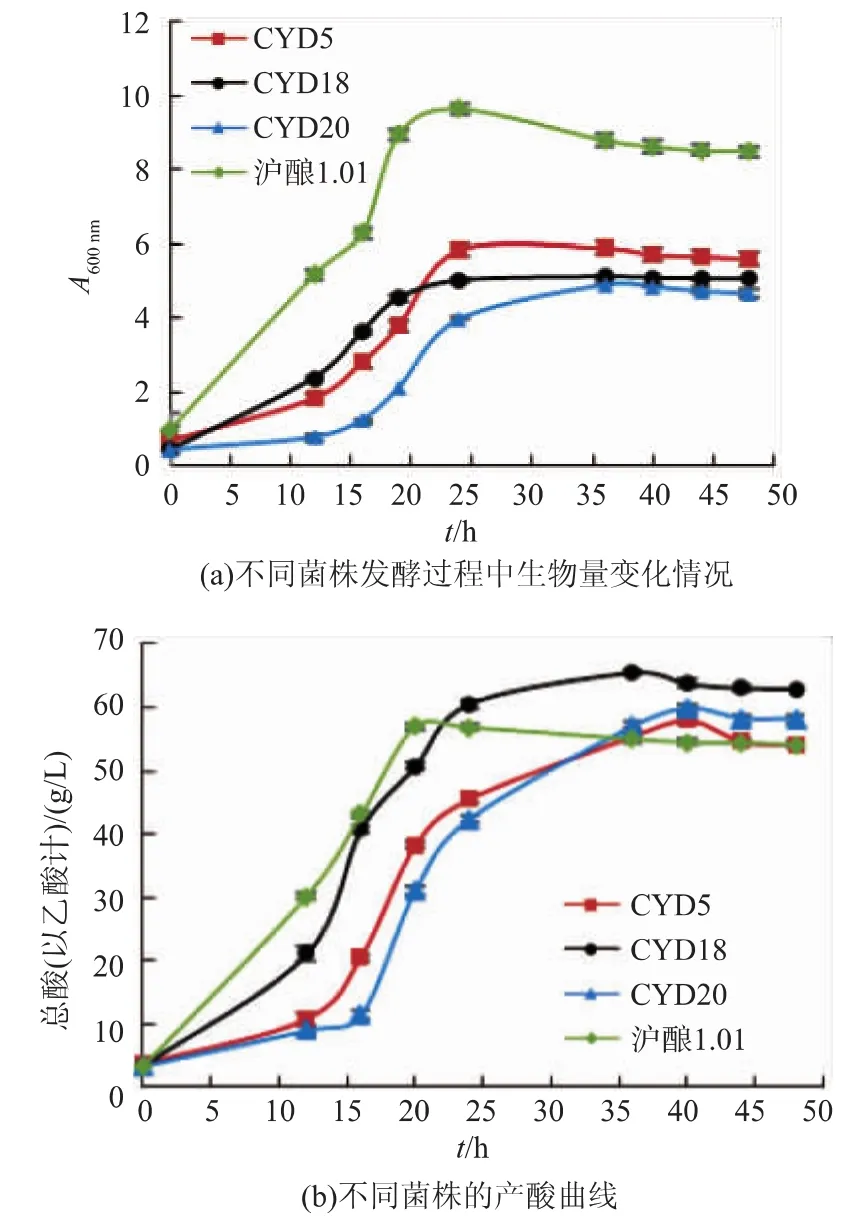
图3 不同菌株的发酵性能对比Fig.3 Fermentation characteristic of strains
2.2 菌株鉴定
2.2.1 菌株形态观察 如图4所示,菌株CYD159的菌落为圆形、乳白色、边缘光滑有明显凸起。经美蓝染色后在光学显微镜下观察如图5,细胞无芽孢,呈短杆状,单个或成对成链出现。

图4 菌株CYD159的菌落特征Fig.4 Colony characteristics of CYD159
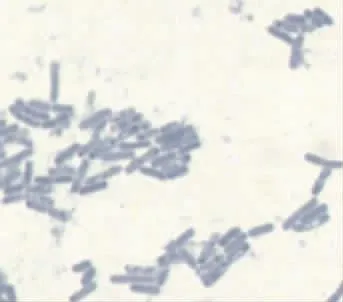
图5 菌株CYD159的菌体形态Fig.5 Thalli properties of CYD159
2.2.2 分子生物学鉴定 如图6所示,菌株CYD159经PCR扩增得到的16S rDNA片段,经琼脂糖凝胶电泳后,该菌株在凝胶上出现了一条亮带,大约1600 bp。
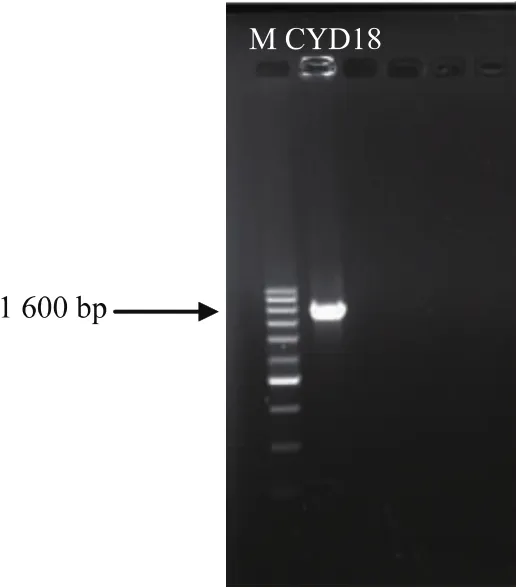
图6 16S rDNA琼脂糖凝胶电泳图Fig.6 Agarose gel electrophoresis of 16S rDNA obtained from CYD159
将所得序列在GenBank中使用Blast程序进行同源性比较后发现该菌株与巴氏醋杆菌(Acetobacter pasteurianus)有很高的同源性,达到99%;用MEGA 7.0软件,Neighbor-joining法构建系统发育树,如图7所示,菌株CYD159与巴氏醋杆菌关系亲近,可以确定是巴氏醋杆菌(Acetobacter pasteurianus)。保藏武汉大学中国典型培养物保藏中心,保藏编号为CCTCC M 2015418。

图7 CYD159的系统进化树Fig.7 Phylogenetic tree of strain CYD159
2.3 高酸度苹果醋酿造实验
2.3.1 发酵过程中乙醇体积分数的确定
1)初始乙醇体积分数的确定 随着初始乙醇体积分数增加,发酵24 h时菌体A600nm和产酸量都呈现先增长后下降的趋势。由图8可知,初始乙醇体积分数为1%时,醋酸菌由于底物体积分数过低,不能满足其基本需求,生长和产酸能力都最低;初始乙醇体积分数为5%时,菌体增长量开始下降,说明此浓度对醋酸菌生长已产生抑制作用,但经过一段时间适应后,其总酸仍在积累。但乙醇体积分数高达11%时,菌体几乎停止增长,产酸量较低。初始乙醇体积分数为3%时,菌体生长最好,但由于发酵过程中总乙醇体积分数只有3%,导致总酸增长量比高体积分数乙醇的对照组低,说明通过适当补给碳源,该醋酸菌仍有能力继续合成乙酸。为避免乙醇的底物抑制作用,缩短菌种的发酵延滞期,所以选取3%作为苹果醋发酵的初始乙醇体积分数。
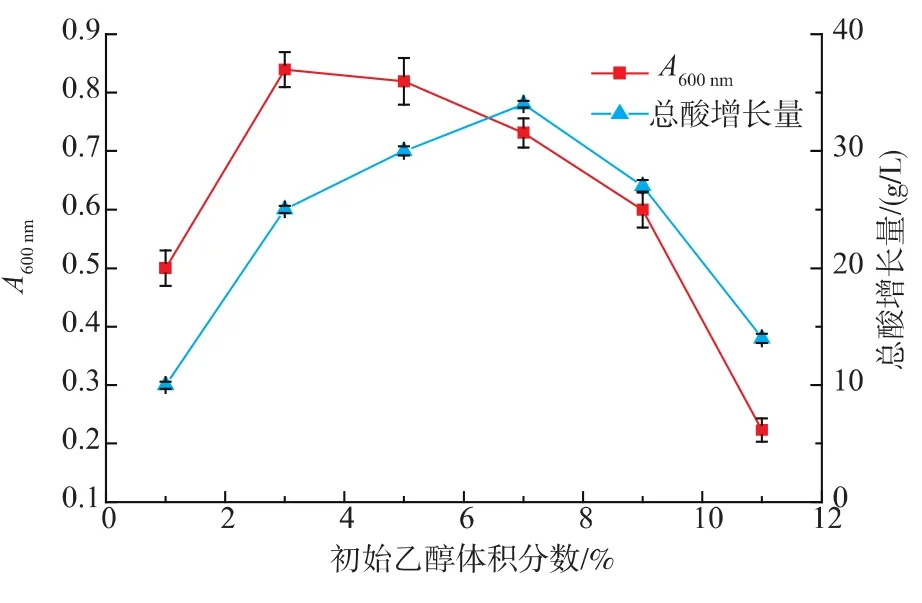
图8 初始乙醇体积分数对苹果醋发酵的影响Fig.8 Influence of initial ethanol concentration to apple vinegar fermentation
2)发酵过程中乙醇体积分数的确定发酵初始体积1.25 L,初始乙醇体积分数3%,总酸3 g/L左右,当发酵至12 h,发酵罐内乙醇体积分数降至0,总酸达到25 g/L左右,菌体浓度3.6左右,说明醋酸菌已开始发酵,此时补加苹果酒调整发酵过程中的乙醇体积分数,发酵第48 h取样,测得参数见表2。
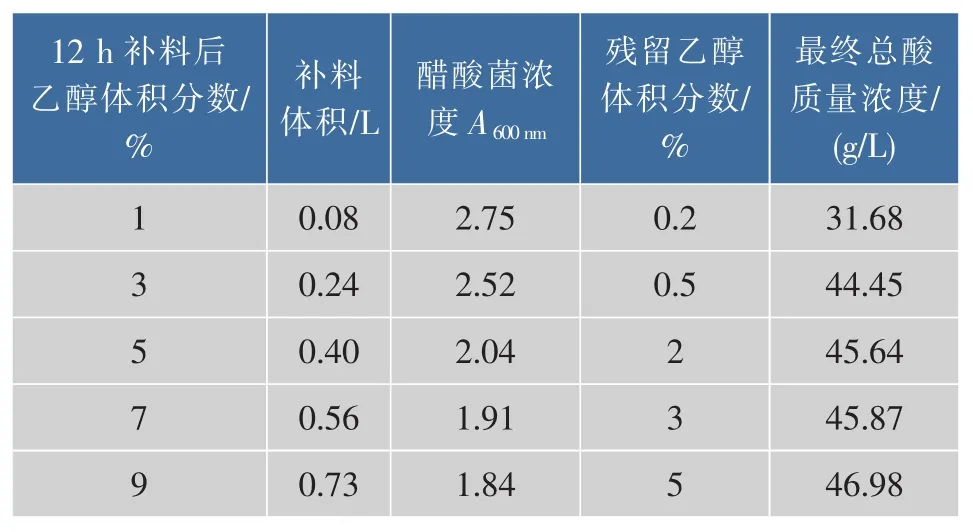
表2 乙醇体积分数对苹果醋发酵的影响Table2 Influence of ethanol concentration to apple vinegar fermentation
发酵过程中乙醇体积分数为1%和3%时,醋酸菌代谢旺盛,乙醇转化率较高。当乙醇体积分数高于3%,乙醇转化率明显下降,说明醋酸菌在一定体积分数的乙酸的作用下,对环境中乙醇较为敏感,乙醇耐受能力有所下降[20],当发酵液中乙醇体积分数高于5%时,醋酸菌CYD159难以维持较高的生长和产酸能力,进而对乙醇的利用率降低[21],造成残酒,对高酸度苹果醋酿造产生不良影响。此外,大多数补料分批发酵过程中采用人工分时补料方式,这种方法会对发酵过程造成较大冲击[22],使发酵过程的温度、pH值和溶解氧等参数波动。因此,为提高原料利用率,实现高酸度苹果醋的生产,在发酵过程中应通过控制流加速率的方法补加乙醇体积分数并控制在3%以下,避免一次性补加过量乙醇。
2.3.2 发酵过程中分割次数的确定 前期实验通过补料流加苹果酒的方法,尽可能降低了初期和发酵过程中底物乙醇对醋酸菌的抑制,但在醋酸发酵后期,随着发酵液中乙酸体积分数的增加,产物抑制效应随之加剧,醋酸菌的产酸能力和对乙酸的抗性都会降低,致使醋酸积累量不足,难以获得高酸度苹果醋。通过多次发酵罐实验发现,及时对发酵液进行分割,可以降低乙醇和醋酸的协同胁迫,因此对发酵中分割时间和次数进行了探讨。
高素国[14]等人指出分割取醋工艺顺利实施的关键是醋酸发酵结束后放料的时机。通常情况下要求醋酸发酵醪中残留乙醇体积分数在0.3%~0.5%之间,因此该实验除了残留乙醇体积分数,还以发酵液中总酸质量浓度不再明显上升为主要指标。如图9所示,当发酵液酸度不再增加时,反而有所下降,说明菌体产酸速率已下降,醋酸发酵结束,因此可在达到最高酸度之前分割取醋,避免醋酸菌的乙酸过氧化作用,保证苹果醋的品质和产物质量浓度。最终确定了分割时间分别为 36、66、85、140 h。
由图10可知,每次分割后发酵液酸度下降,醋酸菌在短时间内处于对新环境的适应期,产酸速度也较慢,但此后酸度变化较快并在较短时间内达到最高值。分割次数少于4次时,发酵达到最高酸度的时间随次数的增加越来越短,分别为36、29、20 h。因为当进行分割发酵时,不需要种子扩培过程,通过利用发酵罐中剩余的菌种起始发酵,可以实现半连续流加发酵生产;而且每次分割后补料使总酸下降,但起始酸度随分割次数逐渐提高,醋酸菌对高酸环境的适应变强,能在酸度越来越高的环境下迅速积累醋酸。但并不是分割次数越多越好,当140 h时进行第4次分割后,酸度长时间内无明显上升,反而有所下降,可能醋酸菌总数随分割次数增多而越来越低,能继续产酸的醋酸菌变少,导致总体生产强度下降[21],发酵结束。
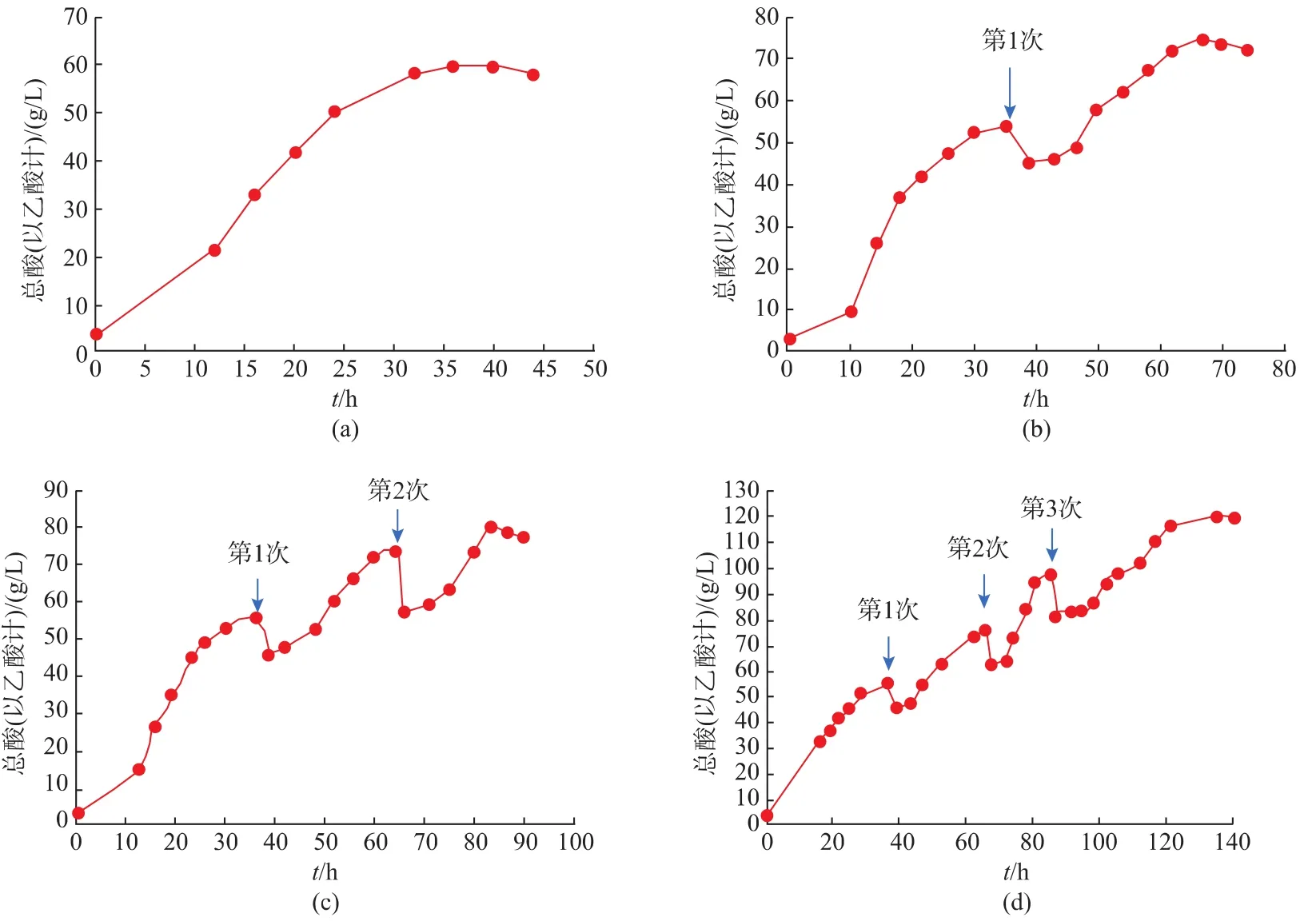
图9 分割时间的确定Fig.9 Determination of the multi-stage fermentation
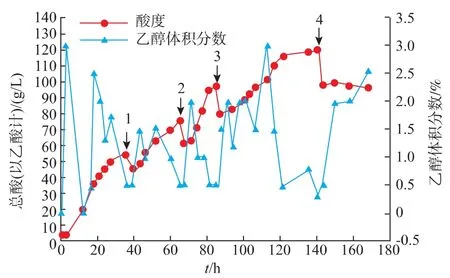
图10 分割次数对醋酸发酵的影响Fig.10 Influence of the multi-stage fermentation on the Acid Production
因此分别在36、66、85 h分割3次时,高酸度苹果醋发酵工艺最优,发酵第140 h时可生产总酸(以乙酸计)120 g/L苹果醋,是同菌种单批发酵总酸产量(图3a,61.6 g/L)的2倍,并经过多次实验说明该生产工艺可重复,菌株CYD159稳定性高,并具有较强的产酸能力。
3 结 语
以醋厂的醋酸发酵液、醋酸发酵醅为原料,通过平板初筛、定性实验、以及产酸能力和苹果醋发酵性能的比较,得到一株高产醋酸且产酸稳定的醋酸菌CYD159。经过菌种鉴定,该菌株为巴氏醋杆菌。采取流加发酵的方法,探究了底物乙醇体积分数和分割发酵的次数对苹果醋发酵的影响并对发酵工艺进行优化,结果表明,当发酵液初始乙醇体积分数为3%时,并通过调整流加速率,使罐内乙醇体积分数不超过3%,分别在36、66、85 h分割3次时,可得到总酸120 g/L的高酸度苹果醋。
综上,作者筛选得到了一株高产醋酸的醋酸菌并应用于高酸度苹果醋的酿造,经过流加发酵工艺参数的优化和多次实验,该生产工艺可靠,且菌株CYD159产酸能力强且稳定性高,为高酸度苹果醋的大规模生产提供一定的理论支持和技术依据。

