恒温实时荧光法快速检测不同样品中的单增李斯特菌
张文敏, 石育娇, 戚 成, 田明胜, 朱 智, 殷荣永,钟少水, 王大鹏, 何更生, 冯元琦, 董庆利*
(1.上海理工大学 医疗器械与食品学院,上海 200093;2.上海食品药品监督管理局,上海 200021;3.上海捷易生物科技有限公司,上海 201210;4.上海交通大学 农业与生物学院,上海 200240;5.复旦大学 公共卫生学院,上海 200433;6.广州迪澳生物科技有限公司,广州 510663)
单增李斯特菌是一种人畜共患的病原菌,在大多数食品中都能找到该菌。食品中存在的单增李斯特菌感染健康人体后主要表现为败血症、脑膜炎和单核细胞增生[1],因此,很多国家都已经采取措施来控制食品中的单增李斯特菌[2],我国也将单增李斯特菌定为进出口食品的重要检测卫生指标之一[3],并且在我国食品安全国家标准中也详细列出了单增李斯特菌的检验方法[4];国家标准检验方法虽然准确可靠,但存在检验周期长(最少需要4 d)和鉴定过程工作量大等不足,降低了食品安全监测效率和力度,不能满足临床快速诊断的需要。
随着现代分子生物技术的发展和广泛应用,对单增李斯特菌的检验方法从传统的生化分离鉴定过渡到以DNA探针技术、基因芯片技术、PCR等为主的现代分子生物技术手段[5-6]。目前,国内外许多临床机构已经将PCR技术应用于单增李斯特菌的快速检测,PCR方法敏感、快速,在实验室检测中应用最为广泛[7];但是该方法容易引起交叉污染,而且需要昂贵的仪器设备、较高检测费用以及对检测人员有较高的技术要求,难以在基层普及和推广[8]。
DNA环介导恒温扩增技术 (loop-mediated isothermal amplification,LAMP)分别使用一对外部引物和一对内部引物识别目的序列上6个特定区域,在等温条件下高效扩增核酸,1 h左右即可完成[9]。该方法不需要进行模板的预变性,减少了PCR技术升降温带来的影响以及对精密昂贵实验仪器的要求。LAMP阳性扩增反应会产生大量的类似花椰菜结构的产物和白色焦磷酸镁沉淀,可直接用肉眼观测或在反应体系中加入染料,根据颜色的变化进行判断。肉眼观测方法存在人为判断主观性,可能产生错检、漏检;加入染料法需要在LAMP反应终止时打开反应管的管盖,极易导致反应体系被污染,检测结果出现假阳性。为适应高灵敏度现场检测的需求,近年来基于LAMP技术开发的便携式实时恒温扩增仪已被应用于微生物快速检测中[10-12]。
作者以LAMP技术和荧光技术相结合,应用便携式荧光恒温扩增仪收集反应管内单增李斯特菌的核酸扩增荧光信号,获得实时核酸扩增生成量,进而确定待测样品中是否含有目的基因,探讨恒温实时荧光法快速检测乳制品中和临床腹泻样本中的单增李斯特菌的可行性,为进出口乳制品及临床诊断中单增李斯特菌的检测提供一种快速灵敏、简单经济、客观准确的方法。
1 材料与方法
1.1 材料与主要试剂
标准菌株单增李斯特菌 (ATCC 19116血清型4c):作者所在实验室保存;
Bst大片段 DNA聚合酶、0.8~1 mol/L甜菜碱、1.6~2 mmol/L dNTP、20~25 mmol/L Tris-HCl、10~12.5 mmol/LKCl、10 ~12.5 mmol/L(NH4)2SO4、8 ~10 mmol/L MgSO4、质量分数0.100%~0.125%TritonX-100、10~20 mmol/L pH 8.0 的 Tris-HCl、1~2 mmol/L EDTA、质量分数1.0%~1.2%Triton X-100和引物,荧光染料SYBR Green I,细菌基因组DNA快速提取试剂盒,广州迪澳生物科技有限公司产品;扩增缓冲液、DNA Ladder Marker、TGG:Takara 公司公司;质量分数0.8%NaCl溶液、0.6%酵母浸膏的胰酪胨大豆肉汤 (TSB-YE)、BHI培养基 (Brain Heart Infusion)、PALCAM单增李斯特菌选择性培养基、李氏增菌肉汤基础培养基(LB)、李斯特氏菌显色培养基、琼脂粉:北京陆桥生物技术责任有限公司产品。
1.2 仪器与设备
离心机、Deaou-308C型恒温扩增仪:广州迪澳生物科技有限公司产品;XW-80A型漩涡混合器:上海沪西分析仪器厂有限公司产品;YXQ-LS-75S11型灭菌锅:上海博讯实业有限公司产品;S·SW-CJ-IC型净化工作台:上海跃进医疗器械厂产品;MJ-250-(Ⅱ)型霉菌培养箱:上海跃进医疗器械厂产品;电磁炉:上海慧仪仪器厂产品;JJ500型电子天平:常熟市双杰测试仪器厂产品;100-1000 μL移液枪:德国Eppendorf公司产品;PCR仪(Gene Amp®PCR system 9700)、凝胶成像仪:香港Gene Company Limited基因有限公司产品。
1.3 菌株鉴定
为确保实验结果的可靠性,实验室保存的标准菌株在李斯特菌显色培养基上划线鉴定,以确保该菌没有未被污染。之后将该菌株分别以BHI、LB1和LB2营养肉汤为增菌液,在37℃摇床中培养24 h(培养至第四代), 用引物 (hly F:TGACGAAAT GGCTTACAGTG,hly R: AATGGGAACTCCTGGTGT T)对单增中的特异性基因hly进行PCR扩增。PCR扩增产物用琼脂糖凝胶电泳分析。
1.4 反应体系的建立
1.4.1 引物设计 LAMP引物序列由广州迪澳生物科技有限公司提供[13],该引物经检测具有特异性。

表1 扩增基因的LAMP引物序列Table1 Sequence of LAMP primers for amplification
1.4.2 DNA模板制备 分别取不同样品不同含菌浓度为1mL的增菌液,10000 r/min离心3 min,弃上清液;涡旋混匀DNA提取液,向沉淀中加入100 μL DNA提取液,涡旋混匀,100℃加热5 min;10000 r/min离心3 min,将上清液转移至新的离心管备用,即为DNA模板[14]。
1.4.3 LAMP反应体系的的配置 参考文献 [12]建立23 μL的反应体系包括:BstDNA聚合酶大片段(8U/μL),2 mmol/L dNTP,25 mmol/L Tris-Cl,12.5 mmol/L KCl,12.5 mmol/L(NH4)2SO4,10 mmol/LMgSO4,质量分数 0.125%TritonX-100,1 mol/L 甜菜碱,内引物FIP和BIP各2 mol/L和外引物F3/B3各 0.20~0.25 mol/L,pH 8.0 的 Tris-HCl 20 mmol/L,2 mmol/L EDTA和质量分数1.2%Triton X-100,0.2 μmol/L SYBR Green I。
1.5 灵敏度及最低检测限实验
实验室制备不同浓度的单增李斯特菌菌液(ATCC 19116血清型4c),用平板计数法测定菌浓度,以DNA提取液提取不同浓度单增李斯特菌的DNA,以各浓度梯度的2 μL DNA作为模板进行反应,检测该方法检测单增李斯特菌基因组DNA的灵敏度及最低检测限。
1.6 样品检测
1.6.1 乳制品样本检测 实验选取15份乳酪样本(前期检测均不含单增李斯特菌),利用该方法对其进行快速检测,同时利用国标(GB 4789.30-2010)法计数,以验证该方法的适用性[15]。
1.6.2 腹泻物样本检测 单增李斯特菌感染健康人群极易出现腹泻呕吐症状,临床治疗需要快速确定病人病因[16]。因此实验选取20份腹泻样本(前期检测均不含单增李斯特菌),利用该方法对其进行快速检测,同时利用国标(GB 4789.30-2010)法计数,以验证该方法的适用性。
1.7 扩增反应
在上述含有混匀LAMP反应体系的PCR管中分别加入2 μL各样品的DNA模板(加样顺序为阴性对照、待检样品、阳性对照),盖好管盖,10000 r/min离心30 s,上述阴性对照为无菌双蒸水,阳性对照为单核增生李斯特菌基因组DNA。取阴性对照、阳性对照及样品放入恒温扩增仪中,63℃反应45 min。
结果判定如下:若有“S”型扩增曲线且出峰时间<30 min,则判断为阳性,含有单增李斯特菌;若有“S”型扩增曲线且出峰时间≥30 min,则判断为可疑样本,需进行复检;若无“S”型扩增曲线,则判断为阴性,不含有单增李斯特菌或含量低于检测限。
2 结果与分析
2.1 菌株鉴定结果
凝胶成像结果如图1所示,使用引物 (hly F:TGACGAAATGGCTTACAGTG,hly R: AATGGGAA CTCCTGGTGTT)对实验样本接种菌株进行鉴定时,2泳道扩增出与预期大小(535 bp)一致的条带,进一步进行DNA测序,将序列拼接后在NCBI网站进行序列特异性比对,比对结果相似度为100%,判定实验样本接种菌株是单增李斯特菌标准菌株。

图1 实验接种菌株鉴定结果Fig.1 Identification ofLis.monocytogenes in the experimental samples by PCR analyses
2.2 灵敏度及最低检测限
采用国标法测定各浓度梯度的单增李斯特菌菌落浓度。以DNA提取液提取1.5所述各浓度下菌体的DNA,以各梯度的DNA模板进行反应,检测该方法对提取的基因组DNA的灵敏度及最低检测限。随机选取一组实验结果2,由图2可知,恒温实时荧光方法检测单增李斯特菌DNA的灵敏度可达到102CFU/ml。将各组实验扩增峰出现时间汇总,结果见表2。该方法检测单增李斯特菌基因组DNA的假阳性为0。102CFU/mL的基因组DNA为模板时,12份阳性样本检出率为75%,而103CFU/mL及以上浓度的基因组DNA为模板时,阳性检出率为100%,因此恒温实时荧光方法检测单增李斯特菌基因组DNA的最低检测限定为103CFU/mL。
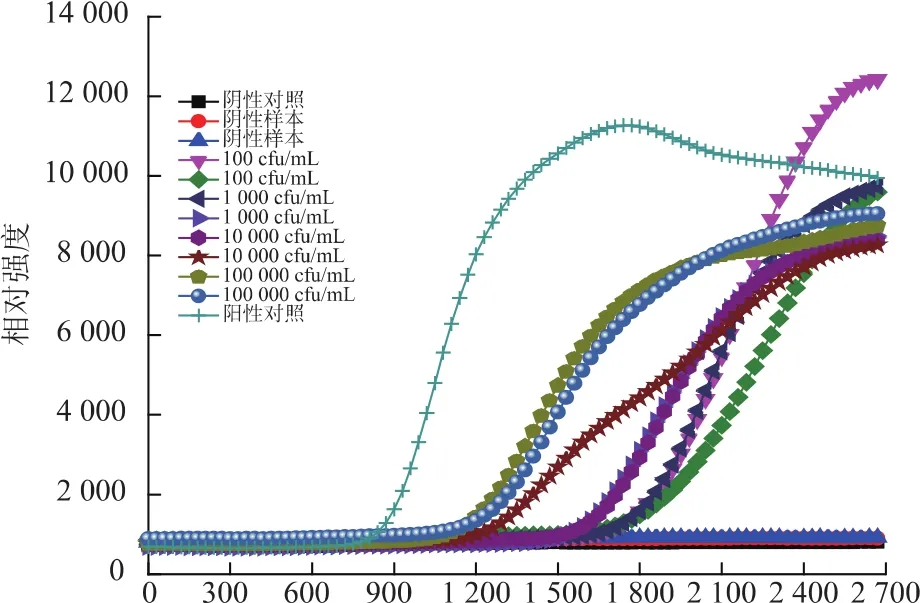
图2 恒温实时荧光法检测纯培养时单增李斯特菌基因组的灵敏度和检测限Fig.2 Sensitivity and detection limit on genomic DNA of Lis.monocytogenes in pure cultures by real time fluorescence isothermal amplification
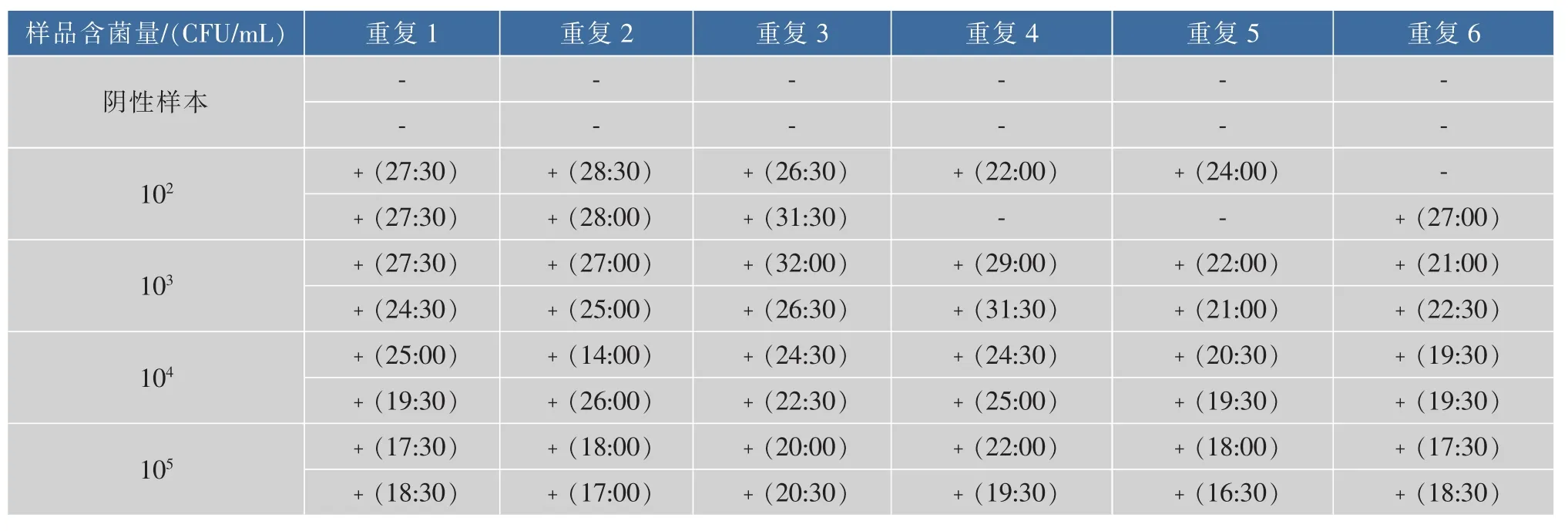
表2 恒温实时荧光法检测纯培养时单增李斯特菌的扩增峰出现时间Table2 Amplification peak of Lis.monocytogenes in pure cultures by real time fluorescence isothermal amplification
2.3 乳制品检测结果
采用国标法测定各浓度梯度的单增李斯特菌菌落浓度;用DNA提取液提取1.6.1所述各样本的菌体DNA;以各梯度的DNA作为模板进行反应,验证该方法对乳制品中单增李斯特菌快速检测的适用性,随机选取一组实验结果如图 3,结果表明,恒温实时荧光方法检测单增李斯特菌污染的乳制品样品,灵敏度可达102CFU/ml。
由表3可知,该方法检测乳制品中单增李斯特菌DNA的假阴性为0.02%,其中有两份是可疑样品,复检后结果表现为阳性;在增菌液浓度为102CFU/mL,乳制品中单增李斯特菌的检出率为83%;在增菌液浓度为103CFU/mL及以上浓度时,乳酪中单增李斯特菌的检出率接近100%;因此检测限规定为103CFU/mL。其中在增菌液浓度为104CFU/mL时,出现了假阴性,这可能与DNA提取、反应体系配置及加样过程等的实验操作有关,需要实验人员操作过程细心谨慎。在阴性样本检测时,出现了假阳性现象,这可能是操作过程中样品被污染有关;因此,在恒温实时荧光法检测单增李斯特菌时要注意样品配置、DNA提取、反应体系配置及加入DNA模板过程分区进行,且实验过程要保持通风,以提高实验准确率。
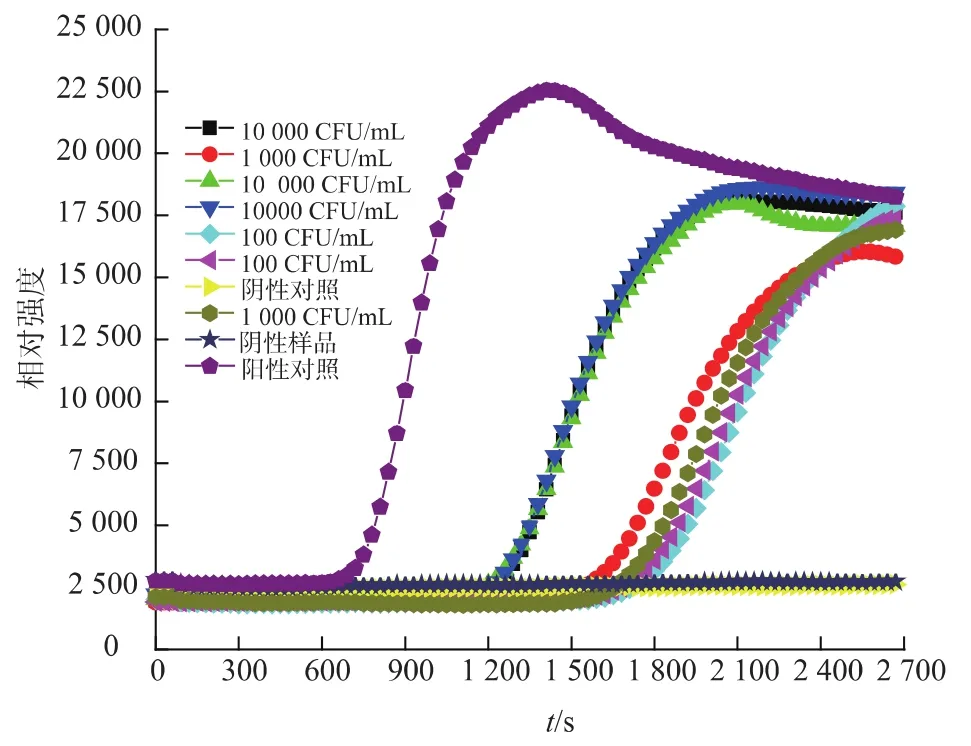
图3 恒温实时荧光法检测乳制品中单增李斯特菌基因组的灵敏度和检测限Fig.3 Sensitivity and detection limit on genomic DNA of Lis.monocytogenes in dairy products by real time fluorescence isothermal amplification
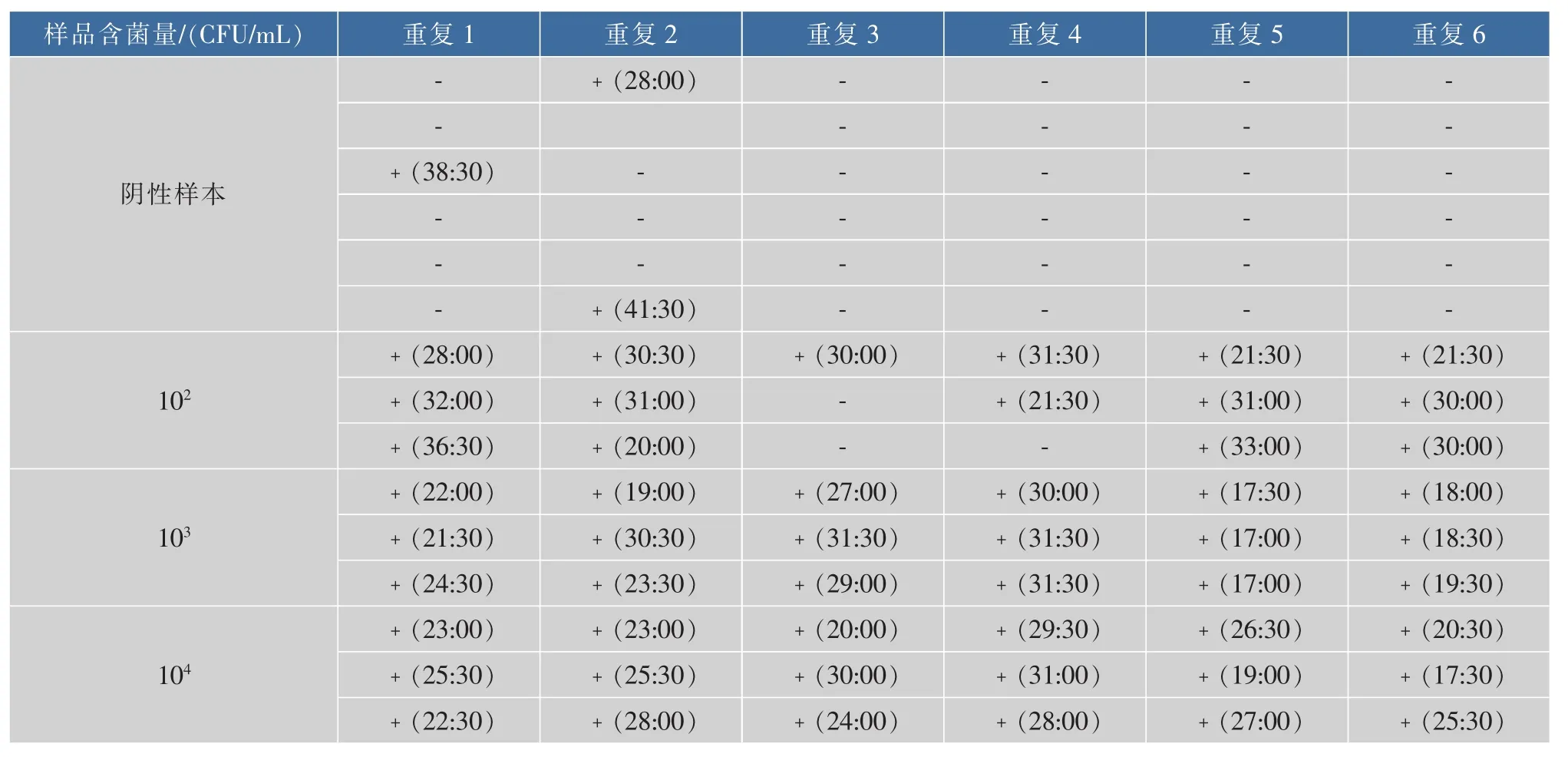
表3 恒温实时荧光法检测乳制品中单增李斯特菌的扩增峰出现时间Table3 Amplification peak of Lis.monocytogenes in dairy products by real time fluorescence isothermal amplification
2.4 腹泻样品检测结果
由前面实验结果可知恒温实时荧光法检测单增李斯特菌基因组DNA的检测限为103CFU/mL,因此在进行腹泻样本检测时直接污染腹泻样品至单增李斯特菌浓度为103~104CFU/mL,用DNA提取液提取1.6.2所述各样本的菌体DNA作为模板进行反应,验证该方法对临床腹泻样本中单增李斯特菌快速检测的适用性;随机选取一组实验结果如图4所示,表明所有阳性样本均能在30 min之前出现扩增峰。样本扩增峰出峰时间见表4。所有被检阴性样本均未出现假阳性现象,因此将LAMP技术和荧光技术相结合,应用便携式时荧光恒温扩增仪对单增李斯特菌进行快速检测,可有效降低假阳性现象发生。阳性样品检出率为92%,其中未被检出的阳性样本主要出现在其中一组实验中,在进行国标法对这些阳性样本进行计数时发现只有几个菌落生长,因此判断是对样本接种菌液时出现了问题。
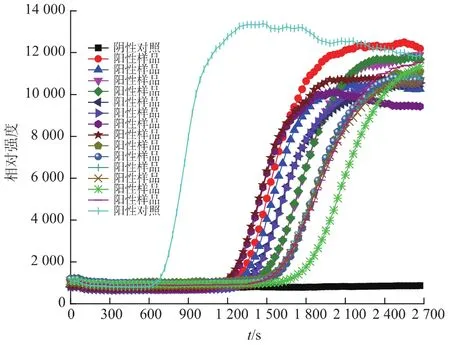
图4 恒温实时荧光法检测腹泻样品中单增李斯特菌基因组的灵敏度Fig.4 Sensitivity and detection limit on genomic DNA of Lis.monocytogenes in clinical diarrhea by real time fluorescence isothermal amplification

表4 恒温实时荧光法检测腹泻样品中单增李斯特菌的扩增峰出现时间Table4 Amplification peak of Lis.monocytogenes in dairy products by real time fluorescence isothermal amplification
3 结 语
1)以LAMP技术和荧光技术相结合,应用便携式时荧光恒温扩增仪通过采集荧光信号对扩增产物实时监控,比传统的检测浊度的LAMP技术更加灵敏、准确,快速,整个实验可在45 min内完成;整个扩增过程在闭合管道中进行,减少荧光法检测LAMP结果产物时,因开盖添加染料导致反应体系被污染,产生假阳性结果的概率;而且该仪器可精确地控制反应温度和时间,并且通过可视化软件直接将扩增结果数据化、自动化、形象化,可实验对检测样本实时监控。
2)恒温实时荧光快速检测方法检测实验室纯培养、乳制品样品和临床病人腹泻样本中单增李斯特菌,其灵敏度均可达到102CFU/mL,检测限均为103CFU/mL;假阳性率很低,分别为 0、0.03%、0,在检测限及以上浓度时,阳性检出率分别为100%、99%、92%;综上所述,单增李斯特菌的恒温实时荧光快速检测方法灵敏度高、准确性高、操作简单、反应速度快、成本较低、稳定性较好,并且可以实时观察扩增情况,为单增李斯特菌的快速检测提供了新方向。
3)在实验过程中要尽可能防止污染,避免假阳性出现。

