苦水玫瑰干花蕾中总黄酮的提取工艺及其主要成分的测定
陈继华 , 王 波 , 刘倩倩 , 周 围 *,
(1.甘肃农业大学 食品科学与工程学院,甘肃 兰州 730070;2.甘肃出入境检验检疫局 综合技术中心,甘肃 兰州730010;3.甘肃检科院 玫瑰工程技术研究中心,甘肃 兰州730010)
玫瑰(Rosa ragosa)为蔷薇属植物,是一种集观赏、食用、药用、酿酒及香料等多种用途于一身的植物资源。苦水玫瑰是中国玫瑰和钝齿蔷薇的杂交种,盛产于甘肃永登苦水镇,耐碱耐旱。苦水玫瑰花色泽殷红,品质可与久负盛名的大马士革玫瑰媲美。同时,玫瑰花蕾作为花茶具有消炎杀菌、消除疲劳、改善体质、润泽肌肤的功效[1]。研究表明:苦水玫瑰富含黄酮类及多酚类化合物,黄酮类化合物是玫瑰花中最重要的活性成分之一,具有清除自由基、抗氧化、抗衰老等作用[2-4]。此外,苦水玫瑰中的黄酮还可以抑制红细胞溶血和脂质过氧化过程,具有体外抗补体作用[5-6]。目前由于国内外比较注重玫瑰挥发油的开发和利用,而对玫瑰总黄酮的研究相对比较少,且多采用超声波辅助进行总黄酮的提取,虽然提取时间较短,但是运行成本高,仅限于小型实验研究而难以对其进行工业化生产。另外,玫瑰总黄酮的提取材料多使用平阴玫瑰,对苦水玫瑰总黄酮的提取鲜有研究[7-8]。
对于黄酮类化合物的检测,通常使用液相色谱[12-14]、液相色谱串联质谱[15-16]以及紫外分光光度法[17-18]等。超高效合相色谱法(UPC2)是传统超高效液相色谱(UPLC)和超临界流体色谱(SFC)技术的结合,主要使用超临界CO2为流动相的主体,依靠流动相的溶剂化能力进行分离、分析;因超临界CO2相对于液体作为流动相的传统液相色谱来说,它具有较小的粘度、较高的扩散系数和传质速率,在分离操作时所用的时间短,单位时间内分离效能高[19-20]。作者在使用响应面分析法优化检测苦水玫瑰总黄酮含量的同时,还使用了区别于传统液相色谱(LC)和气相色谱(GC)的超高效合相色谱(UPC2)检测苦水玫瑰总黄酮中的槲皮素和山奈酚的含量,为黄酮类化合物的检测提供新的方法及思路,并为干制苦水玫瑰的质量评价提供理论依据。
1 材料与方法
1.1 材料与试剂
苦水玫瑰花:摘自甘肃检科院玫瑰工程技术研究中心实验基地,80℃热风烘干,密封备用。
芦丁标准品(纯度>98%):中国药品生物制品检定所提供;槲皮素、山奈酚 (纯度 99%):Dr.Ehrenstorfer公司产品。
1.2 仪器与设备
超高效合相色谱仪(配有Waters EmpowerTM3数据处理系统):美国Waters公司产品;Lambda 25UV紫外可见分光光度计:美国珀金埃尔默公司产品;多功能偏程干燥箱:德国memmert公司产品;冷冻离心机:德国Sigma公司产品;均质机:美国Tomtec公司产品;移液枪:美国Thermo Electron公司产品。
1.3 试验方法
1.3.1 芦丁标准曲线绘制 准确称取于120℃烘至恒重的芦丁标准品25.0 mg,用体积分数为70%的乙醇溶液定容于25 mL容量瓶中,得到质量浓度1 mg/mL的芦丁标准液,准确移取芦丁标准液1.0、2.0、3.0、4.0、5.0 mL 于 50 mL 容量瓶中, 依次加入质量分数5%NaNO2溶液0.5 mL,摇匀静置5 min后,加入质量分数10%硝酸铝溶液0.5 mL,摇匀静置5 min后,加入质量分数4%氢氧化钠溶液4 mL摇匀,用体积分数70%乙醇定容至50 mL,摇匀静置15 min,用1 cm比色皿于510 nm测定样品吸光度。以芦丁质量浓度C(mg/mL)为纵坐标,吸光度A为横坐标,绘制标准曲线拟合方程为C=0.0599A-0.0003,相关系数R2=0.9993,表明在0.02~0.10 mg/mL范围内,线性关系良好。
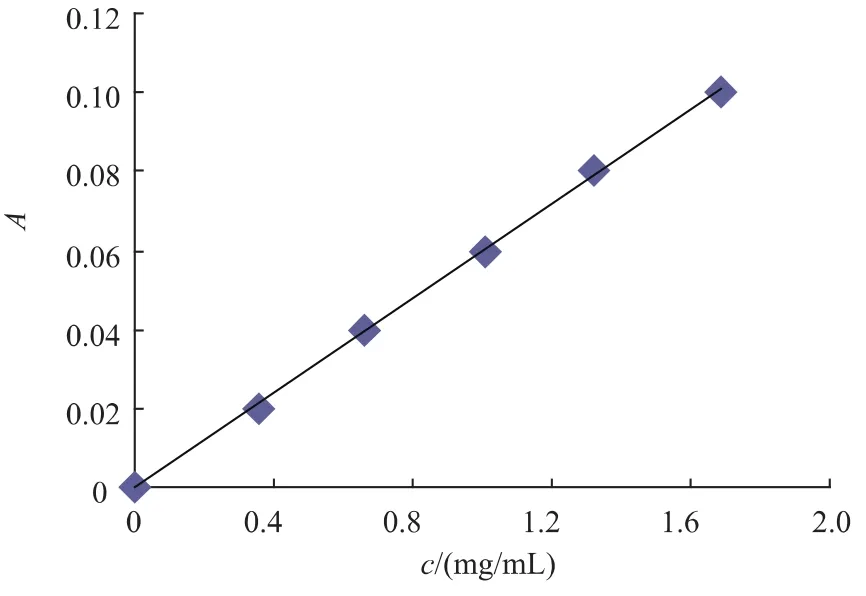
图1 芦丁标准曲线Fig.1 Standard curves of rutin
1.3.2 总黄酮的提取 苦水玫瑰花蕾于80℃烘干后粉碎(60目),准确称取1.0 g玫瑰粉末于50 mL离心管中,加入15 mL体积分数为70%的乙醇,置于漩涡振荡器上摇匀,然后在70℃恒温水浴振荡条件下提取30 min,冷却后在4℃下10000 r/min离心10 min,取上清液1.0 mL过0.22 μm有机相膜后待UPC2分析;另移取1.0 mL于15 mL离心管中,按照芦丁标准曲线测定方法测定吸光度。每个样品重复3次。
1.3.3 标准溶液配制 标准贮备液:分别精确称取0.010 g槲皮素和山奈酚,用含质量分数0.05%H3PO4的体积分数80%乙醇溶液,准确定容至100 mL容量瓶中,配制成100 mg/L的标准储备液,4℃下冷藏待用。
标准工作液: 准确转移 1000、750、500、250、100、50、25 μL 标准贮备液分别稀释为 100、75、50、25、10、5、2.5 mg/L 的标准工作液,4 ℃下冷藏待用。
1.3.4 UPC2条件 色谱柱:Waters CSH Fluoro-Phenyl C182.1 mm×100 mm×1.7 μm; 流动相:A:CO2,B:甲醇(含质量分数 0.2%H3PO4);流量:0.4 mL/min,进样体积:1.0 μL,柱温:50 ℃,检测波长:360 nm,动态背压(ABPR):12.4 MPa。
梯度洗脱:0~0.25 min时甲醇体积分数为20%,25 min时甲醇体积分数由20%变为35%,27 min时甲醇体积分数由35%变为20%,保持3 min。标准色谱图及样品图见图2。

图2 标准色谱图及样品图Fig.2 Chromatography of standards and sample
2 结果与讨论
2.1 单因素实验
2.1.1 提取溶剂的选择 控制提取条件在液料体积质量比15 mL/g、提取温度70℃、提取时间90 min的条件下,分别在乙醇体积分数为60%、70%、80%、90%和100%的条件下提取苦水玫瑰中总黄酮。以总黄酮质量分数为考察指标,研究提取溶剂对苦水玫瑰总黄酮提取率的影响,选取最适提取溶剂。从图3中可以看出,乙醇体积分数为60%~70%时,黄酮质量分数在逐渐增大,在70%时达到最大值,随后逐渐降低。由此可以得知乙醇体积分数为70%时提取效果较好。
2.1.2 液料体积质量比的选择 控制提取条件在乙醇体积分数70%、提取温度70℃、提取时间90 min的条件下,分别在液料体积质量比为10、15、20、25、30 mL/g的条件下提取苦水玫瑰中的总黄酮。以黄酮质量分数为考察指标,研究液料体积质量比对苦水玫瑰总黄酮提取率的影响,选取最适液料体积质量比。从图4中可以看出,液料体积质量比为10~15 mL/g时,黄酮质量分数在逐渐增大,液料体积质量比为15 mL/g时达到最大值,随后逐渐降低。由此可以得知液料体积质量比为15 mL/g时提取效果较好。
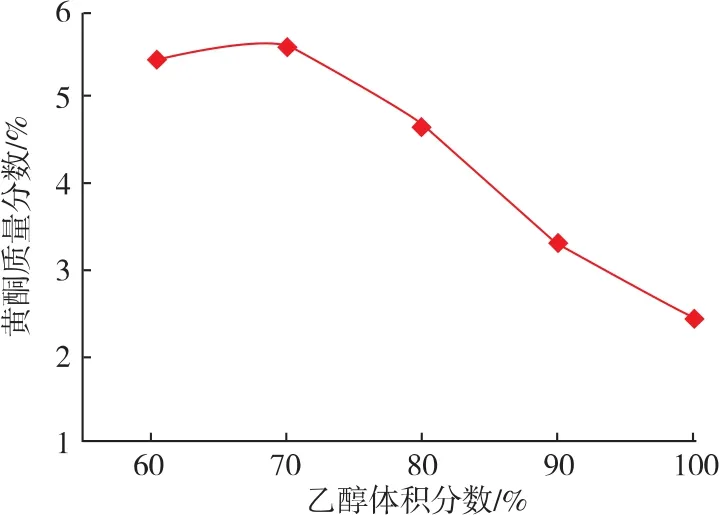
图3 不同乙醇体积分数对黄酮质量分数的影响Fig.3 Effect of ethanol concentration on the extraction rate of total flavonoids

图4 不同液料体积质量比对黄酮质量分数的影响Fig.4 Effect of material-liquid ratio on the extraction rate of total flavonoids
2.1.3 提取温度的选择 控制提取条件在乙醇体积分数70%、液料体积质量比15mL/g、提取时间90min的条件下,在提取温度为40~95℃的条件下提取苦水玫瑰中总黄酮。以黄酮质量分数为考察指标,研究提取温度对苦水玫瑰总黄酮提取率的影响,选取最适提取温度。从图5中可以看出,随着提取温度的升高,黄酮质量分数在逐渐增大,在提取温度为40~70℃时显著增大,在70℃以后呈平稳状态。由此可以得知提取温度为70℃时提取效果较好。
2.1.4 提取时间的选择 控制提取条件在乙醇体积分数70%、液料体积质量比15 mL/g、提取温度70℃的条件下,分别在提取时间为30~150 min的条件下提取苦水玫瑰中总黄酮。以黄酮质量分数为考察指标,研究提取时间对苦水玫瑰总黄酮提取率的影响,选取最适提取时间。从图6中可以看出,提取时间为30~90 min时,黄酮质量分数逐渐增大,时间为90 min时达到最大值,随后逐渐降低。由此可以得知提取时间为90 min时提取效果较好。

图5 提取温度对黄酮质量分数的影响Fig.5 Effect of extraction temperature on the extraction rate of total flavonoids
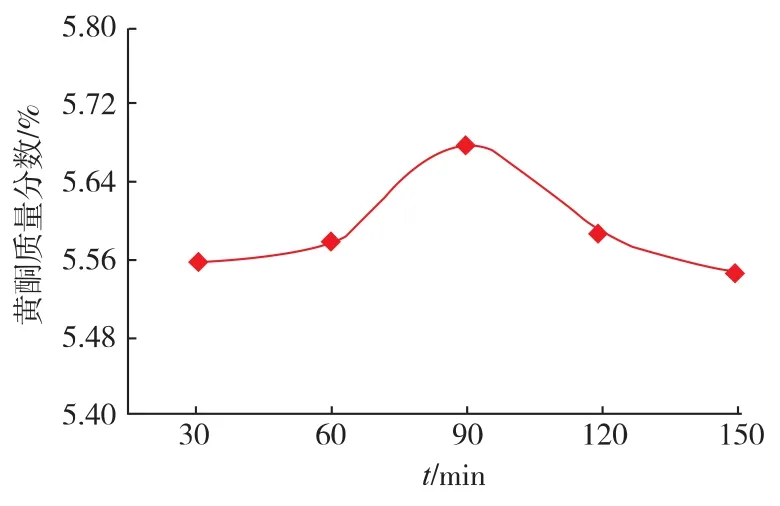
图6 提取时间对黄酮质量分数的影响Fig.6 Effect of extraction time nn the extraction rate of total flavonoids
2.2 响应面实验
根据单因素实验,同时考虑到总黄酮提取过程中温度的变化规律,鉴于温度在70℃之后呈平稳状态,为了节约能源,直接选取70℃为最佳提取温度,选择3因素3水平进行响应面实验,以黄酮质量分数为响应值,采用中心组合设计,得到3因素3水平优化模型共17个试验组,其中中心点“0”水平重复5次以计算误差。各因素与水平的设计如表1所示,实验结果见表2。

表1 响应面分析因素与水平Table1 Experimental design and results for response surface analysis

表2 实验设计及结果Table2 Design and results
Box-Behnken设计回归分析结果显示,总黄酮质量分数与各个因素之间的关系为:y=5.73+0.14A+0.031B-0.51C+0.032AB+0.11AC-0.030BC-0.22A2-0.023B2-0.62C2,决定系数R2=0.9980,说明该回归模型的拟合情况较好,试验值与预测值较为接近,模型的可靠性可通过方差分析及相关系数来考察。
响应面方差分析表见表3。
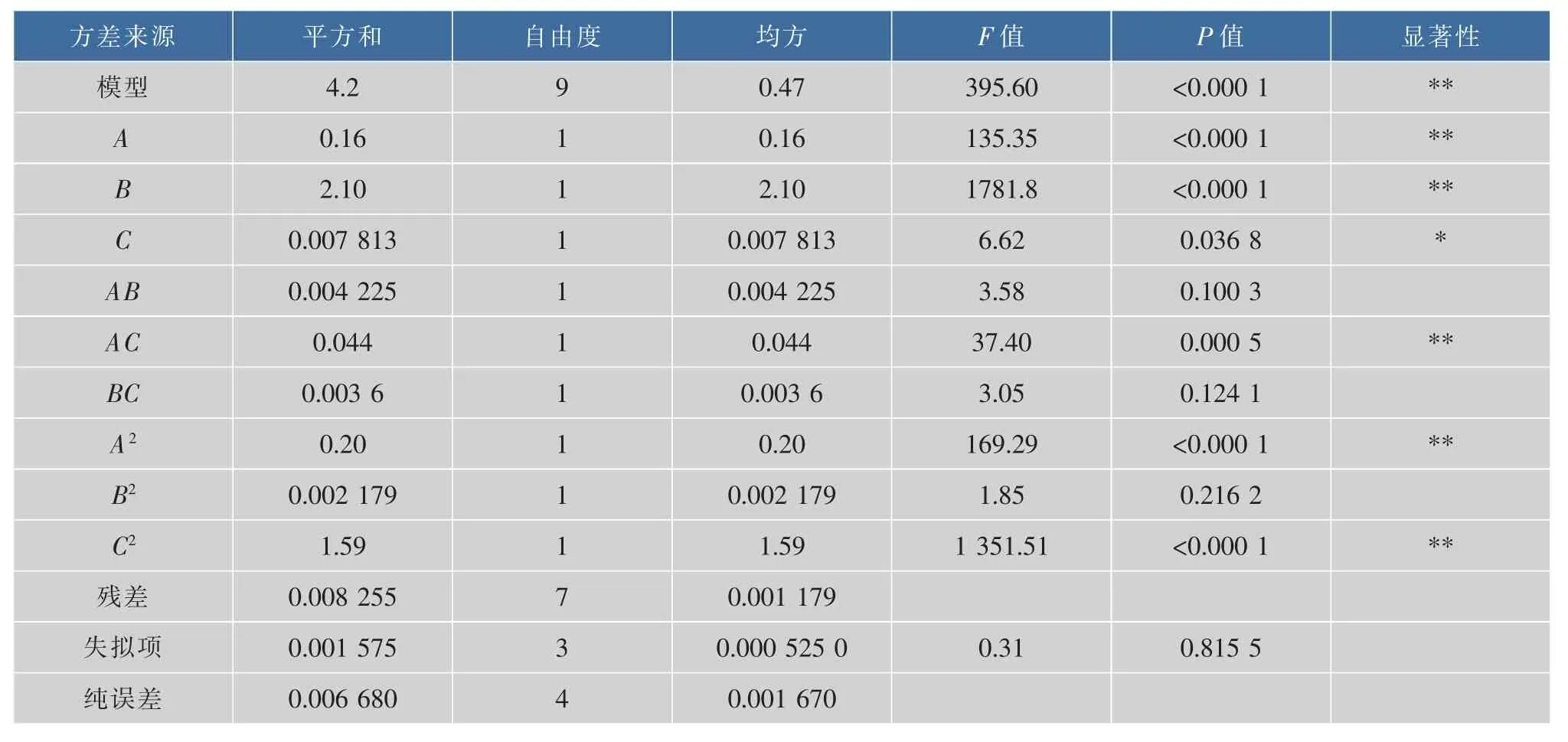
表3 回归分析结果Table3 Results of variance analysis
由表3可知模型P<0.0001,表明模型极显著,失拟项P=0.8155>0.05不显著,说明该模型拟合程度良好,可以用此模型对苦水玫瑰总黄酮的超声辅助提取效果进行分析和预测。由回归模型系数显著性检验结果可知,模型的一次项A(液料体积质量比)、B(乙醇体积分数)、二次项A2、C2和交互项AC均对苦水玫瑰中总黄酮提取的线性效应极显著;一次项C(提取时间)对苦水玫瑰中总黄酮提取的曲面效应显著;交互项AB、BC对苦水玫瑰中总黄酮提取的曲面效应不显著。
模型响应曲面见图7~9。从响应面分析图上看出最佳参数及各参数之间的相互作用。
对模型方程解逆矩阵得苦水玫瑰中总黄酮提取最佳工艺为:液料体积质量比16.49 mL/g,乙醇体积分数65.85%,提取时间120 min。为检验试验结果与实际情况是否相一致,对上述条件进行修正后进行验证,即:液料体积质量比16 mL/g,乙醇体积分数66%,提取时间120 min。用此最佳试验条件重复3次,得到平均总黄酮质量分数为5.85 mg/g,与理论最佳总黄酮质量分数5.87 mg/g基本一致。

图7 液料体积质量比和时间对黄酮质量分数的交互作用的响应曲面Fig.7 Response surface plot showing the interactive effects of extraction ratio and time on the content of total flavonoid
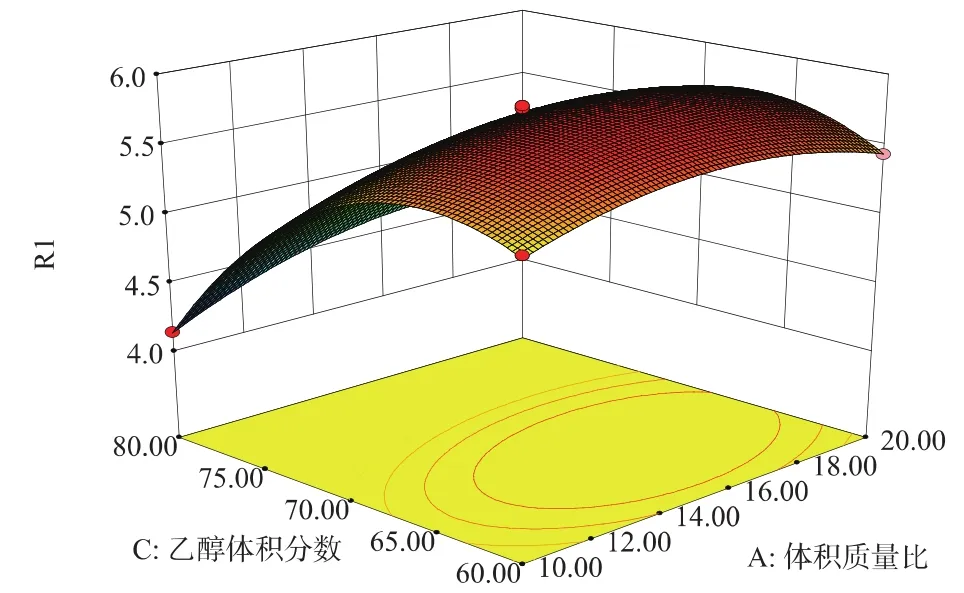
图8 液料体积质量比和乙醇体积分数对黄酮质量分数的交互作用的响应曲面Fig.8 Response surface plot showing the interactive effects of extraction ratio and ethanol?concentration on the content of total flavonoids
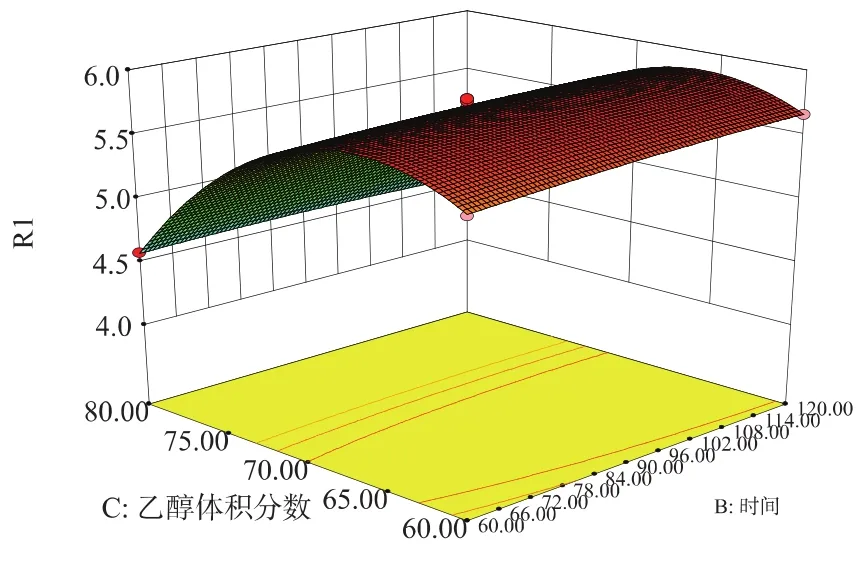
图9 乙醇体积分数和时间对黄酮质量分数的交互作用的响应曲面Fig.9 Response surface plot showing the interactive effects of ethanol concentration and time on the content of total flavonoids
2.3 UPC2方法学考察
2.3.1 线性范围和灵敏度 在优化实验条件下,选取 100、75、50、25、10、5、2.5 mg/kg 的槲皮素和山奈酚系列混合标准溶液按“1.7色谱条件”进行测定。结果表明,该方法在5.0~100 mg/kg范围内有较好的线性关系,线性相关系数分别为R2=0.9989及0.9993。该方法对槲皮素和山奈酚的检出限(LOD)分别为0.75 mg/kg和1.25 mg/kg,定量限(LOQ)分别为2.5 mg/kg和3.75 mg/kg。
2.3.2 回收率和精密度 分别准确称取1.00 g粉碎后的烘干苦水玫瑰花,分别加入高、中、低3个质量分数(5、50、100 mg/kg)的槲皮素和山奈酚混合标准溶液,置于50 mL聚乙烯管中,分别按照最佳提取条件和“1.7色谱条件”进样测定,计算其回收率。结果表明,该方法的加标回收率在96.05%~101.15%之间,相对标准偏差 (RSD)为0.52%~1.76%。方法的回收率和重现性均较好。
2.3.3 稳定性实验 取同一份苦水玫瑰供试品溶液, 每隔 0、l、5、10、24 h 进样 l.0 μL 测定槲皮素和山奈酚的质量分数,其相对标准偏差 (RSD)为3.17%,表明槲皮素和山奈酚在24 h内基本稳定。
2.3.4 实际样品测定 作者利用上述最佳优化条件,分别称取5个不同批次的烘干苦水玫瑰花10.00 g,粉碎后称取1.00 g,置于50 mL聚乙烯管中,分别按照最佳提取条件和“1.7色谱条件”进样测定,结果见表4,色谱图见图2。

表4 不同批次烘干玫瑰花蕾中槲皮素和山奈酚的质量分数Table4 Contents of quercetin and kaempferol in different batches of dried rose
3 结语
响应面分析法在优化中药提取工艺方面具有一定的优势。在使用UPC2检测总黄酮中槲皮素和山奈酚中,由于UPC2的分离机理与传统液相色谱不同,在分离总黄酮中槲皮素和山奈酚的过程中,具有效率高、成本低、所需时间短、测定结果准确等特点。该方法准确可靠,重现性好,可用于苦水玫瑰花中主要活性成分含量的分析与质量控制,具有很好的实用价值。
——苦水“二月二”社火组照

