线粒体融合蛋白2在姜黄素减轻脓毒症小鼠淋巴细胞凋亡中的作用
支绍册 郑来赞 洪广亮 陈隆望 李海啸 倪菁晶 李萌芳 赵光举 卢中秋
脓毒症是宿主对感染反应失调而导致器官功能障碍的疾病状态,已成为全球日益严重的健康问题[1-2]。尽管早期液体复苏、新型抗生素和器官功能支持等治疗措施使治疗效果有了重大进步,但脓毒症的死亡率仍然居高不下,达30%~50%[3-4]。姜黄素是姜黄的主要活性成分之一,具有抗炎、抗氧化、抗诱变等作用,并且对免疫系统有着重要调节作用,可降低脂多糖(LPS)诱导脓毒症小鼠的病死率[5-8]。线粒体融合蛋白 2(mitofusin2,Mfn2)位于线粒体外膜中,在线粒体融合/分裂的动态平衡中及维持线粒体和细胞功能方面发挥重要作用,具有抗细胞凋亡作用,包括卵巢、神经元和缺血/再灌注损伤后的心脏[9-13]。笔者前期研究发现,姜黄素可以明显减少脓毒症小鼠T淋巴细胞的凋亡,并且能够上调T淋巴细胞Mfn2表达[14-15]。因此,本研究通过构建小鼠盲肠结扎穿孔(cecal ligation and puncture,CLP)模型,利用腺相关病毒转染调控Mfn2表达,观察Mfn2在姜黄素干预脓毒症T淋巴细胞凋亡中的作用,从线粒体融合和切割的角度揭示姜黄素在脓毒症时对细胞免疫的调节机制。
1 材料和方法
1.1 实验动物 成年健康雄性Balb/c小鼠165只,体重20~25g,由温州医科大学实验动物中心提供,许可证编号:SYXK(浙)2015-0009。25°C 恒温(湿度 50%)和12h光照/12h黑暗周期性变化条件下饲养。适应环境7d后,随机分成以下8组:假手术组、脓毒症组、姜黄素干预组、姜黄素对照组、Mfn2干扰脓毒症组、Mfn2干扰姜黄素治疗组、阴性对照病毒脓毒症组、阴性对照病毒姜黄素组,每组15只;剩余小鼠随机分为正常组、阴性病毒组、Mfn2干扰组,用于检测病毒转染效率,每组15只。通过CLP诱导小鼠脓毒症模型[16]。给予水但不给食物过夜后,予戊巴比妥钠40~80mg/kg麻醉小鼠。将暴露的盲肠从自由端1cm处结扎,并在中间用21G针刺破,粪便被压出以确保穿刺的通畅性。然后返回肠环,关闭腹壁。此后,皮下给予0.9%氯化钠注射液1ml进行液体复苏。假手术组除了盲肠未结扎或穿刺外,对小鼠进行相同的手术。在最初6h内,存活率为100%,且小鼠出现抑郁和腹泻等典型症状,表明建模成功。CLP后72h的病死率约为40%~60%。姜黄素干预组及姜黄素对照组予灌胃姜黄素200mg/(kg·d)1周(姜黄素溶解在玉米油中),阴性病毒脓毒症组及阴性病毒姜黄素组通过尾静脉注射阴性腺相关病毒建立模型,Mfn2干扰脓毒症组及Mfn2干扰姜黄素组通过尾静脉注射携带Mfn2干扰序列腺相关病毒建立模型。
1.2 主要试剂和仪器 线粒体膜电位检测试剂盒(上海碧云天生物技术研究所);姜黄素(美国Sigma公司);玉米油(上海太阳能生物科技有限公司)。凋亡试剂盒(美国BD公司);小鼠脾脏组织淋巴细胞分离液(天津市灏洋生物制品科技有限责任公司);BCA蛋白浓度测定试剂盒(美国Thermo Scientific公司);兔抗小鼠Mfn2单抗(英国 Abcam 公司);兔抗小鼠 Bcl-2、Bax、β-actin单抗、山羊抗兔二抗(美国Cell Signaling Technology公司)。
1.3 方法
1.3.1 腺相关病毒的构建和转染 携带Mfn2干扰序列的腺相关病毒载体由中国上海吉凯公司构建。根据制造商的说明,阴性病毒组小鼠将阴性病毒液通过尾静脉注射滴度为1.38×1012g/ml的腺相关病毒,Mfn2干扰组用同样方法注射携带eGFP的滴度为3.32×1012g/ml重组腺相关病毒。2周后,采用颈椎脱臼法处死小鼠,固定、消毒后取小鼠脾脏,进行冰冻切片后于荧光显微镜下观察脾脏组织荧光强弱。通过Western blot法检测阴性病毒以及下调后脾脏淋巴细胞的Mfn2表达水平,Western blot法检测步骤见1.3.3。通过以上方法检测腺相关病毒的转染效率。转染成功后,取阴性病毒脓毒症组、阴性病毒姜黄素组、Mfn2干扰组脓毒症组、Mfn2干扰组姜黄素组小鼠脾淋巴细胞进行流式细胞术检测细胞凋亡情况。
1.3.2 脾单个核细胞的分离 8组小鼠CLP建模后24h采用颈椎脱臼法处死,固定、消毒后取小鼠脾脏,置于含有预冷PBS的培养皿中,转移到超净台,剥去脾脏被膜并放至大培养皿上的400目筛网上,轻轻研磨,用PBS冲洗、过滤,收集细胞悬浮液。1 500r/min离心10min,弃上清液。以4ml PBS重新悬浮细胞,加入4ml小鼠器官淋巴细胞分离液,差速离心机3 000r/min离心15min,取第二层雾化细胞层,以预冷的PBS洗涤2次,细胞计数板进行计数。
1.3.3 Western blot法检测 Caspase-3、Bcl-2、Bax 蛋白表达水平 细胞收集后,用预冷的裂解缓冲液裂解细胞,用超声波细胞破碎机将细胞破碎3次,然后在4℃以14 000r/min离心20min。使用BCA方法检测上清液中的蛋白质浓度后将蛋白质与适当的SDS上样缓冲液混合,然后在95℃下煮沸5min。在10%十二烷基硫酸钠-聚丙烯酰胺凝胶中分离蛋白质,随后转移到聚偏二氟乙烯膜(PVDF)上。在室温下用5%脱脂乳封闭2h后,将膜与抗-Mfn2(1:1 000)和抗 β-actin(1∶1 000)抗体在4℃下过夜孵育。此外,孵育Caspase-3、Bcl-2、Bax抗体需要12%Tris-HCl十二烷基硫酸钠-聚丙烯酰胺凝胶。然后,与辣根过氧化物酶-(HRP-)缀合的山羊抗兔二抗(1∶5 000)在室温下孵育1h。TBST洗涤后,使用ECL显影,用图像分析系统分析条带灰度值。
1.3.4 流式细胞术分析细胞凋亡情况 通过离心收集的细胞(以1 000r/min离心8min)用PBS洗涤细胞2次(以1 000r/min离心8min),并收集约5×105个细胞。随后,加入500μl 1×结合缓冲液悬浮细胞,然后加入5μl的膜联蛋白V-FITC和5μl的 PI,在室温下混合,避光,并孵育反应15min。在1h内通过使用FACSCalibur(BD Biosciences,Mountain View,CA)流式细胞仪分析各组小鼠脾脏T淋巴细胞,计算细胞凋亡率。
1.3.5 线粒体膜电位 取5×105个细胞,重悬于0.5ml PBS中,加入0.5ml JC-1染色工作液,倒置数次混合,然后置于37℃的细胞培养箱中20min。孵育后,将细胞在4℃下以600g离心4min,沉淀细胞,除去上清液,用预冷的1×JC-1染色缓冲液洗涤细胞2次,然后重悬于适当的JC-1染色缓冲液。JC-1有单体和多聚体两种存在状态,以单体存在时,流式细胞术可检测到绿色荧光,而以多聚体存在时,流式细胞术可检测到红色荧光。JC-1单体和多聚体之间转变可逆,当细胞凋亡增加时,多转变为单体状态。在1h内通过使用FACSCalibur流式细胞仪分析各组小鼠脾脏T淋巴细胞。

图1 腺相关病毒介导下调Mfn2(a:正常组;b:阴性病毒组;c:Mfn2干扰组)
1.4 统计学处理 应用SPSS 22.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验;两组间比较采用两独立样本t检验;计数资料组间比较采用χ2检验。P<0.05为差异有统计学意义。
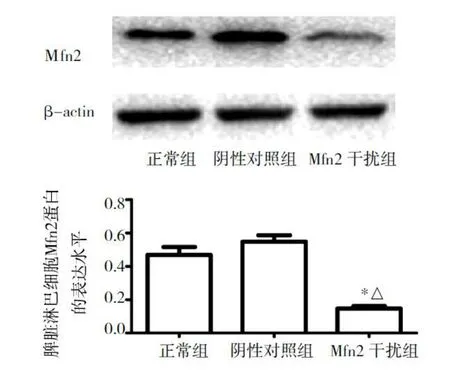
图2 3组小鼠脾脏淋巴细胞Mfn2表达水平的比较(与正常组比较,*P<0.05;与阴性对照组比较,△P<0.05)
2 结果
2.1 Mfn2干扰腺相关病毒转染效率的验证 小鼠尾静脉注射携带eGFP的腺相关病毒后,在荧光显微镜下观察发现,与正常组相比,Mfn2干扰组小鼠脾脏可见明显的绿色荧光(图1,插页),提示病毒已转染小鼠脾脏组织。提取小鼠脾脏淋巴细胞通过Western blot检测Mfn2干扰组小鼠转染效率为0.156±0.027,相对于正常组小鼠的0.423±0.113明显降低(P<0.01),下调程度>60%,说明Mfn2下调有效,可用于后续实验(图2)。
2.2 姜黄素干预对脓毒症T淋巴细胞凋亡的影响 假手术组、脓毒症组、姜黄素干预组以及姜黄素对照组T淋巴细胞凋亡率分别为(21.017±8.564)%、(50.733±6.802)%、(29.020±0.563)%、(29.810±1.745)%,4 组凋亡率比较差异有统计学意义(P<0.05)。进一步两两比较发现,脓毒症组淋巴细胞凋亡率较假手术组明显增加(P<0.01);与脓毒症组相比,姜黄素干预组淋巴细胞凋亡率明显降低(P<0.05),而姜黄素对照组与假手术组的差异无统计学意义(P>0.05)(图3)。
2.3 姜黄素干预对脓毒症T淋巴细胞线粒体膜电位的影响 经CLP造模后,脾脏淋巴细胞从原先的红光多聚体慢慢释放为绿光单体,差异有统计学意义(P<0.05)。而姜黄素干预后发现,JC-1重新转化为红光多聚体,差异有统计学意义(P<0.05),说明姜黄素干预后,造模后小鼠脾脏淋巴细胞凋亡明显减少(图4,插页)。
2.4 姜黄素对脓毒症小鼠T淋巴细胞Mfn2表达的影响 脓毒症组小鼠在造模24h后取脾脏T淋巴细胞,Mfn2表达(0.473±0.579)较假手术组(2.576±1.139)明显降低,差异有统计学意义(P<0.05);姜黄素干预后,脓毒症组小鼠脾脏T淋巴细胞的Mfn2表达(2.489±0.874)较脓毒症组明显增高,差异有统计学意义(P<0.05)。而姜黄素对照组(2.034±1.337)小鼠脾脏T淋巴细胞的Mfn2表达与假手术组比较无统计学差异(P>0.05)(图 5)。

图3 流式细胞术AnnexinV/PI双染法检测淋巴细胞凋亡(采取右上象限以及右下象限之和来比较各组间的凋亡差异;与假手术组比较,*P<0.05;与脓毒症组比较,△P<0.05)
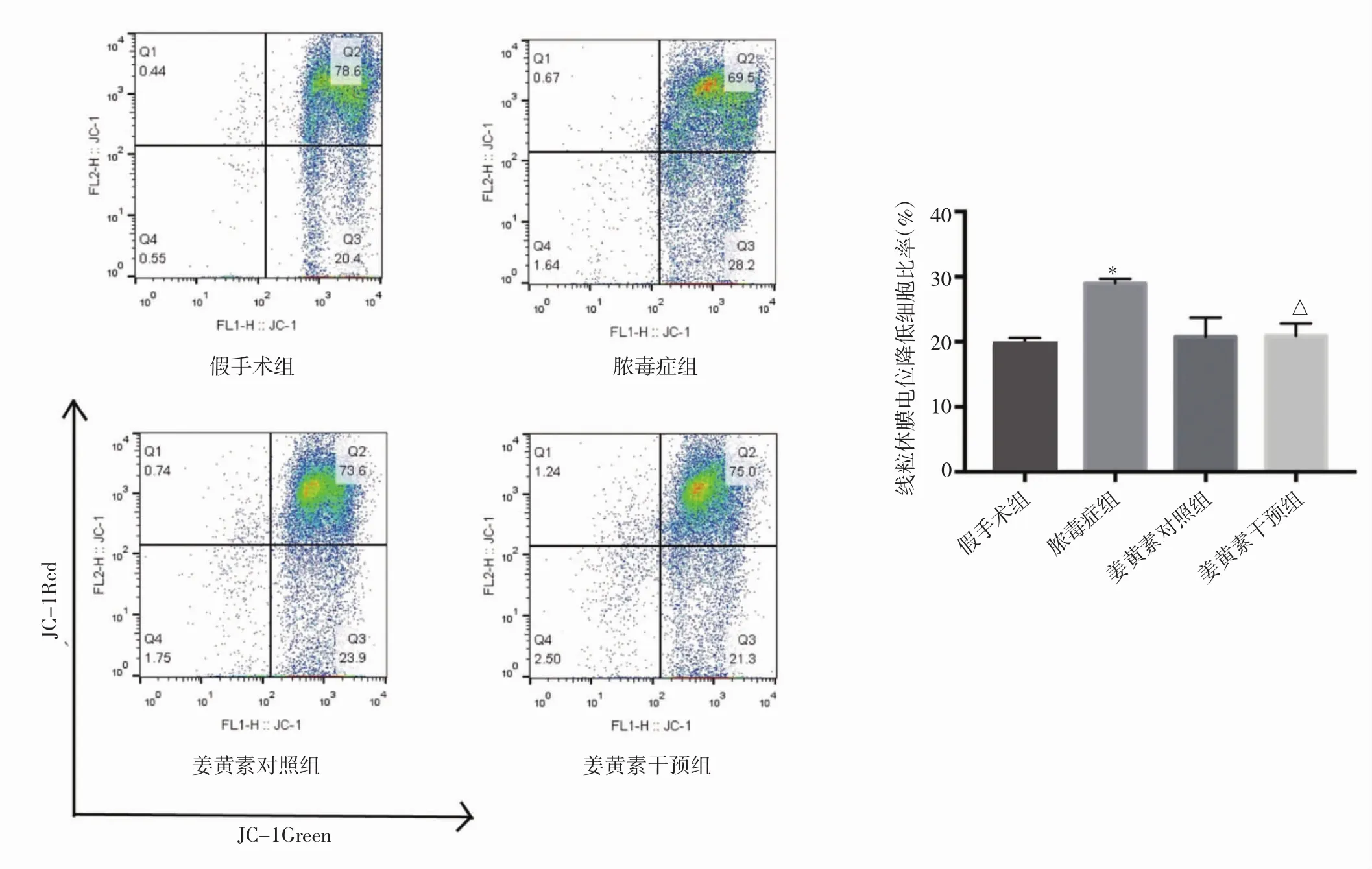
图4 流式细胞术线粒体膜电位的检测(右下角数值代表膜电位降低率;与假手术组相比,*P<0.05;与脓毒症组相比,△P<0.05)

图5 各组小鼠脾脏淋巴细胞的Mfn2表达水平(与假手术组比较,*P<0.05;与脓毒症组比较,**P<0.05)
2.5 下调Mfn2后,姜黄素对脓毒症中淋巴细胞凋亡作用的影响 阴性病毒姜黄素组(25.347±4.099)与阴性病毒脓毒症组(45.507±4.527)比较仍有统计学差异(P<0.01)。而 Mfn2干扰姜黄素组(33.010±3.721)较 Mfn2干扰脓毒症组(27.490±1.595)高,但差异无统计学意义。与阴性病毒脓毒症组比较,Mfn2干扰脓毒症组无统计学差异(图6),说明下调Mfn2后,姜黄素对脓毒症小鼠淋巴细胞凋亡作用的影响降低或者消失。阴性病毒姜黄素组线粒体膜电位降低率较阴性病毒脓毒症组明显降低,差异有统计学意义(P<0.05),而Mfn2干扰姜黄素组线粒体膜电位较Mfn2干扰脓毒症组稍有降低,但差异无统计学意义(图7,插页)。
2.6 下调Mfn2后,姜黄素对脓毒症小鼠Caspase-3、Bcl-2/Bax表达的影响 与假手术组Caspase-3(0.615±0.146)相比,脓毒症组(1.935±0.145)小鼠脾脏淋巴细胞的明显降低,差异有统计学意义(P<0.05),姜黄素干预组(0.868±0.202)较脓毒症组明显升高(P<0.05)。当Mfn2下调后,与Mfn2干扰脓毒症组(1.954±0.770)相比,Mfn2干扰姜黄素干预组 Caspase-3(1.816±0.075)差异无统计学意义(P>0.05)。与假手术组Bcl-2/Bax(1.397±0.272)相比,脓毒症组(0.269±0.101)小鼠脾脏淋巴细胞的明显降低(P<0.05),姜黄素干预组(2.060±1.217)较脓毒症组明显升高(P<0.05)。当Mfn2下调后,与Mfn2干扰脓毒症组(1.014±0.601)相比,Mfn2干扰姜黄素干预组(0.963±0.276)差异无统计学意义(P>0.05)(图 8)。
3 讨论
脓毒症是一种由感染引起的全身炎症反应综合征,其发病率及病死率呈逐年上升趋势,严重威胁着人类生命健康。大量研究表明,大多数晚期脓毒症患者死于免疫抑制而非仅限于炎症反应[17-18]。在脓毒症期间,存在大量T淋巴细胞凋亡,免疫功能紊乱,是组织器官功能障碍和死亡的重要原因[19-20]。迄今为止,脓毒症治疗仍缺乏特效的药物[21]。姜黄素是一种姜科植物姜黄中提取的多酚类物质,是姜黄的主要活性成分之一[22-23]。已被许多研究证实用于治疗脓毒症,但其具体机制尚不清楚。Rana等[24]证明姜黄素提取物可以调节IPAK-MAPK信号通路发挥抗炎作用。而Siddiqui等[25]在一项前瞻性研究中也指出姜黄素可能是通过过氧化物酶体增殖物激活受体-γ的上调对脓毒症小鼠有治疗作用。研究发现,姜黄素能抑制脓毒症T淋巴细胞凋亡,预先给予姜黄素保护则显著上调调节性T淋巴细胞的比例,进而降低脓毒症炎症反应和器官损伤[26]。
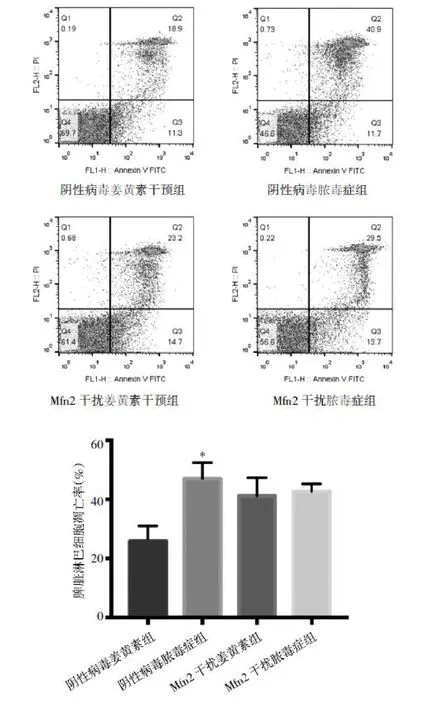
图6 流式细胞术AnnexinV/PI双染法检测淋巴细胞凋亡(与阴性病毒脓毒症组比较,*P<0.05)
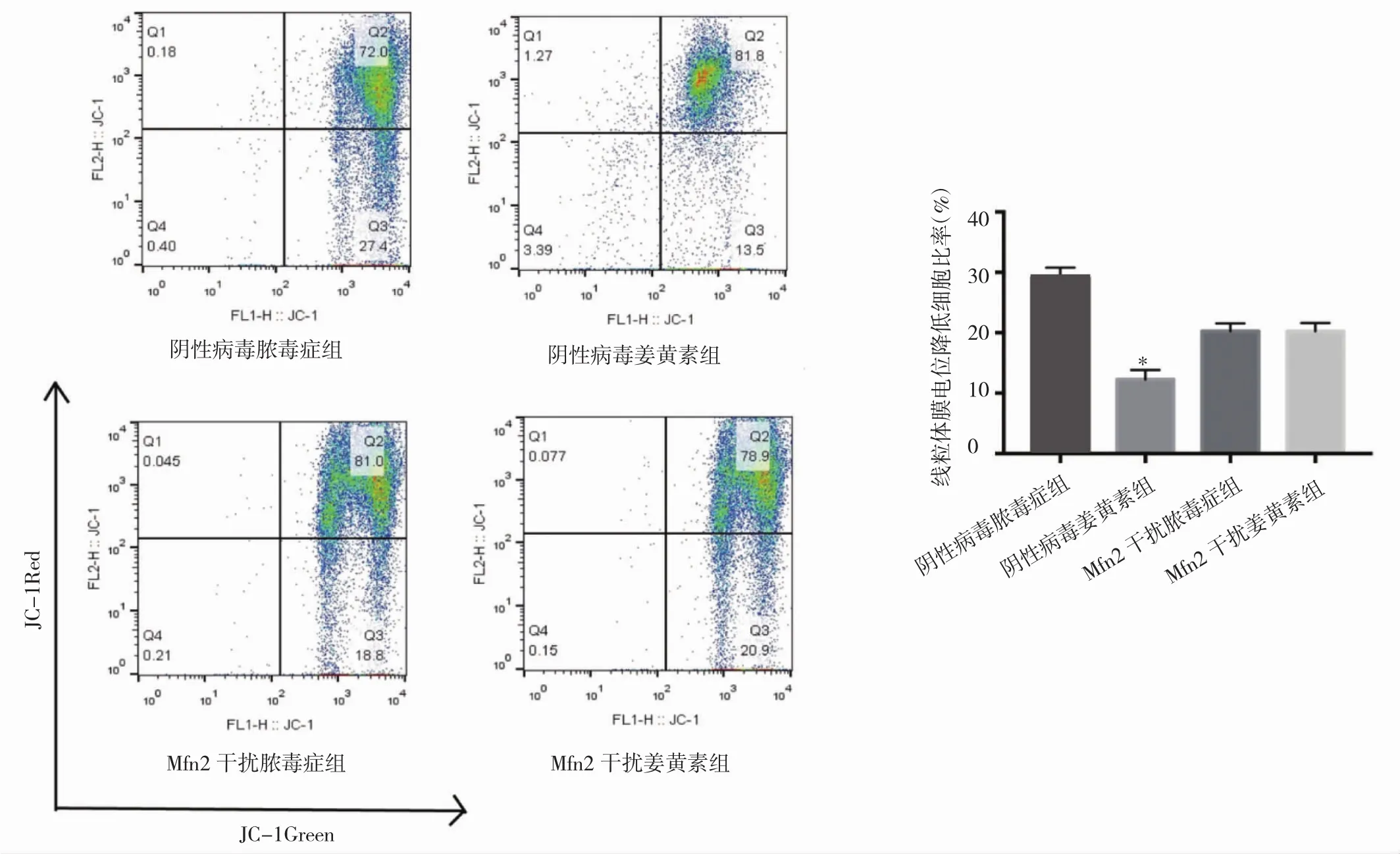
图7 流式细胞术线粒体膜电位的检测(与阴性病毒脓毒症组相比,*P<0.05)
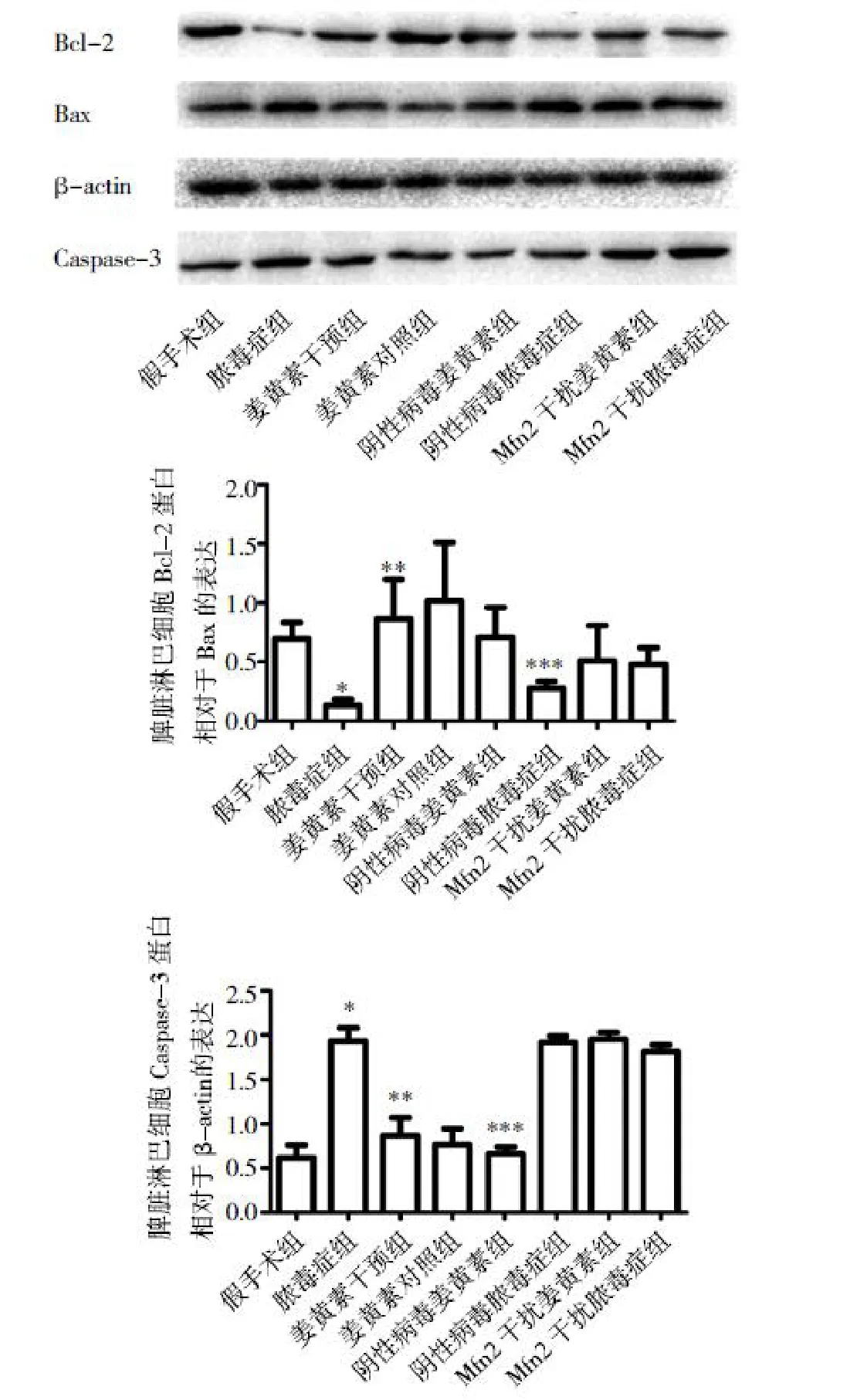
图8 Western blot法检测Caspase-3、Bcl-2/Bax表达水平(与假手术组比较,*P<0.05;与脓毒症组比较,**P<0.05;与阴性病毒姜黄素干预组比较,***P<0.05)
早在2008年Weber等[27]研究发现,在脓毒症中,T淋巴细胞在循环系统中表现出广泛的细胞凋亡,并提出该细胞在脓毒症中起重要作用。细胞凋亡主要通过死亡受体活化途径、线粒体途径以及内质网途径3条途径调控,其中线粒体途径在细胞凋亡过程中最为重要。线粒体是一种动态细胞器,根据细胞的需要,不断移动,融合和分裂,形成动态平衡[28-29]。越来越多的证据表明,这种线粒体稳态对先天免疫反应和T细胞功能有重要影响[30-31]。脓毒症期间,线粒体稳态失衡是其导致细胞凋亡及器官衰竭的重要原因之一。其中Mfn2是治疗许多疾病的靶基因,也是维持线粒体稳态的关键蛋白[32-33]。研究发现,脓毒症小鼠的Mfn2表达较假手术组明显降低,而姜黄素干预后,Mfn2表达较脓毒症组升高,符合姜黄素改善线粒体重塑的研究[34]。
本研究中同样发现姜黄素可有效抑制脓毒症小鼠淋巴细胞线粒体途径凋亡,而T淋巴细胞凋亡的减少可以降低脓毒症小鼠的死亡率,从而增强机体的免疫功能,并对脓毒症起到保护作用[35-36]。Bcl-2是凋亡抑制蛋白,而Bax是凋亡促进蛋白,主要存在于细胞质中,在细胞受到凋亡刺激的情况下,细胞质中Bax蛋白转移到线粒体中。Bcl-2/Bax变化能准确的反映细胞凋亡情况,脓毒症组较正常组明显降低,而姜黄素组该比值较脓毒症组升高;Caspase-3是一种经常被激活的死亡蛋白酶,催化许多关键细胞蛋白的特异性切割,对于细胞的解体和凋亡小体的形成相关的某些过程是必需,本研究发现姜黄素可以降低脓毒症Caspase-3的高表达,流式细胞术和线粒体膜电位也进一步明确了姜黄素的作用。而下调Mfn2后,姜黄素的上述作用较上调前明显降低,说明姜黄素是通过Mfn2来降低淋巴细胞凋亡。此外,还需要进一步研究以提高其生物利用度,如纳米粒子12或环孢菌素纳米乳剂[37],或通过药物和其他方法的组合来提高姜黄素的疗效[38]。
总之,姜黄素可通过Mfn2导致淋巴细胞凋亡减少,从而增强脓毒症小鼠的免疫功能。本研究表明,姜黄素干预对脓毒症小鼠有保护作用,并且该作用依赖于Mfn2。虽然已经证实Mfn2在这方面发挥了作用,但仍有必要进一步研究其确切的机制。

