病毒巨噬细胞炎症蛋白Ⅱ对293T细胞APOBEC3G表达的影响
郑国霞 刘如锦 齐燕 王小波 闫玉涛 谭晓华 杨磊
杭州师范大学医学院 310036
人获得性免疫缺陷病毒(HIV)感染和艾滋病(AIDS)的传播流行严重威胁着人类健康。研究发现,一些具较强抑制HIV-1感染功能的天然免疫因子如载脂蛋白B mRNA 编辑酶催化多肽样蛋白3G(APOBEC3G),其表达水平与HIV-1 感染和疾病进展相关[1-2]。在细胞水平上,增加 APOBEC3G 表达量能有效抑制HIV-1 感染[3]。有研究显示,干扰素α(IFN-α)可以明显诱导APOBEC3G的表达[4-6]。经典的 IFN-α 诱导 APOBEC3G 转录途径是,STAT1:STAT2 异源二聚体同干扰素调节因子(IRF)9 形成复合体,该复合体再结合到IFN应答相关基因启动子的顺式反应元件上(ISRE)[4]。Rose 等[7]的研究表明,在永生化的CD4+T细胞系,佛波酯可以通过PKCа/MEK/ERK 途径诱导 APOBEC3G 表达。Kaposi 肉瘤(Kaposi′s sarcoma,KS)是 AIDS 患者最常见的并发症及死因,KS 相关病毒(KSHV)是KS的病原。研究发现[7-8],KSHV K4 基因编码的病毒巨噬细胞炎症蛋白Ⅱ(vMIP-Ⅱ)能封闭HIV 辅助受体,具有抗HIV感染的功能。Cherqui等[9]用基因芯片筛选到转染vMIP-Ⅱ基因后的人脐静脉内皮细胞中APOBEC3G 上调了8.70 倍。我们在预实验中采用同样的基因芯片筛选KS患者肿瘤组织中差异表达基因,也发现APOBEC3G 表达上调。因此,推测vMIP-Ⅱ可能通过激活APOBEC3G 表达来抵抗HIV 感染。本研究探讨vMIP-Ⅱ对APOBEC3G 表达的影响,初步探讨其调控机制。
材料与方法
一、材料
胎牛血清白蛋白(以色列Biological Industries公司)。绿色荧光蛋白质粒pEGFP-N3由北京大学医学院惠赠。pEGFP-N3-K4质粒[中美泰和生物技术(北京)有限公司],萤火虫荧光素酶报告基因(pGL3)质粒(上海捷瑞生物工程有限公司),海肾荧光素酶质粒(美国Promega 公司)。胎牛血清(FBS)、DMEM培养基(澳洲HyClone公司)。IFN-α储存液(美国Thermo 公司),U0126(ERK 信号通路抑制剂)干粉、AG490(JAK/STAT信号通路抑制剂)干粉(美国Sigma 公司)。β 肌动蛋白抗体(德国Cell Signaling Technology 公司),兔抗vMIP-Ⅱ一抗(美国R&D 公司),兔抗APOBEC3G 一抗(美国EPIT MICS 公司),辣根过氧化物酶标记的山羊抗兔二抗、辣根过氧化物酶标记的山羊抗鼠二抗(美国Bio-RAD公司)。cDNA第一链合成试剂盒(天根生化科技有限公司)。Lipofectamine™2000 转染试剂盒(美国Thermo公司)。
大肠杆菌DH5α 及293T 细胞为课题组实验室保存,293T 细胞用含 10%FBS、100 U/ml 青霉素和100 μg/ml链霉素(上海碧云天生物技术有限公司)的DMEM(美国Gibco公司)培养液在37 ℃、5%CO2细胞培养箱中培养。
二、方法
1.vMIP-Ⅱ对 293T 细胞 APOBEC3G 表达的影响:按Lipofectamine™2000 说明书操作,分别转染空质粒pEGFP-N3(以下简称空质粒)和重组质粒pEGFP-N3-K4(以下简称转染vMIP-Ⅱ质粒)至293T 细胞,转染前3 ~4 h 换为无血清无双抗的DMEM培养基,转染4 ~6 h后换成有血清新鲜培养基继续培养36 h,倒置荧光显微镜观察细胞绿色荧光蛋白的表达,确定重组质粒转染成功并达到了下游实验的要求后(图1),提取两组细胞总蛋白及总RNA,采用 Western 印迹法检测 vMIP-Ⅱ 和APOBEC3G 蛋白水平;qPCR 检 测 APOBEC3G mRNA水平。
2.vMIP-Ⅱ和IFN-α 对 APOBEC3G 表达的影响:用125、250、500、1 000 IU/ml IFN-α处理293T细胞,以加入相同体积0.5%BSA作为对照,36 h后离心收集细胞并抽提细胞总RNA 及总蛋白质,以总RNA 逆转录的cDNA 为模板,采用qPCR 进行相对定量(以对照组mRNA相对表达为1),采用Western印迹法检测APOBEC3G 的蛋白水平。取步骤1 中转染vMIP-Ⅱ质粒、转染空质粒的293T 细胞,分为空质粒组、vMIP-Ⅱ质粒组、空质粒 + IFN-α(1 000 IU/ml)组、vMIP-Ⅱ质粒 +IFN-α(1 000 IU/ml)组,培养36 h 后,按Western 印迹法检测各组细胞APOBEC3G蛋白水平,以空质粒组作为对照组进行数据分析。
3.AG490和U0126对APOBEC3G表达的影响:取步骤1 中转染vMIP-Ⅱ质粒、转染空质粒的293T细胞,用不同浓度的JAK/STAT 信号通路的抑制剂AG490(5、20、50、75、100 μmol/L)和不同浓度的ERK信号通路抑制剂U0126(2.5、5、10、20、40 μmol/L)分别处理,以添加相同体积0.5%BSA为对照组,24 h后收集细胞并提取总RNA,qPCR 检测APOBEC3G mRNA水平。以空质粒组APOBEC3G表达量为“1”,计算各组细胞mRNA水平相对表达水平。
对转染vMIP-Ⅱ质粒的293T 细胞,分别用75 μmol/L AG490和20 μmol/L U0126处理,以vMIP-Ⅱ质粒组为对照,24 h后收集细胞总蛋白,Western印迹法检测各组APOBEC3G蛋白水平。
4.Western印迹实验:磷酸盐缓冲液(PBS)漂洗细胞 2 次,吸净 PBS 后,每孔加入含 100 μg/ml 苯甲基磺酰氟的 RIPA 裂解液150 μl,冰上静置30 min,收集至 1.5 ml 的EP 管中,于 4 ℃、12 000 r/min 离心20 min(离心半径为4 cm),吸取上清液,BCA 法测定蛋白浓度。配平蛋白浓度,取30 ~80 μg总蛋白上样,经十二烷基硫酸钠聚丙烯酰胺凝胶电泳后,转移至聚偏二氟乙烯膜上,5%脱脂奶粉室温封闭1 h。加入一抗,4 ℃孵育过夜,加入辣根过氧化酶标记的二抗,室温孵育1 h。电化学发光法发光,曝光,扫描。应用ImageJ软件对检测结果图进行灰度值分析。
5.mRNA 提取、RT-PCR 和实时荧光定量PCR检测mRNA 的表达:293T 细胞经处理后提取总RNA,用1%琼脂糖凝胶电泳检测其完整性,应用逆转录试剂盒合成cDNA第1链,采用特异性引物[生工生物工程(上海)有限公司]进行实时荧光定量PCR 检测 APOBEC3G 和 vMIP-Ⅱ mRNA 表 达,APOBEC3G正向引物5′-CACGTGAGCCTGTGCATC TTC-3′,反向引物5′-TTGGCTGTGCTCATCTAGTCC ATC-3′;GAPDH 正向引物5′-GCACCGTCAAGGCT GAGAAC-3′,反向引物 5′-ATGGTGGTGAAGACGC CAGT-3′。以 GAPDH 为内参基因,2-ΔΔCt法计算mRNA的相对表达量。
6.APOBEC3G 基因上游转录调控区域的生物信息学分析:用SignalScan 对APOBEC3 基因上游2 000 bp(-2000/-1)进行预测对比(http://thr.cit.nih.gov/cgi-bin/molbio/signal),发现 APOBEC3G 的转录因子和顺式反应元件主要位于其翻译起始位点上游1 560 bp 至 240 bp 之间(-1560/-240)。用在线启动子软件对APOBEC3G 基因上游2 000 bp的区域进行启动子位置预测。在http://snpper.chip.org/mapper/mapper-top 网站,同时选取TRANSFAC matrices、TRANSFAC factors 和 JASPAR matrices 模式以及 http://www.flruitfly.org/seg_tools/promoter.html多个启动子相关网站分析APOBEC3G翻译起始点上游2 000 bp 范围内可能的转录调控区序列(转录因子结合位点的顺式作用元件)。
7.双荧光素酶报告基因系统检测APOBEC3G启动子上受vMIP-Ⅱ调控的主要作用区域:PCR 扩增APOBEC3G 启动子序列,分别将起始密码上游的 240、330、360、420、480、720、960、1 560 bp 大小片段克隆到萤火虫荧光素酶报告基因(pGL-3)载体上游,构建APOBEC3G 启动子荧光素酶报告基因质粒,基因克隆实验送至上海捷瑞生物工程有限公司完成。以表达海肾荧光素酶的质粒为内参质粒。先将2.5 μg vMIP-Ⅱ质粒、荧光素酶报告基因质粒(PGL3-APOBEC3G片段)以及2.5 ng海肾荧光素酶质粒共转染入293T细胞中,24 ~48 h后,在荧光显微镜下观察同一视野下的细胞数与显示荧光的细胞数,转染效率(荧光细胞比例)大于30%时进行下一步实验。
由于重组萤火虫荧光素酶的表达载体上有APOBEC3G启动子调节序列,因此转染后的荧光素酶活性反映启动子的活性。构建APOBEC3G 启动子荧光素酶报告基因重组质粒,APOBEC3G启动子序列包括APOBEC3G 的全长启动子序列(POS)与长度 1 560、960、720、480、420、360、330、240 bp 片段及APOBEC3G启动子序列中不含调控元件的区域(NEG),将荧光素酶报告基因重组质粒与vMIP-Ⅱ质粒共转染的293T 细胞为实验组,以与空质粒共转染293T 细胞为对照,同时转染海肾荧光素酶质粒为内参,通过比较两组细胞萤火虫荧光素酶与海肾荧光素酶的活性比值判断细胞内APOBEC3G启动子的活性。荧光素酶活性检测按照美国Promega公司双荧光素酶报告基因检测试剂盒说明书操作。
三、统计学方法
采用SPSS 13.0软件,配对资料的比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
结 果
一、vMIP-Ⅱ对APOBEC3G表达的影响
Western印迹法显示,vMIP-Ⅱ质粒组出现与预期蛋白大小一致的条带,而空质粒组未出现蛋白条带(图2A),重组质粒转染成功。将空质粒组APOBEC3G mRNA 表达值设为1,结果显示,vMIP-Ⅱ转染组相对表达量为2.500±0.013,差异有统计学意义(t=6.22,P< 0.01)。Western 印迹法显示,vMIP-Ⅱ转染组 APOBEC3G 蛋白水平(1.472 ±0.013)高于空质粒组(0.364 ± 0.030),差异有统计学意义(t=6.54,P< 0.05)(图2B)。
二、vMIP-Ⅱ和IFN-α对APOBEC3G表达的影响

图2 Western印迹法检测293T细胞转染空质粒和病毒巨噬细胞炎症蛋白Ⅱ(vMIP-Ⅱ)基因质粒的产物2A:vMIP-Ⅱ质粒组出现与预期蛋白大小一致条带,而空质粒组未出现蛋白条带;2B:vMIP-Ⅱ质粒转染组载脂蛋白B mRNA编辑酶催化多肽样蛋白3G(APOBEC3G)水平高于空质粒组
对照组与125、250、500、1 000 IU/ml IFN-α 组APOBEC3G mRNA 相对表达及蛋白水平差异均有统计学意义(P< 0.001),1 000 IU/ml组APOBEC3G mRNA 及蛋白水平均高于对照组(t值分别为6.12、5.57,P< 0.001),见表1、图3。
Western 印迹法显示,空质粒组、vMIP-Ⅱ质粒组、空质粒 + IFN-α 组、vMIP-Ⅱ质粒 + IFN-α 组APOBEC3G 的蛋白水平(1、2.030 ± 0.108、2.700 ±0.081、2.600 ± 0.099)差异有统计学意义(F=67.026,P< 0.001),后3 组均高于空质粒组(t值分别为3.04、4.73、4.82),vMIP-Ⅱ质粒组与空质粒 +IFN-α 组差异无统计学意义(t=3.46,P> 0.05),见图4。
三、AG490和U0126对APOBEC3G表达的影响
0(对照组)、5、20、50、75、100 μmol/L AG490处理的空质粒组、vMIP-Ⅱ质粒组APOBEC3G mRNA水平差异有统计学意义(P< 0.001),20、50、75、100 μmol/L AG490 处理的空质粒组均低于对照组(t值分别为 4.67、4.56、5.79、3.84,P< 0.05);空质粒组mRNA 水平均低于相应浓度的vMIP-Ⅱ质粒组(P< 0.05)。见表2。0(对照组)、2.5、5、10、20、40 μmol/L U0126 处理的空质粒组、vMIP-Ⅱ质粒组APOBEC3G mRNA 水平差异有统计学意义(P<0.001),2.5、5、10、20、40 μmol/L U0126 处理的空质粒组均低于对照组(t值分别为 9.18、5.79、5.09、4.92、6.03);空质粒组mRNA水平均低于vMIP-Ⅱ质粒组(均P< 0.01)。见表3。
Western 印迹法显示,转染vMIP-Ⅱ质粒的293T细胞,对照组、AG490组、U0126组APOBEC3G蛋白水平分别为 0.617 ± 0.025、0.179 ± 0.061、0.359± 0.012,差异有统计学意义(F=70.019,P<0.001),AG490组、U0126组水平均低于对照组(t值分别为9.66、11.836,P< 0.01),AG490 组水平低于U0126组(t=7.22,P< 0.01)。见图5。
四、vMIP-Ⅱ调控APOBEC3G转录活性的关键启动子作用区域
荧光素酶活性检测结果显示,转染了POS、1 560、960、720、480、420、360、330、240、NEG 序列的vMIP-Ⅱ质粒组启动子活性差异有统计学意义(F=81.092,P< 0.001),随着转染的克隆片段的截短,APOBEC3G 启动子活性呈降低趋势,从720 片段至 480 片段活性降低幅度巨大,480、420、360、330、240、NEG片段的启动子活性相差不大(图6)。
表1 不同浓度干扰素α对239T细胞载脂蛋白B mRNA编辑酶催化多肽样蛋白3G(APOBEC3G)mRNA及蛋白表达的影响()

表1 不同浓度干扰素α对239T细胞载脂蛋白B mRNA编辑酶催化多肽样蛋白3G(APOBEC3G)mRNA及蛋白表达的影响()
注:n=3。qPCR检测mRNA水平,以对照组APOBEC3G mRNA水平为1,计算各组相对水平;Western印迹法检测APOBEC3G蛋白水平。a 与对照组比较,P <0.001
APOBEC3G mRNA蛋白水平0(对照组)1 0.104±0.098 125 IU/ml 1.508±0.098 0.118±0.046 250 IU/ml 1.897±0.011 0.118±0.046 500 IU/ml 1.755±0.058 0.178±0.006 1 000 IU/ml 2.045±0.007a 0.204±0.035a F值80.541 69.830 P值<0.001<0.001

图3 Western 印迹法检测不同浓度干扰素α 对239T 细胞载脂蛋白B mRNA 编辑酶催化多肽样蛋白3G(APOBEC3G)水平的影响1 000 IU/ml干扰素α组APOBEC3G蛋白水平高于对照组 图4 Western印迹法检测转染空质粒、vMIP-Ⅱ质粒及干扰素(IFN)α对293T细胞载脂蛋白B mRNA编辑酶催化多肽样蛋白3G(APOBEC3G)蛋白水平的影响 vMIP-Ⅱ质粒组、空质粒+IFN-α组水平均高于空质粒组
表2 不同浓度JAK/STAT信号通路抑制剂(AG490)对分别转染空质粒与vMIP-Ⅱ质粒的293T细胞APOBEC3G mRNA表达的影响(2-ΔΔCt,)

表2 不同浓度JAK/STAT信号通路抑制剂(AG490)对分别转染空质粒与vMIP-Ⅱ质粒的293T细胞APOBEC3G mRNA表达的影响(2-ΔΔCt,)
注:n=3。vMIP-Ⅱ:病毒巨噬细胞炎症蛋白Ⅱ;APOBEC3G:载脂蛋白B mRNA编辑酶催化多肽样蛋白3G。a 与对照组相比,P <0.05
组别AG490 F值P值空质粒组vMIP-Ⅱ质粒组t值P值0(对照组)1.00 2.089±0.456 8.23<0.01 5 μmol/L 1.042±0.063 1.972±0.003 7.90<0.01 20 μmol/L 0.474±0.045a 1.207±0.033 8.05<0.05 50 μmol/L 0.516±0.035a 1.148±0.014 9.51<0.01 75 μmol/L 0.301±0.034a 0.837±0.006 6.52<0.001 100 μmol/L 0.521±0.004a 0.987±0.085 6.52<0.001 80.430 68.076<0.001<0.001
表3 不同浓度ERK信号通路抑制剂(U0126)对分别转染空质粒与vMIP-Ⅱ质粒的293T细胞APOBEC3G mRNA表达的影响(2-ΔΔCt,)

表3 不同浓度ERK信号通路抑制剂(U0126)对分别转染空质粒与vMIP-Ⅱ质粒的293T细胞APOBEC3G mRNA表达的影响(2-ΔΔCt,)
注:n=3。vMIP-Ⅱ:病毒巨噬细胞炎症蛋白Ⅱ;APOBEC3G:载脂蛋白B mRNA编辑酶催化多肽样蛋白3G。a 与对照组相比,P <0.05
组别空质粒组vMIP-Ⅱ质粒组t值P值0(对照组)1.00 2.062±0.135 6.02<0.01 2.5 μmol/L 0.963±0.035a 2.306±0.148 4.72<0.01 U0126 5 μmol/L 0.989±0.078a 1.983±0.026 7.80<0.01 10 μmol/L 0.954±0.121a 2.009±0.128 7.54<0.01 20 μmol/L 0.961±0.067a 1.978±0.030 8.28<0.01 40 μmol/L 0.964±0.047a 1.912±0.028 6.03<0.01 F值69.031 70.309 P值<0.001<0.001
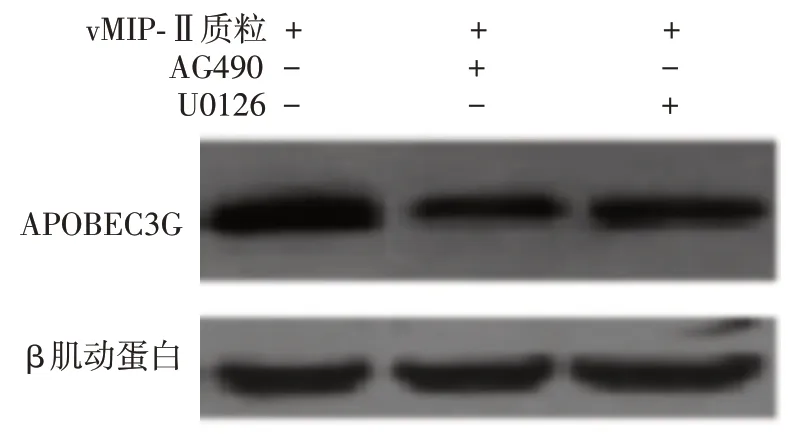
图5 Western 印迹法检测转染病毒巨噬细胞炎症蛋白Ⅱ(vMIP-Ⅱ)质粒的293T 细胞采用AG490(JAK/STAT 信号通路抑制剂)、U0126(ERK 信号通路抑制剂)处理后载脂蛋白B mRNA 编辑酶催化多肽样蛋白3G(APOBEC3G)蛋白表达

图6 双荧光素酶报告基因系统检测APOBEC3G 启动子上vMIP-Ⅱ上调APOBEC3G 表达的主要作用区域 随着转染的克隆片段的截短,APOBEC3G启动子活性呈降低趋势,从720 bp片段至480 bp 片段活性降低幅度巨大,480、420、360、330、240 bp 及NEG片段的启动子活性相差不大
讨 论
早期流行病学研究发现,并发KS 的艾滋病患者相对于并发其他疾病者存活时间更长[10],之后,在KSHV 感染的细胞中以及转染KSHV 某些基因的细胞中均发现一些抗HIV 基因表达上调[11]。Cherqui 等[9]发现,KSHV vMIP-Ⅱ基因使人脐静脉内皮细胞内CCL5、APOBEC3G、ISG-15 和OAS-1 等多条抗HIV 基因表达明显上调。以上研究提示,KSHV 的某些基因能以上调宿主抗HIV 基因表达的方式抑制HIV 感染。APOBEC3G 属于胞嘧啶脱氨酶家族成员,含两个胞嘧啶脱氨酶结构域,通过诱导HIV-1 基因组发生致死性突变等方式抑制HIV-1 感染[12-13]。本研究证实,vMIP-Ⅱ可以上调APOBEC3G 基因表达,且其上调APOBEC3G 的能力与IFN-α相当。
对 APOBEC3G 转录水平调节的研究[14-15]表明,JAK-STAT 通路是调控APOBEC3G 表达信号的主要信号通路,受不同细胞因子的刺激,相应JAK 分子磷酸化发挥激酶活性,活化不同的STAT 分子形成同二聚体或异二聚体结合到启动子上的干扰素调节因子元件(IFN regulatory factor element,IRF-E)或干扰素反应元件(IFN-stimulated response elements,ISRE)等顺式作用元件上,激活基因的转录。干扰素主要通过JAK-STAT 信号通路上调APOBEC3G 基因表达,而 vMIP-Ⅱ是 KSHV 基因表达的外分泌蛋白,需要与特殊的受体结合才能发挥作用。本研究也发现,vMIP-Ⅱ上调APOBEC3G 的能力与IFN-α 相当。我们使用AG490 阻断JAK/STAT 信号通 路 、U0126 阻 断 ERK 信 号 通路后,vMIP-Ⅱ诱导细胞内APOBEC3G表达的功能均受到抑制,AG490 组 APOBEC3G 表达量低于 U0126 组,提示在vMIP-Ⅱ调控细胞内APOBEC3G 表达的机制中JAK/STAT信号通路发挥了主要作用。
我们进一步从转录水平上研究了vMIP-Ⅱ诱导细胞内APOBEC3G 表达的机制,通过转染不同长度的APOBEC3G 启动子序列与vMIP-Ⅱ质粒至293T细胞中,发现APOBEC3G启动子活性从720片段至480 片段降低幅度巨大,提示vMIP-Ⅱ上调APOBEC3G 表达的关键启动子区域在翻译起始点上游 720 bp 到 480 bp 之间,且 720 bp 到 480 bp 间的调控元件为MZF-1、E47 和MZF1,而已有文献[16]提示,STAT 可上调E47 的表达而启动下游基因的转录。因此,我们推测vMIP-Ⅱ激活APOBEC3G 表达可能机制为,vMIP-Ⅱ与趋化因子受体结合,使细胞内的JAK 分子磷酸化,JAK 发挥激酶活性活化STAT 分子并形成二聚体,转位到细胞核内,结合到APOBEC3G 启动子的E47 调控元件区,启动APOBEC3G 表达,但JAK/STAT 信号通路调控APOBEC3G 启动子活性的具体机制尚需要进一步研究。
总之,vMIP-Ⅱ除了在细胞外与HIV-1 辅助受体CCR5 等结合封闭受体从而抑制HIV-1 进入宿主细胞外,还可能通过结合某些受体,活化JAKSTAT 信号通路,上调APOBEC3G 表达,发挥抑制HIV-1 感染的功能。该假说可以解释vMIP-Ⅱ上调APOBEC3G 表达的现象及其在表达不同受体细胞中抗HIV-1功能的差异。因此,在激活宿主免疫基因抑制HIV 感染方面,vMIP-Ⅱ具有不可忽略的优势。
利益冲突所有作者均声明不存在利益冲突
——一道江苏高考题的奥秘解读和拓展

