T细胞免疫球蛋白和黏蛋白结构域蛋白3抑制银屑病患者CD14+单核细胞分泌白细胞介素12
秦俊霞 秦小卫 赵鹏
山西省人民医院皮肤科,太原 030012
银屑病的发病与多基因遗传背景下的细胞免疫异常密切相关,T 细胞、粒细胞、单核细胞、角质形成细胞、内皮细胞、神经细胞等以及这些细胞之间的复杂相互作用诱导银屑病的发生发展[1]。T细胞免疫球蛋白和黏蛋白结构域蛋白3(T cell immunoglobulin and mucin domain-containing protein 3,TIM-3)是一类T细胞表面抑制性分子,在病毒感染、肿瘤等疾病过程中发挥介导免疫耐受的作用[2-3]。TIM-3 不但可调控T 细胞功能,还在多种抗原提呈细胞中高表达,调控单核巨噬细胞活化,参与机体固有免疫应答[4-5]。TIM-3 在银屑病患者 Th1 和Th17 细胞中的表达降低,诱导并促进炎症应答[6],但TIM-3 对银屑病患者单核细胞的调控作用尚未见相关报道。本研究利用体外细胞培养系统,研究TIM-3对银屑病患者CD14+单核细胞分泌细胞因子功能的调控作用,以期初步阐释TIM-3对固有免疫的调控在银屑病发病中的作用。
对象和方法
一、对象
2017年11月至2018年3月于山西省人民医院皮肤科就诊的寻常型银屑病患者47例,入组标准:年龄≥18 岁且符合《中国银屑病治疗专家共识(2014版)》诊断标准[7]。排除标准:合并恶性肿瘤、合并自身免疫性疾病、合并慢性病毒感染或者长期接受免疫抑制剂治疗。其中,男21 例,女26 例,年龄18 ~ 57(41.8 ± 13.9)岁,银屑病面积和严重程度指数(psoriasis area and severity index,PASI)评分4 ~ 29(8.12± 3.37)分。19例年龄和性别相匹配的健康体检者作为对照组,其中男8例,女11例,年龄18 ~ 65(39.7 ± 10.9)岁。本研究方案已通过山西省人民医院伦理委员会审核[(2017)省医伦审字19号],所有入组志愿者均签署知情同意书。
二、方法
1.外周血单个核细胞(peripheral blood mononuclear cell,PBMC)的分离:清晨空腹留取外周血20 ml,EDTA 抗凝。使用Ficoll 淋巴细胞分离液(美国Sigma 公司),采用密度梯度离心法分离PBMC,冻存于液氮中备用。
2.流式细胞仪检测CD14+细胞TIM-3的表达和IL-12的分泌:每例受试者取106个PBMC,设立2个复孔,每个复孔中加入5 × 105个PBMC,加入含10%胎牛血清的RPMI 1640培养液于37 ℃、5%CO2条件下培养,其中1 个复孔加入Toll 样受体4(Tolllike receptor 4,TLR4)配体脂多糖(lipopolysaccharide,LPS;美国 Invivogen 公司,终浓度为 5 mg/L)和TLR7/8 配体 R848(美国 Invivogen 公司,终浓度为5 mg/L)刺激培养12 h,在刺激培养的后6 h加入布雷非德菌素A(美国BD公司,终浓度为10 mg/L)抑制蛋白转运,另1个复孔不加刺激因子。培养后收集细胞,转入FACS 管中,加入抗CD14-APC(美国eBioscience 公司)和抗 TIM-3-FITC(美国eBioscience公司)进行细胞表面染色,加入抗IL-12-PE(美国eBioscience 公司)进行细胞内染色。使用FACS AriaⅡ流式细胞仪检测,CellQuest Pro软件获取细胞,FlowJo Version 8.7.2软件进行数据分析。
3.角质形成细胞的分离和培养:取10 例寻常型银屑病患者皮损标本置于预冷的0.2%胰酶中冷消化12 h,然后37 ℃热消化30 min,待真表皮分离时转入装有含10%胎牛血清的RMPI 1640 培养液无菌平皿中冲洗,分离表皮,放入离心管中反复吹打,过100目尼龙筛,获取细胞,然后以105/cm2的细胞密度接种于培养瓶中,于37 ℃、5%CO2条件下培养12 h,待细胞贴壁后,强力冲洗去除未贴壁细胞,然后消化贴壁细胞,收集并计数。
4.CD14+单核细胞分选:复苏冻存的PBMC,于4 ℃、300×g离心10 min,收集细胞,加入分离缓冲液重悬细胞,并加入CD14 Microbeads(德国美天旎公司),4 ℃避光孵育15 min。将使用分离缓冲液预处理的分离柱置于分离架上,将上述细胞悬液加入分离柱中,CD14+细胞吸附于分离柱内,从分离架上取下分离柱,加入分离缓冲液,收集CD14+单核细胞并计数。
5.CD14+单核细胞与角质形成细胞共培养系统的建立:取纯化的CD14+单核细胞,加入抗TIM-3抗体(美国R&D 公司,终浓度为10 mg/L)刺激培养12 h,对照组加入对照抗体IgG(美国R&D 公司,终浓度为10 mg/L)培养12 h,洗涤细胞后,取5×105个CD14+单核细胞,与同一患者分离的105个角质形成细胞直接混合共培养,向培养液中加入LPS 和R848刺激培养12 h,在刺激培养的后6 h加入布雷非德菌素A 抑制蛋白转运,收集CD14+单核细胞进行TIM-3和IL-12的流式细胞检测。
6.Western 印迹检测细胞因子信号抑制物1(suppressor of cytokine signaling-1,SOCS-1)表达和抗信号传导及转录激活因子1(signaling transducers and activators of transcription-1,STAT-1)磷酸化:取抗TIM-3刺激后的CD14+单核细胞,加入50 μl 细胞裂解液,冰上裂解15 min 后于95 ℃孵育10 min,收集上清液,加入等量的2×SDS-PAGE 缓冲液,取 30 μl 标本加入 SDS-PAGE 电泳浓缩胶孔中电泳至分离胶后,电转移至PVDF膜。用封闭缓冲液封闭转膜后的PVDF膜后,加入抗SOCS-1抗体(1∶1 000稀释)、抗STAT-1抗体(1∶1 000稀释)、抗磷酸化STAT-1抗体(1∶1 000稀释)或抗GADPH抗体(1∶2 000稀释),4 ℃孵育过夜。洗涤后加入抗兔IgG-HRP(1∶2 000 稀释),室温孵育2 h。所有抗体均购自美国Abcam 公司。洗涤后利用化学发光法显影。使用ImageJ软件对蛋白条带进行灰度检测。
7.统计学方法:所有数据均采用SPSS21.0软件处理,先进行正态性检测,符合正态分布,两组间数据比较采用t检验,相关性分析采用Pearson 检验。P<0.05为差异有统计学意义。
结 果
一、PBMC中CD14+单核细胞表面TIM-3的表达
在无TLR 配体刺激状态下,银屑病组CD14+TIM-3+细胞比例(12.20% ± 2.83%)高于对照组(9.91% ± 1.77%),t= 3.27,P< 0.01。TLR 配体刺激后,与刺激前比较,CD14+TIM-3+细胞比例在银屑病组(6.80% ± 1.11%)和对照组(4.85% ± 1.37%)均显著降低(t=9.86 和12.17,均P< 0.01),但银屑病组仍高于对照组(t=6.06,P< 0.01)。见图1。
二、PBMC中CD14+单核细胞分泌IL-12的水平
在无TLR 配体刺激的状态下,银屑病组CD14+IL-12+细胞比例(0.80%±0.13%)和对照组(0.82%±0.19%)均较低,两组比较,t= 0.453,P= 0.652。TLR 配体刺激后,与刺激前比较,CD14+IL-12+细胞比例在银屑病组(13.49% ± 2.80%)和对照组(28.97% ± 8.97%)均增加(t=13.68 和t=30.99,均P< 0.01),但银屑病组低于对照组(t= 10.71,P<0.01)。见图2。
三、CD14+单核细胞TIM-3表达与IL-12分泌呈负相关
LPS+R848刺激后两组CD14+单核细胞TIM-3表达与IL-12 的分泌均呈显著负相关,对照组r=-0.47,P=0.039;银屑病组r=-0.37,P=0.010。见图3。
四、封闭TIM-3通路对银屑病患者CD14+单核细胞分泌IL-12的影响

图1 对照组和银屑病组外周血单个核细胞中CD14+TIM-3+比例 1A:两组刺激前后CD14+单核细胞表达TIM-3 的流式散点图;1B:两组CD14+TIM-3+细胞比例比较。TIM-3:T 细胞免疫球蛋白和黏蛋白结构域蛋白3

图2 对照组和银屑病组外周血单个核细胞中CD14+单核细胞分泌白细胞介素12(IL-12)水平比较 2A:两组刺激前后CD14+单核细胞表达分泌IL-12 的流式散点图;2B:两组CD14+IL-12+细胞比例比较
使用抗TIM-3 抗体封闭TIM-3 通路可降低CD14+单核细胞 SOCS-1 的表达,IgG 对照组为0.54±0.12,抗TIM-3抗体组为0.08±0.02,t=7.14,P<0.01;STAT-1磷酸化水平则显著升高,IgG对照组为0.34±0.08,抗TIM-3抗体组为0.89±0.10,t=8.96,P< 0.01。见图4A。

图3 对照组和银屑病组CD14+单核细胞T细胞免疫球蛋白和黏蛋白结构域蛋白3(TIM-3)表达与白细胞介素12(IL-12)分泌的相关性分析 3A:对照组;3B:银屑病组
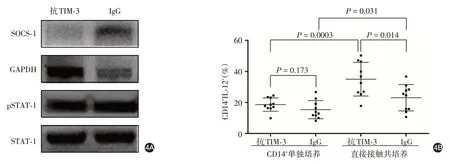
图4 抑制TIM-3对10例银屑病患者CD14+单核细胞下游信号分子和IL-12分泌的影响 4A:SOCS-1、磷酸化STAT-1、总STAT-1的典型Western印迹检测;4B:CD14+单核细胞单独培养及与角质形成细胞共培养系统中的IL-12+细胞比例。TIM-3:T细胞免疫球蛋白和黏蛋白结构域蛋白3;IL-12:白细胞介素12;SOCS-1:细胞因子信号抑制物1;STAT-1:信号传导及转录激活因子1
取10 例银屑病患者CD14+单核细胞,加入抗TIM-3 抗体或对照抗体IgG 培养,单独培养或建立与角质形成细胞的共培养系统。在CD14+单核细胞单独培养系统中,CD14+IL-12+细胞比例在抗TIM-3 抗体处理组(18.63% ± 4.36%)和IgG 处理组(15.33% ± 5.91%)间差异无统计学意义(t= 1.42,P=0.17,图4B);在CD14+单核细胞与自体角质形成细胞的共培养系统中,抗TIM-3 处理组CD14+IL-12+细胞比例(35.02%±10.91%)则显著高于IgG处理组(23.03% ± 8.55%),t= 2.73,P= 0.014,图4B。共培养系统中,抗TIM-3 抗体组与对照组CD14+IL-12+细胞比例均显著高于单独培养系统组(t=4.41和2.34,P=0.0003和0.031,图4B)。
讨 论
TIM-3 作为一种T 细胞表面抑制性因子,主要抑制CD4+和CD8+T 细胞,降低促炎细胞因子的分泌,发挥免疫抑制功能[8]。在银屑病患者中,活化Th1细胞和Th17细胞表面TIM-3表达显著降低,后者使Th1 细胞和Th17 细胞逃避了由TIM-3 介导的负性免疫调控,促进银屑病的发生发展[9]。而新近的研究亦发现,TIM-3还可调控单核巨噬细胞的功能活性。在胃癌[10]、自发性脑出血[11]、疟疾[12]等疾病过程中,CD14+单核细胞中TIM-3 的表达均显著升高,且与疾病进程密切相关。在慢性乙型肝炎患者中,单核细胞的TIM-3高表达可增加促炎细胞因子的分泌和Th17 细胞的应答,促进机体炎症应答[13]。而在慢性丙型肝炎患者中,高表达TIM-3的单核细胞可通过抑制IL-12的分泌发挥负性调控免疫应答的功能[5,14]。
本研究发现,银屑病患者CD14+单核细胞表面TIM-3的表达显著高于对照组。但是,应用TLR配体活化单核细胞后,无论在对照组还是银屑病组,CD14+单核细胞表面TIM-3 的表达均降低,但银屑病组中CD14+TIM-3+的比例仍高于对照组,这与在慢性丙型肝炎中的发现相一致[14]。更为重要的是,TLR配体可诱导CD14+单核细胞分泌IL-12,而银屑病组单核细胞分泌IL-12 的水平较对照组显著降低,且与TIM-3的表达呈负相关。这提示在银屑病中,无论在静息还是活化状态下,CD14+单核细胞中高表达的TIM-3都可能发挥负性免疫调控作用,通过降低IL-12 的分泌发挥抑制单核细胞功能的作用。
本研究发现,银屑病角质形成细胞可诱导CD14+单核细胞表达IL-12,而封闭TIM-3通路可促进角质形成细胞诱导的CD14+单核细胞分泌IL-12水平进一步升高,但其中的分子机制尚未阐明。TIM-3 通路在不同疾病状态下存在不同甚至完全相反的调控效应。在慢性丙型肝炎患者中,TIM-3可与CD14+单核细胞中的SOCS-1相互作用,通过抑制STAT-1 的磷酸化发挥负性免疫调控作用,促进感染慢性化[14]。相反,在肿瘤小鼠模型中,TIM-3可通过抑制STAT-1/miR-155 轴,上调SOCS-1 的表达,增强单核巨噬细胞M2 方向的极化[15]。本研究发现,使用抗TIM-3 抗体封闭银屑病患者CD14+单核细胞中的TIM-3 通路促进STAT-1 的磷酸化,而SOCS-1 表达下降,这与在慢性丙型肝炎中的研究结果[14]相一致。基于伦理原因,本研究未纳入正常人的角质形成细胞,因此,TIM-3 对正常人角质形成细胞介导的细胞因子分泌的影响尚不清楚。但本研究结果仍提示TIM-3可直接调控CD14+单核细胞的功能,参与机体固有免疫应答。
总之,在银屑病患者皮损中,角质形成细胞可诱导银屑病CD14+单核细胞TIM-3 表达升高,从而负性调控CD14+单核细胞介导的固有免疫应答。
利益冲突所有作者均声明不存在利益冲突

