吲哚菁绿荧光导航技术在腹腔镜肝切除术中的应用
张成武
(浙江省人民医院,浙江 杭州 310014,1.肝胆胰外科,2.微创外科)
越来越多的文献表明,腹腔镜肝脏切除术可安全用于肝脏恶性肿瘤的外科治疗。近年来手术经验的积累、技术的成熟、新器械的不断应用(术中超声、3D和4K腹腔镜)和手术理念的更新,进一步拓宽了腹腔镜肝切除术治疗肝癌的手术指征。然而,与开腹肝切除术相比较,腹腔镜肝脏切除术时器械操作活动空间受限、缺乏直接的触觉反馈等因素不利于术中肿瘤准确定位和根治性切除,在一定程度上阻碍了其进一步推广应用。因此,如何更加简便、安全、精准、彻底地切除肿瘤病灶是腹腔镜肝脏切除术的未来发展方向。
吲哚氰绿(indocyanine green,ICG)具有在近红外线激发下产生荧光的特性,已被广泛应用于术中荧光导航,如眼底动脉造影、前哨淋巴结显影等[1-2]。新近ICG荧光图像与腹腔镜白光图像融合技术的发展,使术中荧光图像与腹腔镜手术画面方便地融合在同一显示屏上,极大地促进了ICG荧光导航技术在腹腔镜外科手术中的应用。目前,ICG荧光导航技术已应用于腹腔镜肝脏切除术,包括术中胆道系统的显像、肿瘤病灶的定位和边界判断、发现新病灶、确定肝段解剖界限、评估肝脏组织血供及静脉回流情况等,这些方法的应用使得腹腔镜肝脏肿瘤切除手术的“可视化”成为现实。本文回顾相关文献并结合笔者经验体会,阐述如下。
1 ICG的荧光特性及其在肝胆外科的应用
ICG是具有荧光染料特性的水溶性分子,在机体内与血浆和胆汁中的白蛋白、脂蛋白等高分子蛋白结合后,既不被代谢分解,也不会改变被结合蛋白的分子结构,具有良好的血管内稳定性。静脉内注射后机体无毒性反应,且可在低剂量给药后维持有效作用浓度[3]。实验研究表明,荧光在穿透生物组织的过程中,绝大多数光线被血红蛋白(波长小于700 nm)和水分(波长大于900 nm)吸收中和。ICG分子被波长750~810 nm的光线激发后,发射峰值波长为840 nm的荧光,该荧光波长位于深红和近红外线光谱的“窗口”界限(700~900 nm)内,因而具有最大的组织穿透力,大约10 mm的距离。根据ICG这个特性,距离表面10 mm深部组织内的ICG被激发后发射的荧光可以在近红外光谱区域被探测到,装备有干涉滤光片镜头的相机利用激发光和发射光的波长差异获得信号并形成荧光图像[4]。
研究表明,静脉内注射ICG进入体循环后,ICG分子通过肝细胞活跃的主动转运系统被肝细胞摄取后,分泌至胆道系统最终引流到肠道,不存在肠肝循环。正常肝组织可在12~24 h内彻底清除ICG,肝硬化患者肝组织ICG清除能力相应降低。文献报道,分化型肝细胞癌保留了摄取ICG的能力,但由于缺乏正常的胆管结构,使得ICG在肿瘤组织内积聚滞留。低分化或转移性肝癌细胞虽不摄取ICG,但肿瘤的压迫干扰癌旁肝脏组织ICG通过胆管分泌,在不同程度上影响癌旁肝组织ICG的正常清除,造成局部组织内ICG滞留[5]。这些含ICG的组织或液体可以通过近红外荧光显像设备显示荧光图像,通常是绿色荧光,因此,与正常肝脏组织的红色在腹腔镜融合图像上具有鲜明的视觉对比效果。目前,ICG术中荧光导航技术已在肝胆外科得到广泛应用:利用ICG经胆道分泌排泄的特性进行术中胆道荧光造影,利用其被正常肝组织主动摄取的特点进行术中目标肝段的荧光染色、界定标记,利用ICG在肿瘤或癌旁组织滞留的效应进行术中肿瘤的荧光定位和发现新病灶。另外,ICG荧光导航还可用于腹腔镜肝切除术中肝切面胆漏的判断、肝脏血液供应和静脉回流情况的判断等。
2 腹腔镜肝脏切除术中肿瘤的ICG荧光定位
利用ICG在肝脏肿瘤细胞内或肿瘤组织旁滞留的特性,术中近红外荧光显像技术使得肿瘤“可视化”成为现实,有利于精准切除。荧光探测肝肿瘤基于瘤体或瘤旁有ICG滞留组织与无ICG残留肝组织的荧光对比度。有学者将肝恶性肿瘤ICG荧光显像方式分为全瘤体荧光、部分荧光及瘤体周围环状荧光三类,并认为与肿瘤病理组织类型及分化程度密切相关。大多数高分化肝细胞癌(hepatocellular carcinoma,HCC)表现为全瘤体荧光,中分化HCC常为部分荧光,而低分化HCC或转移性肿瘤则为环状荧光[6]。ICG荧光的组织穿透距离小于10 mm,因此对肝包膜下肿瘤荧光定位效果最为理想(图1)。文献报道ICG近红外荧光导航可发现99%以上的位于肝脏浅表位置的恶性肿瘤病灶[7]。由于荧光的极佳的视觉对比效果,1.5 mm左右大小的病灶也可清晰显示。研究表明,利用术中ICG荧光显像发现术前影像学检查未检测到的病灶,比术中手指触摸、术中超声等具有更高的敏感性,但由于ICG荧光显像假阳性率高达50%左右,因此需要术中超声对新发现病灶进行评估判断,必要时予术中冰冻检查以确定病变性质[8]。在术中ICG荧光导航下,腹腔镜肝肿瘤切除术时能直观、简便、精确地实时定位肝脏浅表位置的肿瘤,同时能清晰显示病灶边界,可使病灶彻底、完整切除,确保安全的手术切缘。特别是严重肝硬化患者,肝表面硬化结节与较小的肿瘤病灶常常难以在肉眼下区分,甚至术中超声有时也不能有效鉴别和定位肿瘤病灶,我们联合应用术中腹腔镜术中超声和ICG荧光导航技术,先利用荧光导航的高度敏感性发现可疑病灶,然后术中超声进一步探测明确病灶后,能准确定位浅表肿瘤并将其完整切除。

图1 肝包膜下HCC呈全瘤体荧光
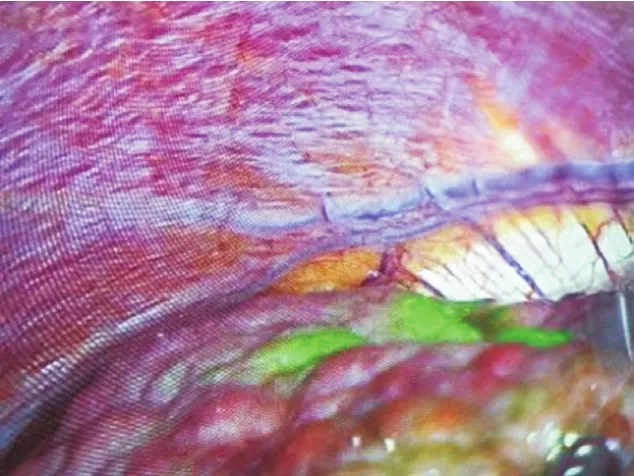
图2 肝硬化合并HCC术中荧光肿瘤定位
虽然手术探查时不能发现位于肝实质深部的肿瘤病灶,但ICG荧光导航在行腹腔镜下肝深部肿瘤局部切除术时仍有重要价值。术中超声虽可定位肝实质深部肿瘤、确定切除范围和肝切面方向及切面深度,但在手术切除时无法真正实现“实时导航”。由于ICG荧光具有10 mm左右的穿透距离,在荧光导航下行深部肿瘤切除时,若切面接近瘤体,将看到隐约显示的绿色荧光,此时及时调整切面方向,可确保在安全切缘内完整切除肿瘤。近年来我们利用术中ICG荧光导航行腹腔镜肝恶性肿瘤切除术32例,其中包括3例尾状叶腔静脉旁部肝癌,均顺利完成手术,所有病灶均获阴性切缘(图3至5)。有学者报道ICG荧光导航下行腹腔镜下肝细胞癌腹腔种植灶切除术,术中发现种植转移灶显示强荧光,利用荧光定位顺利彻底切除病灶,这是因为肝细胞癌具有摄取ICG能力而无法分泌排泄,使ICG滞留在瘤体内。近期我们在ICG荧光导航下行腹腔镜肝癌腹腔种植灶切除术1例,该患者原发性肝癌切除术后3年复查时发现腹腔多发转移瘤,术中新发现多个术前影像学检查未检出的转移瘤,所有瘤体均有荧光染色,总共切除13个病灶,术后患者AFP降至正常范围,随访半年无复发迹象。

图3 腔静脉旁部HCC
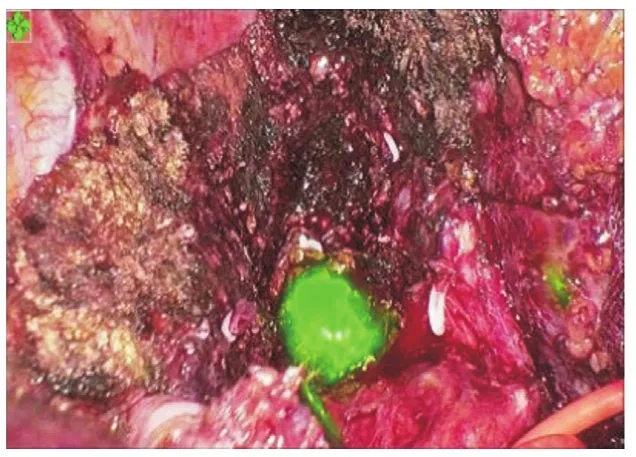
图4 荧光导航下腹腔镜切除肿瘤
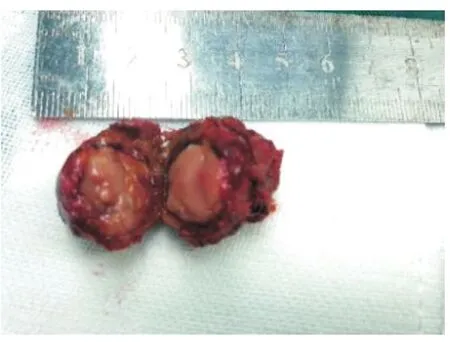
图5 切除标本,切缘阴性
利用ICG荧光导航技术术中发现和定位病灶时,ICG需在术前静脉内给药,其给药时间和剂量目前尚无统一标准。文献报道,术前1~2周内行ICG滞留试验肝储备功能检查时按0.5 mg/kg剂量给药,术中均能较好地使肿瘤病灶荧光显像[7]。但也有学者认为术前1 d静脉注射7.5 mgICG也能达到满意的术中病灶荧光显示效果[9]。我们的经验是,肿瘤病灶荧光显示效果的优劣与肿瘤周围的肝脏背景荧光密切相关,由于严重肝硬化患者肝脏代谢ICG效率明显降低,因此最好至少在术前1周静脉注射ICG以利于非肿瘤肝组织ICG完全清除,以取得较为满意的术中荧光肿瘤定位效果,而肝功能良好的患者可在术前2~3 d完成ICG滞留试验。
3 ICG荧光导航在腹腔镜解剖性肝切除术中的应用
文献报道,解剖性肝脏切除术能显著降低HCC的术后复发率,改善患者预后[10]。术中肝段解剖界限的确定是解剖性肝切除术的技术关键,既往常用的技术是根据肝蒂阻断后肝表面缺血线,以及术中超声引导下穿刺门静脉分支内注射亚甲蓝使目标肝段蓝染来指导解剖性肝段切除术,但精确性较差、难以确定肝段的立体界面,且标记持续时间较为短暂。研究表明,经门静脉注射一定剂量的ICG后,ICG分子在肝细胞内停留时间可达数小时,可较持久地获得相应肝段的三维荧光染色[5]。有学者在开腹解剖性肝切除术中比较经门静脉注射ICG荧光染料与亚甲蓝界定肝段、指导解剖性肝切除的实际应用效果,结果发现ICG荧光染料能更清楚、方便和持久地显示荷瘤肝段在肝实质的三维界限,认为ICG荧光导航可安全、有效地应用于解剖性肝切除术[11]。
术中精准标注肿瘤所在肝段的关键和前提是确定相应的供血血管的解剖情况。由于门静脉和肝动脉以及引流的肝静脉及其分支解剖变异较为常见,术前需要依靠多排螺旋CT等影像学图像3D重建技术,全面了解相应肝段的门静脉解剖情况,并通过虚拟切肝软件明确阻断相应肝蒂门静脉分支后荷瘤肝段的标记效果,来进行手术规划,以在实际手术操作时更好地指导解剖性肝段切除的顺利进行。ICG给药途径的不同,对目标肝段的荧光标识效果也相应不同,将肝段荧光染色的方法分为“正染”和“负染”。“正染”是指在目标肝段的门静脉(或肝动脉)分支里注射ICG,ICG在该肝段肝实质内在近红外线下发出荧光,目标肝段的荧光染色可指导解剖性肝切除术;“负染”是指术中选择性阻断目标肝段的肝蒂血流后,从外周静脉内注射ICG,使除目标肝段外的有血供肝脏实质内ICG荧光显影,而目标肝段无荧光染色获得反衬效果,来确定肝脏切除的平面。
缺乏直接的触觉反馈以及腹腔镜术中超声的检查操作角度的限制通常给腹腔镜解剖性肝切除的开展带来困难,术中实时肝段“可视化”技术将极大地方便腹腔镜解剖性肝段切除术的顺利进行。近年来有学者将ICG荧光导航技术应用于腹腔镜解剖性肝段切除术并取得满意的效果[7,12-13]。按术中肝段荧光染色途径和效果的不同,将腹腔镜肝切除术时肝段ICG荧光染色分为“正染”和“负染”,各有其优点和局限性[14]。ICG荧光术中“正染”肝段时,需要先在超声引导下确定相应的门静脉分支,经皮穿刺门静脉分支注射ICG进行染色,这要求术者有丰富的术中超声引导下穿刺技巧。Sakoda等[15]报道采用腹腔镜术中超声引导下门静脉分支注射ICG进行肝段荧光染色,成功完成2例原发性肝癌完全腹腔镜下解剖性肝段切除术。为避免腹腔镜下门静脉穿刺技术困难,有学者探索在杂交手术室采用放射介入的方法,在目标肝段的供血动脉分支内注射ICG进行“正染”拟切除的肝段,也取得满意的效果[16]。“正染”事前不需要解剖分离相应肝段肝蒂,多应用于右肝的解剖性肝段切除术或者因严重粘连无法肝外解剖阻断肝段的患者。腹腔镜术中荧光染料肝段“负染”要求阻断目标肝段肝蒂或亚肝蒂后,从外周静脉注射ICG,从而使需保留的肝脏组织荧光染色,反衬未染色的肝段。虽然不需要超声引导下门静脉分支穿刺注射,但部分肝段的肝蒂,特别是右后上肝段肝蒂腹腔镜下解剖阻断较为困难,因此通常应用于腹腔镜解剖性半肝切除和左肝的解剖性肝段切除。有学者比较分析ICG荧光导航肝段“正染”和“负染”的效果,结果发现两者均能有效指导解剖性肝段切除术的进行,无显著差异[11]。我们采用Glisson鞘内解剖技术,行选择性阻断相应肝蒂血流后,外周静脉注射ICG荧光导航“负染”方法行腹腔镜下解剖性半肝切除、右肝后叶切除术、右肝前叶切除术和S3切除术,均可获得较为满意肝实质离断界面,使手术顺利完成(图6~7)。

图6 荧光导航“负染”下腹腔镜S3切除术
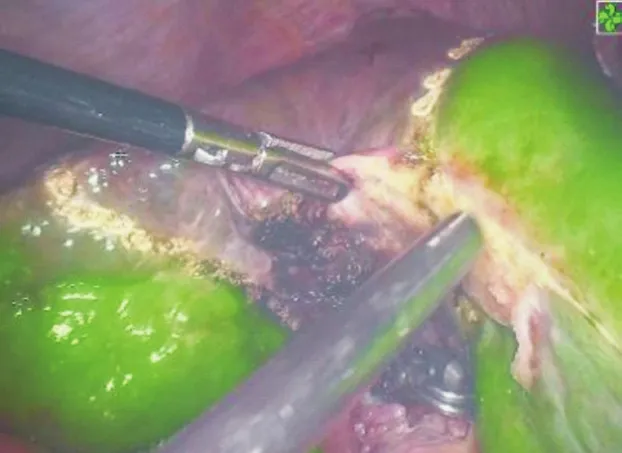
图7 荧光导航“负染”下腹腔镜S5+S8切除术
ICG荧光染色确定肝段解剖界限的实际效果受一些因素的影响。首先,术前行ICG滞留试验评估肝储备功能的患者,如果存在严重的肝硬化,手术时ICG可能清除不彻底残留于肝组织,干扰术中ICG荧光染色,甚至使肝段荧光标识失败。因此,肝硬化患者ICG滞留试验与手术时间间隔尽量延长,以利于术中荧光肝段染色的顺利施行,我们的经验是两者相隔1周以上为宜。其次,ICG荧光染色时所用ICG的剂量与荧光染色效果密切相关。研究表明,ICG在血浆内稀释后,其荧光强度与ICG浓度呈正相关,并在ICG为0.25 mg/mL到达高峰,此后由于近红外光被ICG吸收导致荧光强度减弱。如果门静脉分支内注射ICG量超过相关肝段肝细胞吸收的水平,ICG将可能外溢至肝静脉进入体循环,使得ICG染料在整个肝脏再分布,导致目标肝段的荧光染色对比度明显降低,从而影响判断。目前尚无统一标准,且“正染”与“负染”所用的ICG剂量也不相同。Aoki等[17]报道5 mg ICG门静脉分支注射“正染”肝段的成功率为94%。而Inoue等[11]采用2.5 mg ICG“正染”标记肝段的成功率为100%。最近Miyata等[18]报道术中门静脉分支注射0.25 mg ICG荧光染色目标肝段,30例患者均获满意效果,提示较小的ICG剂量并不影响荧光染色的效果,且可以相应减少发生过敏反应的机会。ICG荧光“负染”肝段时外周静脉注射的剂量各家报道也存在较大差异,从5 mg至1.25 mg不等[7,9]。Terasawa等[7]报道腹腔镜解剖性肝段切除术ICG“负染”时的注射剂量为1.25 mg,12例患者均获得满意标记界面。我们行腹腔镜解剖性肝切除术时曾采用1~5 mg不同剂量ICG施行目标肝段(肝叶)的“负染”,初步体会剂量为1 mg左右的ICG荧光染色效果较为满意,解剖界面的维持时间较长。由于肝动脉血流可能加速ICG染料从目标肝段洗脱,影响荧光染色效果,“正染”时同时阻断相应肝段肝动脉血流将使染色时间更持久。“负染”时目标肝段随时间延长可能被染料逐渐浸染,使得荧光染色界面变得模糊不清,这可能是由于不同肝段间存在侧支循环的缘故,减少ICG剂量可能有一定帮助。
ICG荧光导航技术不仅应用于腹腔镜肝切除术时肿瘤荧光定位和肝段荧光染色,有学者报道利用ICG经胆道分泌的特性,术中可及时发现肝切除创面的胆汁渗漏并予相应处理。也有学者报道ICG荧光染色技术可用于术中评估判断肝脏血供状态以及是否有肝静脉血液回流障碍,以确定是否需要肝静脉重建手术。虽然ICG荧光导航技术在腹腔镜肝切除术中的应用目前仍处起步阶段,其临床应用的方法和价值需要进一步探索和总结,但可以预期,荧光导航技术将使腹腔镜肝切除术进入更加精准的时代。

